作为现代农业中使用最广泛的农药,有机磷农药(organophosphorus pesticides,OPPs)在保护农作物免受虫害和提高农作物产量方面发挥着重要作用[1-2]。不幸的是,由于它在世界范围内的滥用,对水、土壤甚至农产品造成了严重的污染[3]。OPPs进入人体内会引起乙酰胆碱酯酶活性的不可逆抑制,进而导致中枢神经系统的紊乱,甚至威胁生命[4-6]。因此,开发一种灵敏、快速、可靠和经济的方法检测OPPs相当重要。但大多数农药残留检测方法是依赖于大型仪器的实验室分析技术,这些方法灵敏、准确,可用于高通量检测,但通常需要复杂的样品预处理步骤和较长的分析时间,需要训练有素的操作员[7-9]。更重要的是,这些仪器价格昂贵,携带不方便。这些缺点严重限制其广泛应用[8,10]。相比之下,电化学传感检测技术具操作简单、检测迅速、灵敏度高、成本低等优点,非常适合于OPPs残留的简便快捷、灵敏可靠检测[11-13]。
酶抑制法具有检测原理简单、无需大型仪器且易操作等优点,是目前最常用的OPPs快速检测方法。应用在农药残留检测的酶绝大部分是从动物体内分离纯化得到的胆碱酯酶[5-6]。胆碱酯酶提取步骤繁琐、价格高昂,极大地增加了检测成本[14]。有研究发现[6,15],植物酯酶对OPPs具有与胆碱酯酶相似的敏感性,其酶活性也可被OPPs抑制,从而可应用于酶抑制法农药残留检测。此外,植物酯酶广泛存在于植物中,具有提取方法简单,成本低且易于保存的优势[15-17]。因此,以植物酯酶替代胆碱酯酶进行OPPs检测具有可行性和良好的开发应用价值[18]。
随着纳米技术的飞速发展,纳米材料因其独特的光、电、催化等特性而被广泛应用于新型高效生物传感器的开发[7,19-20]。在众多纳米材料中,过渡金属硫族化合物因其比表面积大、优良的电导率和催化性能而受到人们广泛关注和重视[11,21-22]。二硫化钨(WS2)是一种典型的过渡金属硫族化合物[23],具有不同电子结构和性质的两相,分别是1T金属相和2H半导体相。研究表明,1TWS2具有更高的电导率、更强的电荷转移能力和更高的催化活性位点密度,适合构建酶基电化学生物传感器[23-25]。纳米金(AuNPs)因其良好的生物相容性而被广泛用于固定化生物分子以构建生物传感器,并且AuNPs可以促进电子在电极表面和固定化生物分子活性位点之间的传递,通过信号放大提高生物传感器的灵敏度[10,26]。此外,AuNPs与1T-WS2同时用于构建传感平台可实现信号的协同放大,进一步提高传感器的电化学性能[27-28]。然而,目前鲜见利用1T-WS2构建植物酯酶基电化学传感平台的相关研究。
本研究构建来源于白芸豆的植物酯酶基电化学生物传感器,利用1T-WS2@AuNPs纳米复合材料优异的理化性能增敏传感信号,并对其农药检测性能和实际应用性能进行评价。杀螟硫磷检测原理如图1所示,芸豆酯酶(KbE)催化水解底物1-乙酸萘酯(1-naphthyl acetate,1-NA)产生电化学活性物质1-萘酚,当体系中存在农药杀螟硫磷时,KbE活性会被抑制,导致1-萘酚的产生减少,相应的电化学响应信号也会降低,从而实现杀螟硫磷的定量检测。
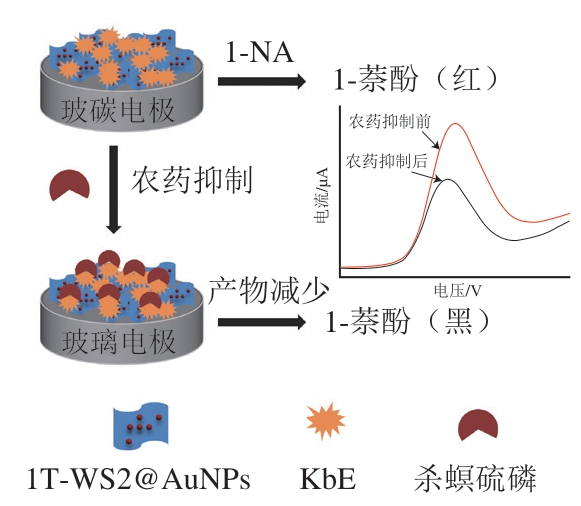
图1 电化学生物传感器检测原理示意图
Fig. 1 Schematic illustration of detection principle for the electrochemical biosensor
1 材料与方法
1.1 材料与试剂
白芸豆、白菜、油菜 贵阳花溪永辉超市;氯化钨、硫代乙酰胺、N,N-二甲基甲酰胺、聚二烯丙基二甲基氯化铵、氯金酸 上海阿拉丁试剂有限公司;壳聚糖(chitosan,CS)(纯度90.0%) 北京索莱宝科技有限公司;1-NA、杀螟硫磷标准品 西格玛奥德里奇(上海)贸易有限公司;Al2O3打磨粉 上海辰华有限公司。若无特殊说明,实验用水均为超纯水(电阻率18 MΩ·cm),所用试剂均为分析纯及以上。
1.2 仪器与设备
CHI660E电化学工作站 上海辰华仪器有限公司;A-10超纯水仪 美国Milipore公司;SB-5200 DTD超声清洗机 宁波新芝生物科技股份有限公司;S-3400N透射电子显微镜(transmission electron microscope,TEM)、SU8010扫描电子显微镜(scanning electron microscope,SEM) 日本日立公司;3K18离心机德国Sigma公司;ESCALAB 250Xi X射线光电子能谱仪(X-ray photoelectron spectroscopy,XPS)、DXRxi显微拉曼成像光谱仪 美国赛默飞世尔科技公司。
1.3 方法
1.3.1 KbE的分离纯化
参照Bao Jing[15]和Yang Limin[16]等的方法,白芸豆洗净晾干后粉碎,称取适量白芸豆粉,按照1∶5(g/mL)比例加入蒸馏水,搅拌30 min,4 ℃浸提过夜,5 000 r/min离心10 min取上清液,即得到KbE粗酶液。采用两步双水相萃取法对KbE粗酶液进行纯化,在聚乙二醇(PEG 1000)与NaH2PO4组成的双水相体系中萃取2~3 h后,弃下相,加入(NH4)2SO4进行第二步萃取,2~3 h后收集下相进行透析处理,最后冷冻干燥得到KbE粉末。
1.3.2 AuNPs的制备
参照Das等[29]的方法并稍作修改。将100 mL超纯水加热至沸腾,在剧烈搅拌下迅速加入1 000 μL质量分数4%聚二烯丙基二甲基氯化铵溶液、800 μL 0.5 mol/L NaOH溶液和400 μL 10 mg/mL的HAuCl4溶液。并在剧烈搅拌下持续加热,直至溶液颜色变成酒红色并不再改变,停止加热,继续搅拌直至溶液冷却至室温。将所得AuNPs溶液装于棕色试剂瓶中,置于4 ℃冰箱保存。
1.3.3 水热法制备1T-WS2[23]
将0.793 2 g的氯化钨和1.502 6 g硫代乙酰胺溶于60 mL N,N-二甲基甲酰胺,搅拌溶解1 h,超声溶解1 h。将上述溶液转移到反应釜中,200 ℃高温下反应24 h。反应终止后冷却至室温,用无水乙醇和超纯水多次洗涤黑色产物,5 000 r/min离心10 min后收集产物,将产物在真空下50 ℃干燥12 h,得到1T-WS2纳米片。
1.3.4 1T-WS2@AuNPs纳米复合物的制备
称取适量1T-WS2纳米片分散于超纯水中,超声分散30 min,得到1 mg/mL 1T-WS2分散液。将1T-WS2分散液与AuNPs溶液按一定体积比混合,超声分散使其充分混匀,得到1T-WS2@AuNP纳米复合物的分散液。
1.3.5 纳米材料的表征
在最优制备条件下,对1T-WS2@AuNPs纳米复合物及1T-WS2纳米片进行表征。用SEM和TEM表征样品的微观形貌和结构,图像采集的加速电压为10 kV和200 kV。用XPS确定样品的元素组成、元素的化学价态以及相的构成,以Al靶(1 486.6 eV)作为激发光源。用拉曼光谱对样品的结构进行鉴定,激发波长为532 nm。
1.3.6 修饰电极的制备
对玻碳电极(glassy carbon electrode,GCE)进行预处理,在含有Al2O3料浆的抛光绒布上打磨数次,依次在丙酮、无水乙醇和超纯水中进行超声清洗,活化后备用。采用滴涂法制备CS/KbE/1T-WS2@AuNPs/GCE修饰电极,在洁净的GCE表面滴涂一定体积的1T-WS2@AuNP纳米复合物分散液,在红外灯下烘干后,滴加一定体积的KbE,室温干燥后在其表面均匀覆盖一层质量分数为0.25%的CS,干燥后得到CS/KbE/1T-WS2@AuNPs/GCE修饰电极。其他修饰电极按照类似方法进行制备,所有酶电极于4 ℃贮存备用。
1.3.7 修饰电极电化学特性测定
以GCE为工作电极,铂丝电极和Ag/AgCl电极分别为对电极和参比电极,在CHI660E电化学工作站上完成电化学测试。采用循环伏安法(cyclic voltammetry,CV)和电化学交流阻抗谱(electrochemical impedance spectroscopy,EIS)分别对经最优制备条件得到的裸电极(GCE)、1T-WS2/GCE、1T-WS2@AuNPs/GCE和CS/KbE/1T-WS2@AuNPs/GCE修饰电极进行测定,以表征传感器组装过程。5 mmol/L K3[Fe(CN)6]/K4[Fe(CN)6](1∶1,c/c)为电解质溶液,CV测试电压范围为-0.4~0.5 V,扫描速率100 mV/s;EIS测试采用相同的电解质溶液,频率范围为1~100 kHz,振幅5 mV。
1.3.8 修饰电极的催化性能测定
将三电极系统浸入含5 mmol/L 1-NA的0.1 mol/L磷酸盐缓冲液反应体系中,采用方波伏安法(square wave voltammetry,SWV)在最优条件下测定CS/KbE/GCE、CS/KbE/AuNPs/GCE、CS/KbE/1T-WS2/GCE、CS/KbE/1T-WS2@AuNPs/GCE对1-萘酚的响应电流值。SWV测试电压范围为-0.1~0.6 V,振幅25 mV,频率为15 Hz。
1.3.9 CS/KbE/1T-WS2@AuNPs/GCE修饰电极制备及测试条件的优化
采用SWV分别考察磷酸盐缓冲液pH值(5.5、6.0、6.5、7.0、7.5、8.0)、1T-WS2与AuNPs体积比(0∶1、1∶0、1∶1、2∶1、3∶1)、1T-WS2@AuNPs负载体积(6~18 μL)、KbE负载量(0.032~0.23 U)以及农药抑制时间(5~25 min)对响应电流的影响,优化电极制备参数。
1.3.10 CS/KbE/1T-WS2@AuNPs/GCE修饰电极的重复性、稳定性及抗干扰性测试
在最优制备条件下,同一批制备5 支修饰电极,并在最优测试条件下分别对同浓度1-NA(5 mmol/L)进行SWV测试。
对同一支CS/KbE/1T-WS2@AuNPs/GCE修饰电极进行连续5 次SWV测试,根据峰电流值变化考察重复性。CS/KbE/1T-WS2@AuNPs/GCE修饰电极不用时置于4 ℃贮存,分别测试贮存15 d和30 d的SWV响应,根据峰电流值的变化考察其稳定性。分别测试5 mmol/L的葡萄糖、柠檬酸、草酸、![]() 50 μg/L百草枯、50 μg/L多菌灵存在时,CS/KbE/1T-WS2@AuNPs/GCE的峰电流信号,根据电流信号变化考察其抗干扰性。
50 μg/L百草枯、50 μg/L多菌灵存在时,CS/KbE/1T-WS2@AuNPs/GCE的峰电流信号,根据电流信号变化考察其抗干扰性。
1.3.11 杀螟硫磷的检测
在最佳条件下,将所构建CS/KbE/1T-WS2@AuNPs/GCE用于杀螟硫磷的检测。将CS/KbE/1T-WS2@AuNPs/GCE浸入含一定浓度底物(1-NA)的0.1 mol/L磷酸盐缓冲液中,进行SWV扫描,得到电流响应I0。电极清洗后,将电极浸入不同浓度的杀螟硫磷标准液中孵化15 min,再次将其浸入含同浓度底物(1-NA)的0.1 mol/L磷酸盐缓冲液中,进行SWV扫描得到电流响应I1。
根据下式计算农药对酶的抑制率:
式中:I0为初始电流值;I1为农药抑制后电流值。
根据酶抑制率与杀螟硫磷质量浓度呈正比的线性关系,以峰电流值为纵坐标、杀螟硫磷质量浓度为横坐标构建标准曲线,其中杀螟硫磷质量浓度设置为0.1、1、10 100、200、500、1 000、2 000 μg/L。
1.3.12 CS/KbE/1T-WS2@AuNPs/GCE修饰电极的实际样品及回收率测试
根据Kumar等[9]的方法稍作修改,将油菜和白菜清洗净晾干后,切碎备用。取2 g油菜样品或白菜样品于10 mL 0.1 mol/L磷酸盐缓冲液中,搅拌10 min混匀,8 000 r/min离心10 min,收集上清液备用。
在上清液中分别添加不同质量浓度的杀螟硫磷(5、100、1 000 μg/L)进行实际样品分析,每组实验平行测定3 次。基于所构建的标准曲线计算实际样品体系中的杀螟硫磷含量,考察检测体系对实际样品的加标回收率和相对标准偏差。
1.4 数据处理
通过Excel统计并分析实验数据,利用Origin 9.0软件绘图。
2 结果与分析
2.1 纳米材料的表征分析
由图2A可知,1T-WS2呈片状,并且1T-WS2纳米片组成了具有大量孔隙的空间结构且结构分布均一。这些空隙一方面能够增加1T-WS2的比表面积,为酶的附着提供更多位点;另一方面也为酶促反应提供了足够的反应环境,促进反应的进行。图2B表明,AuNPs是均匀的球形颗粒,平均粒径为13.5 nm,且较为均匀地附着在1T-WS2的片状表面。
由图2C可知,1T-WS2纳米片中含有钨、硫、氮等元素。从图2D可知,与2H-WS2相比(软件拟合所得),1T-WS2对应的峰向低结合能处偏移了约0.5 eV。同样,硫元素2p高分辨率谱图(图2E)也表现出相似的趋势,以上峰结合能的变化与相关文献报道一致[30],表明本实验制备的1T-WS2纳米片中,1T相占主导地位。为进一步确定1T相的存在,采用拉曼光谱对1T-WS2纳米片的结构进行了鉴定。如图2F所示,在347 cm-1和411 cm-1处有两个明显的特征峰,分别对应于WS2中面内(E12g)和层间(A1g)两种分子振动模式。此外,在低频区域出现了几个新的峰,这文献报道一致[25,30],表明1T-WS2制备成功,这与XPS的表征结果也相对应。
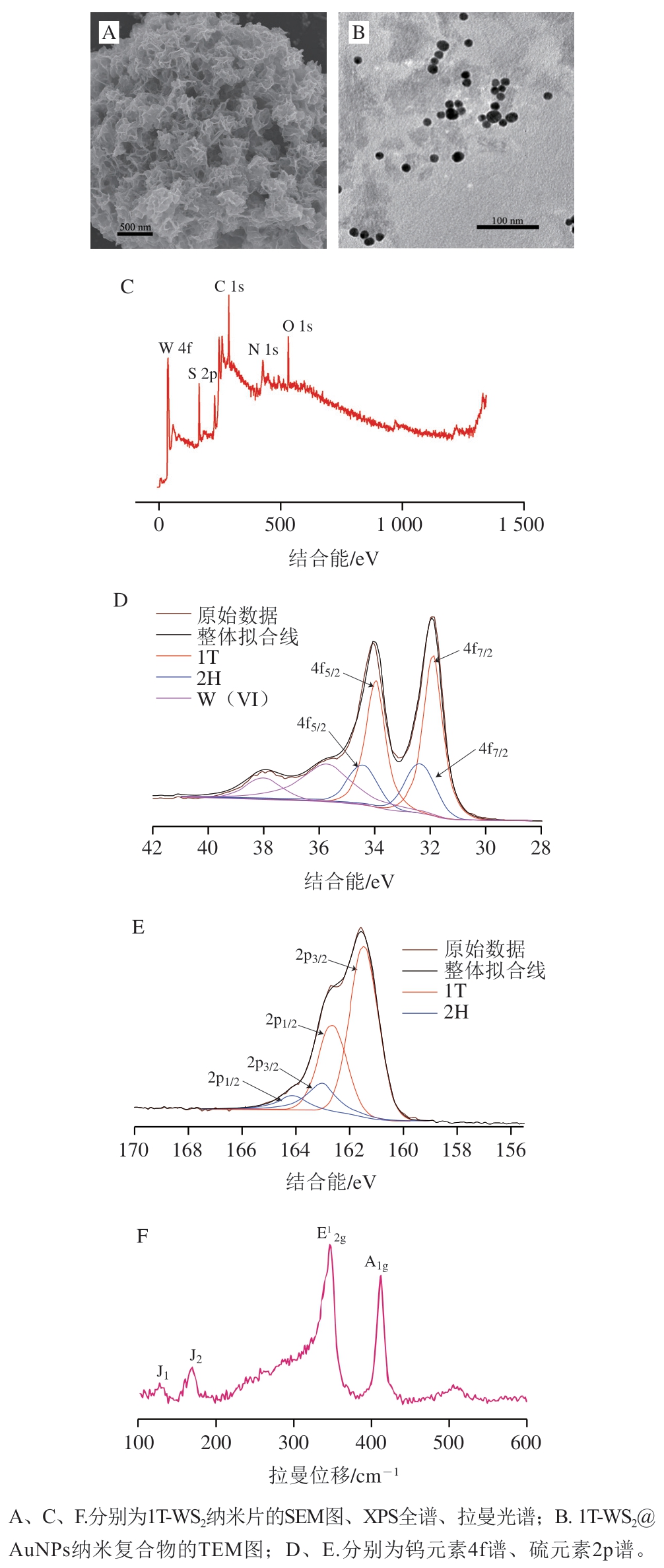
图2 1T-WS2及1T-WS2@AuNPs纳米材料的表征
Fig. 2 Characterization of 1T-WS2 and 1T-WS2@AuNPs nanomaterials
2.2 不同修饰电极的电化学特性分析
如图3A所示,4 种电极均出现一对氧化还原峰。与裸电极相比,1T-WS2/GCE修饰电极上的氧化和还原峰电流明显增大;同时,峰电位差从裸电极的173 mV减小到138 mV,这归因于1T-WS2的高导电性。与AuNPs复合后,Fe2+/Fe3+电对的氧化和还原电流值进一步增大且峰电位差减小至103 mV,表明1T-WS2@AuNPs修饰电极具有更优异的电化学性能,这与AuNPs良好的导电性有关;因此将AuNPs引入1T-WS2可以进一步提高电极的导电性,从而加速电子的传递。由于KbE和CS为不导电的生物分子,阻碍了电子的传递,所以观察到CS/KbE/1TWS2@AuNPs/GCE修饰电极上的氧化还原电流下降且峰电位差增加。
进一步研究不同修饰电极的电化学特性,如图3B所示,每条曲线都是由高频区的一个半圆与低频区的一条直线组成,其中高频区的半圆直径大小反映了电极的电荷转移电阻大小。1T-WS2@AuNPs/GCE修饰电极的半圆直径最小,即电荷转移电阻最小,表明1T-WS2@AuNPs具有优异的电子转移能力。随着KbE和CS的进一步修饰固定,半圆直径明显增大,CS/KbE/1T-WS2@AuNPs/GCE的电子转移能力最差。上述结果与CV测试结果一致,同时表明CS/KbE/1T-WS2@AuNPs/GCE生物传感器被成功构建。
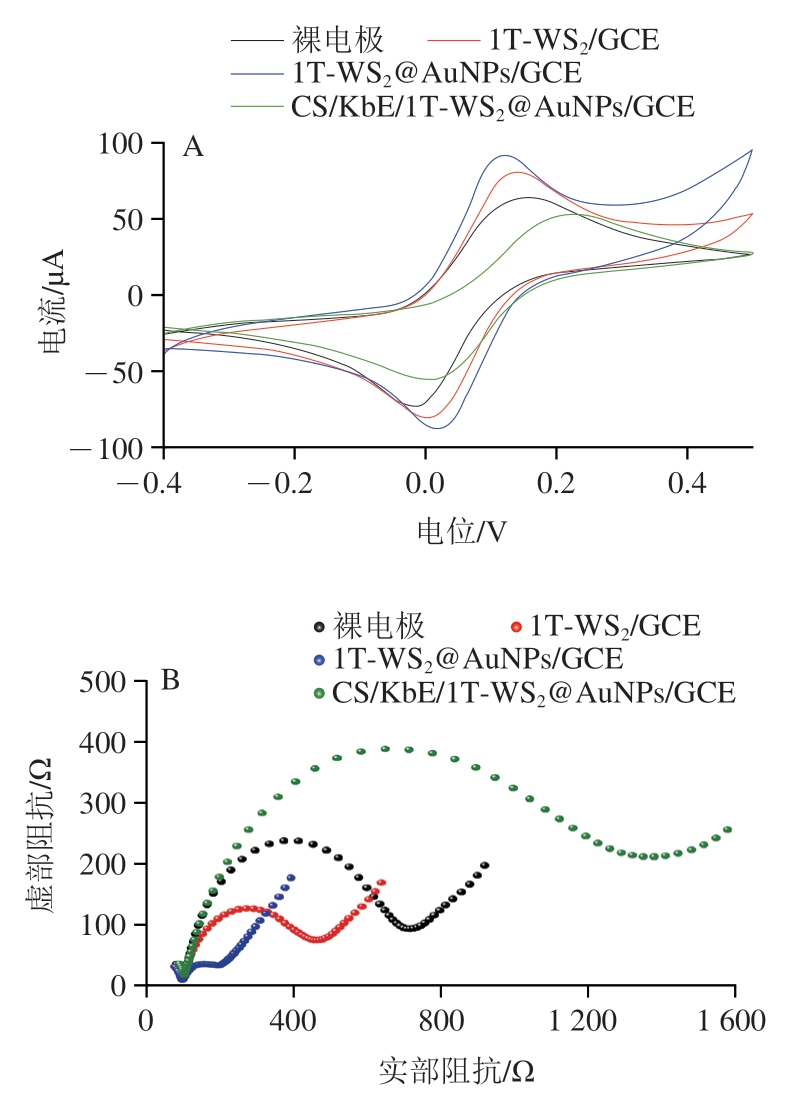
图3 不同修饰电极的CV图(A)及EIS图(B)
Fig. 3 CV curves (A) and Nyquist plots (B) of different modified electrodes
2.3 不同修饰电极的催化性能分析
由图4可知,在不含1-NA的磷酸盐缓冲液中,CS/KbE/1T-WS2@AuNPs/GCE修饰电极的SWV曲线平滑,无峰电流响应产生;加入1-NA后,出现一个明显的氧化峰,说明此峰是由KbE水解1-NA生成的1-萘酚在电极上被电化学氧化而产生。以上结果表明KbE被成功固定在电极上并保持其生物活性。此外,相比于CS/KbE/GCE电极,CS/KbE/1T-WS2/GCE、CS/KbE/AuNPs/GCE、CS/KbE/1T-WS2@AuNPs/GCE修饰电极上所产生的氧化峰电流增大且出峰电位减小。结果表明1T-WS2@AuNPs良好的导电性和协同电催化效应有效促进电子的传递,从而增强1-萘酚的氧化电流信号,该信号的增强有助于提高传感器的响应灵敏度。
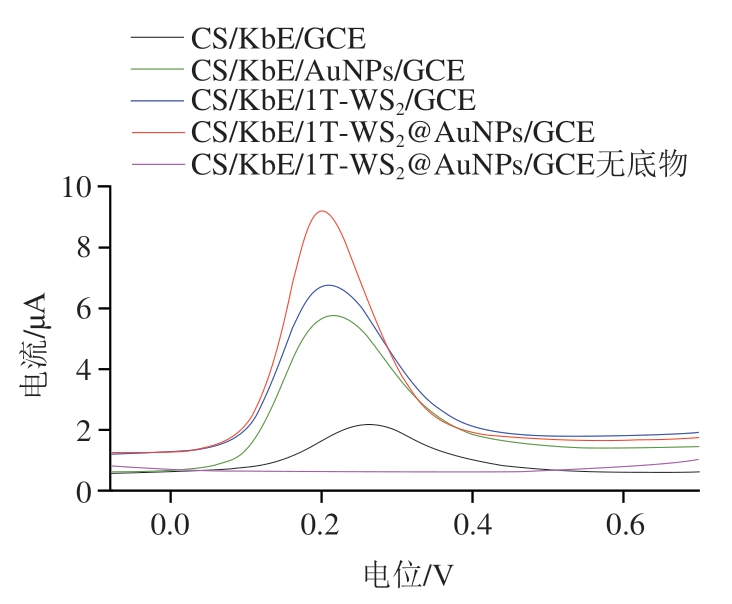
图4 不同修饰电极的SWV响应曲线图
Fig. 4 SWV response curves of different modified electrodes
2.4 CS/KbE/1T-WS2@AuNPs/GCE修饰电极制备及测试条件优化
2.4.1 底液pH值的影响
如图5A所示,随着pH值的增大,电流响应先增大后减小,在pH 7.0处具有最高电流响应。因此pH 7.0为最优pH值,后续实验使用pH 7.0的磷酸盐缓冲液。
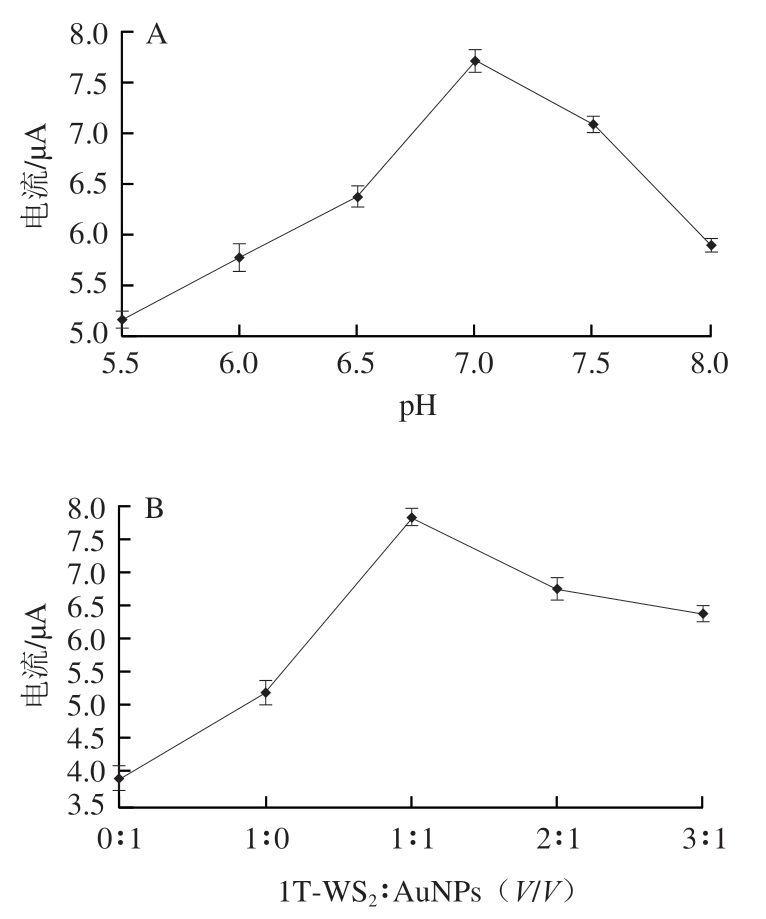
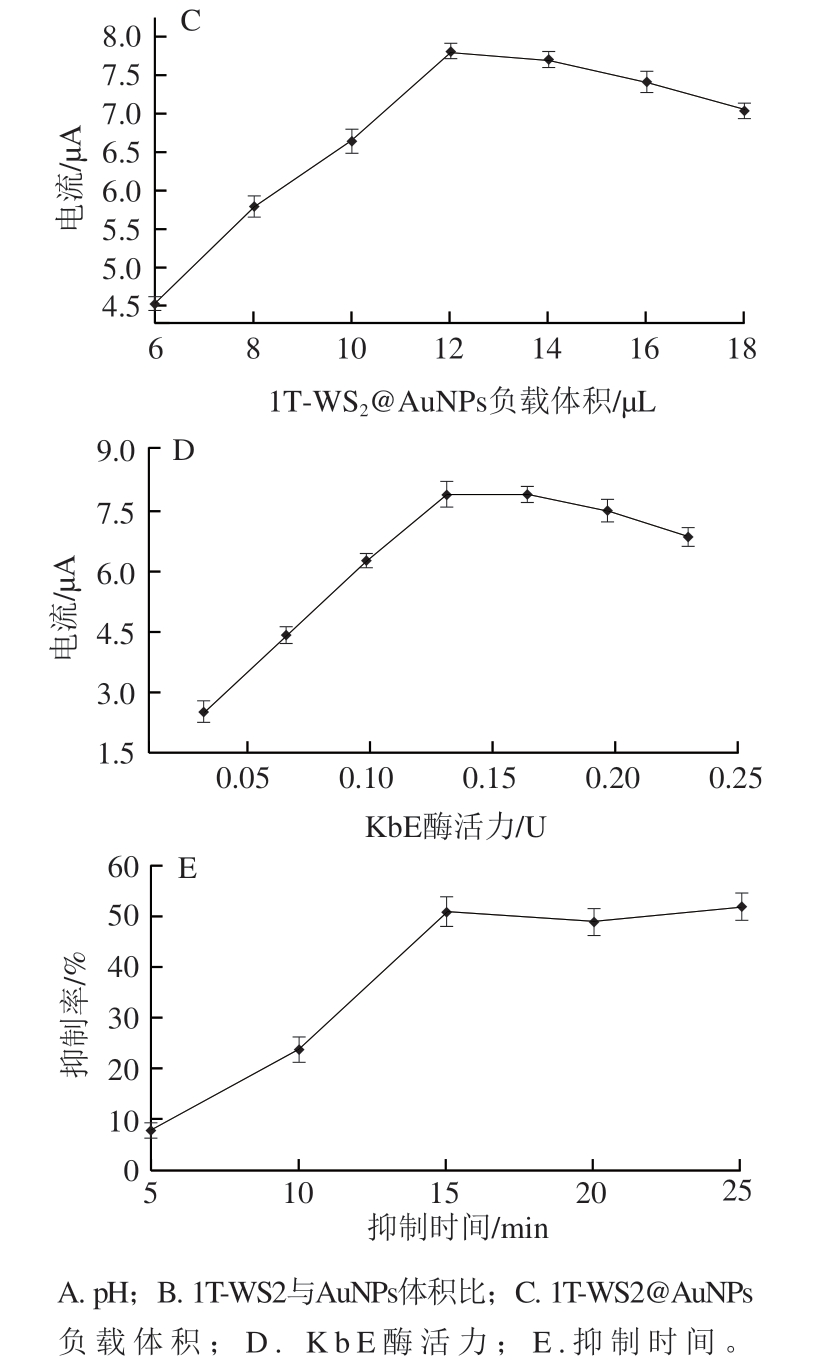
图5 不同制备条件及测试条件对SWV响应电流及抑制率的影响
Fig. 5 Effects of different preparation and test conditions on SWV response current and inhibition rate
2.4.2 1T-WS2与AuNPs体积比和1T-WS2@AuNPs负载体积的影响
电极修饰材料的组成会影响生物传感器的电化学性能。如图5B所示,1T-WS2与AuNPs的最佳体积比为1∶1。适量的纳米材料修饰到电极上可以增大电极的比表面积,促进电极与电活性物质之间的电子转移。如图5C所示,当1T-WS2@AuNPs负载体积从6 μL增加到12 μL,峰电流随负载体积增加而增大,于12 μL时达到最大;当负载体积进一步增加,峰电流值逐渐下降,这可能因为过厚的膜会阻碍电子传递。因此,选择12 μL作为1T-WS2@AuNPs纳米复合物的最佳负载体积。
2.4.3 负载的KbE酶活力的影响
作为传感器的生物识别元件,负载的KbE酶活力对响应信号的影响较大。如图5D所示,随着负载的KbE酶活力的增加,传感器的响应电流值变大,在0.13 U时达到最大值;继续增加负载的KbE酶活力,峰电流值略有下降,这是因为KbE是蛋白酶,导电性很差,过量的酶会阻碍电子在传感器表面的传递。因此,0.13 U为负载的最佳酶活力。
2.4.4 农药抑制时间的影响
农药抑制时间的长短会影响检测的准确性。从图5E可以看出,随抑制时间延长,酶活性下降越多,导致生成的1-萘酚越少,抑制率上升;当抑制时间超过15 min时,由于酶活性位点与农药的饱和结合,酶的抑制程度也趋于稳定。因此,以15 min作为最佳抑制时间。
2.5 CS/KbE/1T-WS2@AuNPs/GCE传感器杀螟硫磷的标准曲线
图6A表明CS/KbE/1T-WS2@AuNPs/GCE传感器的峰电流值整体随着杀螟硫磷质量浓度的增加而减小,农药对酶活性的抑制逐渐增强。由图6B可知,在0.1~2 000 μg/L范围内,抑制率与杀螟硫磷质量浓度(lgC)呈良好的线性关系,其线性标准方程为Y=14.82lgC+24.18,相关系数(R2)为0.992,检出限为0.04 μg/L(信噪比为3)。将CS/KbE/1T-WS2@AuNPs/GCE传感器与已报道的其他检测方法进行比较(表1),结果表明本研究构建的传感器具有较宽的线性区间和检出限;此外,还具有制备简单、成本低等优点。说明将植物酯酶替代来源于动物的胆碱酯酶进行农药的高效检测切实可行,具有进一步开发应用的价值。
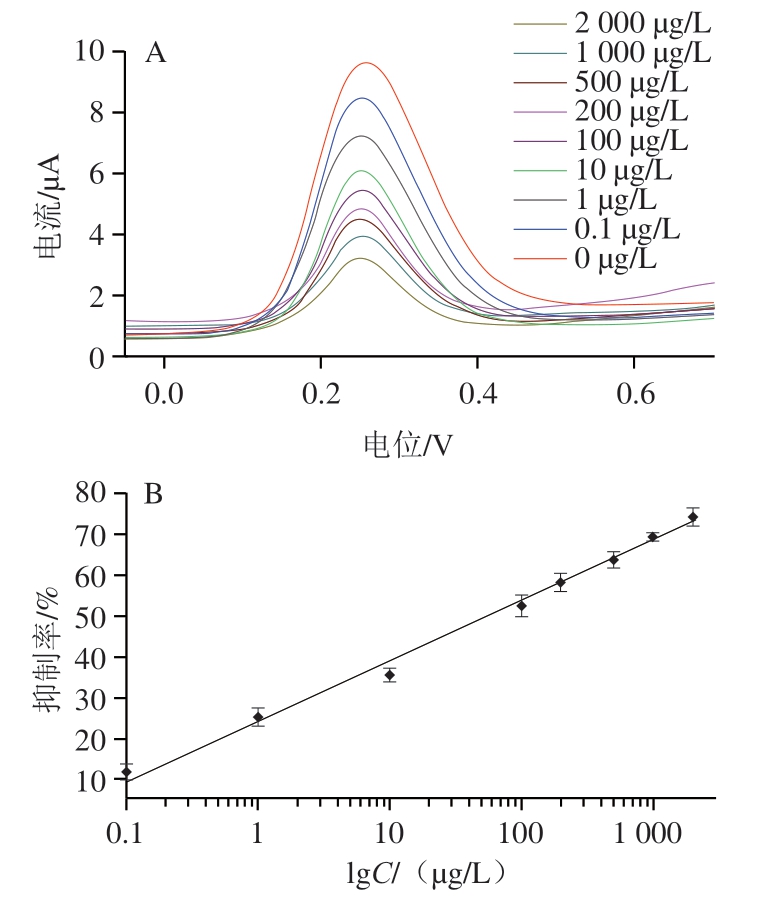
图6 不同质量浓度杀螟硫磷抑制后的SWV曲线图(A)及杀螟硫磷质量浓度与抑制率的线性关系图(B)
Fig. 6 SWV curves in the presence of different concentrations of fenitrothion (A), and linear relationship between KbE inhibition rate and fenitrothion concentration (B)
表1 杀螟硫磷检测方法的比较
Table 1 Comparison of different methods for fenitrothion detection
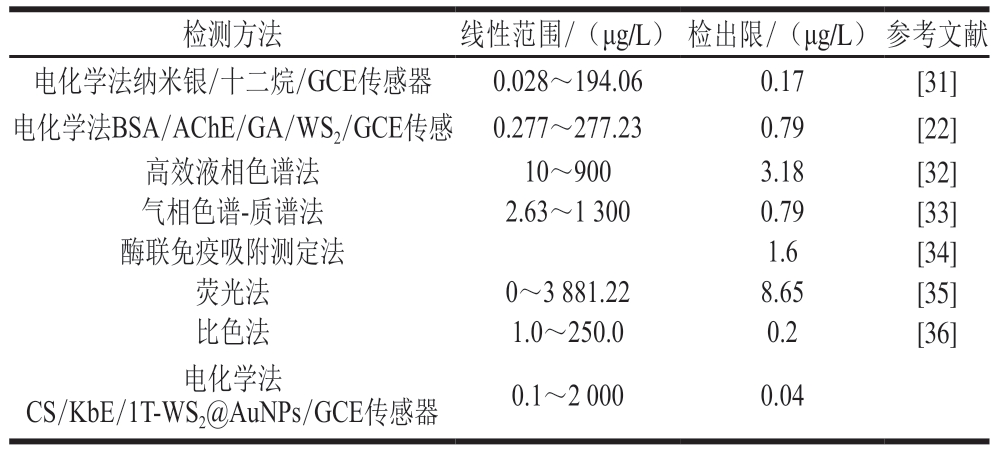
注:AChE.乙酰胆碱酶;BSA.牛血清白蛋白;GA.戊二醛。
检测方法 线性范围/(μg/L) 检出限/(μg/L) 参考文献电化学法纳米银/十二烷/GCE传感器 0.028~194.06 0.17 [31]电化学法BSA/AChE/GA/WS2/GCE传感 0.277~277.23 0.79 [22]高效液相色谱法 10~900 3.18 [32]气相色谱-质谱法 2.63~1 300 0.79 [33]酶联免疫吸附测定法 1.6 [34]荧光法 0~3 881.22 8.65 [35]比色法 1.0~250.0 0.2 [36]电化学法CS/KbE/1T-WS2@AuNPs/GCE传感器 0.1~2 000 0.04
2.6 CS/KbE/1T-WS2@AuNPs/GCE传感器重复性、稳定性和抗干扰能力分析
同一批制备5 支修饰电极,分别对同浓度1-NA进行SWV测试,峰电流值相对标准偏差为4.83%。在相同测试条件下,对同一支修饰电极进行连续5 次SWV测试,峰电流值相对标准偏差为3.96%。不用时将传感器置于4 ℃冰箱贮存,分别测试贮存15 d和30 d的SWV响应,电流响应下降为初始电流的95.9%和80.9%。结果表明所制备的CS/KbE/1T-WS2@AuNPs/GCE传感器具有良好的重复性和贮存稳定性。
考察实际样品中可能共存的常见离子、有机物和其他类型农药对测定的影响。如图7所示,当存在5 mmol/L的葡萄糖、柠檬酸、草酸、![]() Cl-、K+和Fe3+时,对SWV响应信号没有造成显著影响(P>0.05);但当存在50 μg/L的百草枯和多菌灵时,响应信号分别下降至70.96%和64.49%,可能是百草枯作为毒性较强的农药,对KbE有一定的抑制作用,而多菌灵是氨基甲酸酯农药的一种,对KbE也有抑制作用,这与文献中报道的一致[15,18]。结果表明,该CS/KbE/1T-WS2@AuNPs/GCE传感器具有良好的抗干扰能力。
Cl-、K+和Fe3+时,对SWV响应信号没有造成显著影响(P>0.05);但当存在50 μg/L的百草枯和多菌灵时,响应信号分别下降至70.96%和64.49%,可能是百草枯作为毒性较强的农药,对KbE有一定的抑制作用,而多菌灵是氨基甲酸酯农药的一种,对KbE也有抑制作用,这与文献中报道的一致[15,18]。结果表明,该CS/KbE/1T-WS2@AuNPs/GCE传感器具有良好的抗干扰能力。
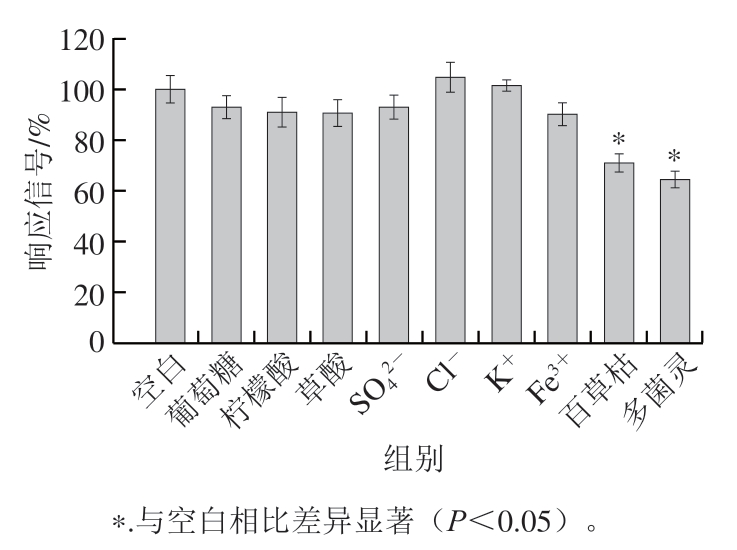
图7 各干扰物对CS/KbE/1T-WS2@AuNPs/GCE传感器响应信号的影响
Fig. 7 Effects of interfering substances on the response signal of CS/KbE/1T-WS2@AuNPs/GCE sensor
2.7 CS/KbE/1T-WS2@AuNPs/GCE传感器在实际样品中应用分析
为了评估所建CS/KbE/1T-WS2@AuNPs/GCE传感器在实际样品中的应用,将其用于白菜、油菜的加标回收检测,每组实验平行测定3 次。如表2所示,回收率为96.16%~109.60%,相对标准偏差小于5%,表明该生物传感器具有良好的实用性,有望应用于实际样品中OPPs的检测。
表2 CS/KbE/1T-WS2@AuNPs/GCE传感器在实际样品中杀螟硫磷检测
Table 2 Rsults of fenitrothion detection in real samples with CS/KbE/1T-WS2@AuNPs/GCE sensor
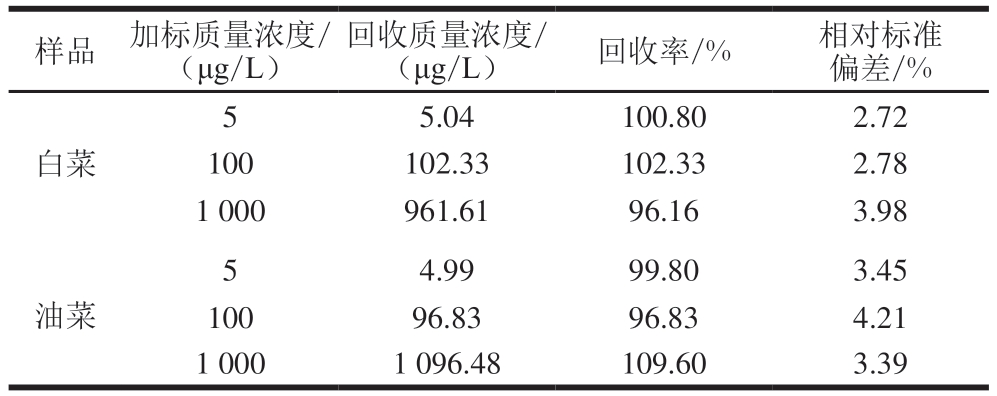
样品 加标质量浓度/(μg/L)回收质量浓度/(μg/L)回收率/%相对标准偏差/%5.04 100.80 2.72 100 102.33 102.33 2.78 1 000 961.61 96.16 3.98 5白菜4.99 99.80 3.45 100 96.83 96.83 4.21 1 000 1 096.48 109.60 3.39 5油菜
3 结 论
制备了具有良好电催化活性的1T-WS2@AuNPs纳米复合物,并以KbE代替乙酰胆碱酯酶构建新型电化学生物传感器,将其用于杀螟硫磷的简便、高效检测。SEM和TEM表征结果表明1T-WS2@AuNPs纳米复合物具有大比表面积,可为酶的负载提供良好的微环境,同时电化学表征表明1T-WS2@AuNPs具有良好的导电性和协同电催化效应可以有效促进电子的传递,提高传感器的响应灵敏度。与传统分析方法相比,该电化学传感器成本低、制备简单、灵敏度高,在OPPs检测中具有潜在的应用价值,并为植物酯酶在农药残留检测方面的应用提供一定理论和技术基础。
[1]PUNDIR C S, MALIK A, PREETY. Bio-sensing of organophosphorus pesticides: a review[J]. Biosensors and Bioelectronics, 2019, 140:111348. DOI:10.1016/j.bios.2019.111348.
[2]PUNDIR C S, CHAUHAN N. Acetylcholinesterase inhibitionbased biosensors for pesticide determination: a review[J]. Analytical Biochemistry, 2012, 429(1): 19-31. DOI:10.1016/j.ab.2012.06.025.
[3]SONGA E A, OKONKWO J O. Recent approaches to improving selectivity and sensitivity of enzyme-based biosensors for organophosphorus pesticides: a review[J]. Talanta, 2016, 155: 289-304. DOI:10.1016/j.talanta.2016.04.046.
[4]XIONG S, DENG Y C, ZHOU Y Y, et al. Current progress in biosensors for organophosphorus pesticides based on enzyme functionalized nanostructures: a review[J]. Analytical Methods, 2018,10(46): 5468-5479. DOI:10.1039/c8ay01851k.
[5]BUCUR B, MUNTEANU F D, MARTY J L, et al. Advances in enzyme-based biosensors for pesticide detection[J]. Biosensors(Basel),2018, 8(2): 27. DOI:10.3390/bios8020027.
[6]CAO J, WANG M, YU H, et al. An overview on the mechanisms and applications of enzyme inhibition-based methods for determination of organophosphate and carbamate pesticides[J]. Journal of Agricultural and Food Chemistry, 2020, 68(28): 7298-7315. DOI:10.1021/acs.jafc.0c01962.
[7]PERIASAMY A P, UMASANKAR Y, CHEN S M. Nanomaterialsacetylcholinesterase enzyme matrices for organophosphorus pesticides electrochemical sensors: a review[J]. Sensors, 2009, 9(6): 4034-4055.DOI:10.3390/s90604034.
[8]MAHMOUDI E, FAKHRI H, HAJIAN A, et al. High-performance electrochemical enzyme sensor for organophosphate pesticide detection using modified metal-organic framework sensing platforms[J]. Bioelectrochemistry, 2019, 130: 107348. DOI:10.1016/j.bioelechem.2019.107348.
[9]KUMAR T H V, SUNDRAMOORTHY A K. Electrochemical biosensor for methyl parathion based on single-walled carbon nanotube/glutaraldehyde crosslinked acetylcholinesterase-wrapped bovine serum albumin nanocomposites[J]. Analytica Chimica Acta,2019, 1074: 131-141. DOI:10.1016/j.aca.2019.05.011.
[10]BARUA S, DUTTA H S, GOGOI S, et al. Nanostructured MoS2-based advanced biosensors: a review[J]. ACS Applied Nano Materials, 2018,1: 2-25. DOI:10.1021/acsanm.7b00157.
[11]WANG Y H, HUANG K J, WU X. Recent advances in transitionmetal dichalcogenides based electrochemical biosensors: a review[J].Biosensors and Bioelectronics, 2017, 97: 305-316. DOI:10.1016/j.bios.2017.06.011.
[12]牙禹, 蒋翠文, 李焘, 等. 基于氧化氮掺杂石墨烯修饰碳糊电极高灵敏测定辣椒素[J]. 食品科学, 2017, 38(22): 211-215. DOI:10.7506/spkx1002-6630-201722032.
[13]薛也, 王艳, 赵宁, 等. 甲烷氧化菌素-纳米金修饰金电极溶出伏安法对Cu2+的检测[J]. 食品科学, 2021, 42(14): 328-332. DOI:10.7506/spkx1002-6630-20200502-009.
[14]YANG L M, HUO D Q, HE K, et al. Role of tryptophan in the active site of plant esterase: chemical modification and fluorometric studies[J]. Applied Biochemistry Biotechnology, 2013, 170(4): 909-924. DOI:10.1007/s12010-013-0203-5.
[15]BAO J, HOU C J, CHEN M, et al. Plant esterase-chitosan/gold nanoparticles-graphene nanosheet composite-based biosensor for the ultrasensitive detection of organophosphate pesticides[J]. Journal of Agricultural and Food Chemistry, 2015, 63(47): 10319-10326.DOI:10.1021/acs.jafc.5b03971.
[16]YANG L M, HUO D Q, HOU C J, et al. Purification of plantesterase in PEG1000/NaH2PO4 aqueous two-phase system by a twostep extraction[J]. Process Biochemistry, 2010, 45(10): 1664-1671.DOI:10.1016/j.procbio.2010.06.018.
[17]HOU C J, HE K, YANG L M, et al. Catalytic characteristics of plantesterase from wheat flour[J]. World Journal Microbiology Biotechnology,2012, 28(2): 541-548. DOI:10.1007/s11274-011-0845-9.
[18]刘丰, 田运霞, 吴远根, 等. 小麦酯酶电化学生物传感器构建及其对敌敌畏的检测[J]. 食品科学, 2022, 43(2): 355-360. DOI:10.7506/spkx1002-6630-20201012-092.
[19]WANG W R, WANG X X, CHENG N, et al. Recent advances in nanomaterials-based electrochemical (bio) sensors for pesticides detection[J]. TrAC Trends in Analytical Chemistry, 2020, 132: 116041.DOI:10.1016/j.trac.2020.116041.
[20]WONGKAEW N, SIMSEK M, GRIESCHE C, et al. Functional nanomaterials and nanostructures enhancing electrochemical biosensors and lab-on-a-chip performances: recent progress,applications, and future perspective[J]. Chemical Reviews, 2019,119(1): 120-194. DOI:10.1021/acs.chemrev.8b00172.
[21]KUMAR T H V, YADAV S K, SUNDRAMOORTHY A K. Review—electrochemical synthesis of 2D layered materials and their potential application in pesticide detection[J]. Journal of the Electrochemical Society, 2018, 165 (16): B848-B861. DOI:10.1149/2.0641816jes.
[22]NASIR M Z M, MAYORGA-MARTINEZ C C, SOFER Z, et al. Twodimensional 1T-Phase transition metal dichalcogenides as nanocarriers to enhance and stabilize enzyme activity for electrochemical pesticide detection[J]. ACS Nano, 2017, 11(6): 5774-5784. DOI:10.1021/acsnano.7b01364.
[23]LIANG Z Q, YANG S R, WANG X Y, et al. The metallic 1T-phase WS2 nanosheets as cocatalysts for enhancing the photocatalytic hydrogen evolution of g-C3N4 nanotubes[J]. Applied Catalysis B: Environmental,2020, 274: 119114. DOI:10.1016/j.apcatb.2020.119114.
[24]TOH R J, MAYORGA-MARTINEZ C C, SOFER Z, et al. 1T-Phase WS2 protein-based biosensor[J]. Advanced Functional Materials, 2017,27(5): 1604923. DOI:10.1002/adfm.201604923.
[25]RAHMAN M T, MARUF A A, FAISAL S, et al. Metallic 1T Phase tungsten disulfide microflowers for trace level detection of Hg2+ions[J]. Advanced Sustainable Systems, 2020, 4(9): 2000068.DOI:10.1002/adsu.202000068.
[26]寿雯, 杨双婷, 王悦靓, 等. 贵金属纳米粒子与水凝胶复合材料的制备及其在分析化学领域的应用进展[J]. 分析化学, 2021, 49(5):676-685. DOI:10.19756/j.issn.0253-3820.201536.
[27]WANG Q Q, QIN X F, GENG L Q, et al. Label-free electrochemical aptasensor for sensitive detection of malachite green based on Au nanoparticle/graphene quantum dots/tungsten disulfide nanocomposites[J]. Nanomaterials(Basel), 2019, 9(2): 229.DOI:10.3390/nano9020229.
[28]ZHANG Y N, LI X, LI D W, et al. A laccase based biosensor on AuNPs-MoS2 modified glassy carbon electrode for catechol detection[J]. Colloids and Surfaces B: Biointerfaces, 2020, 186:110683. DOI:10.1016/j.colsurfb.2019.110683.
[29]DAS K, UPPAL A, SAINI R K. Surfactant induced aggregation behavior of Merocyanine-540 adsorbed on polymer coated positively charged gold nanoparticles[J]. Spectrochimica Acta Part A: Molecular Biomolecular Spectrosccopy, 2016, 152: 378-383. DOI:10.1016/j.saa.2015.07.078.
[30]PIAO M X, CHU J, WANG X, et al. Hydrothermal synthesis of stable metallic 1T phase WS2 nanosheets for thermoelectric application[J].Nanotechnology, 2018, 29(2): 25705. DOI:10.1088/1361-6528/aa9bfe.
[31]KUMARAVEL A, MURUGANANTHAN M. Electrochemical detection of fenitrothion usingnanosilver/dodecane modified glassy carbon electrode[J]. Sensors and Actuators B: Chemical, 2021, 331:129467. DOI:10.1016/j.snb.2021.129467.
[32]ULUSOY H İ, KÖSEOĞLU K, KABIR A, et al. Fabric phase sorptive extraction followed by HPLC-PDA detection for the monitoring of pirimicarb and fenitrothion pesticide residues[J]. Mikrochimica Acta,2020, 187(6): 337. DOI:10.1007/s00604-020-04306-7.
[33]DOZEIN S V, MASROURNIA M, ES’HAGHI Z, et al. Development of a new magnetic dispersive solid-phase microextraction coupled with GC-MS for the determination of five organophosphorus pesticides from vegetable samples[J]. Food Analytical Methods, 2020, 14(4):674-686. DOI:10.1007/s12161-020-01906-0.
[34]KIM Y J, KIM Y A, LEE Y T, et al. Enzyme-linked immunosorbent assays for the insecticide fenitrothion: influence of hapten conformation and sample matrix on assay performance[J].Analytica Chimica Acta, 2007, 591(2): 183-190. DOI:10.1016/j.aca.2007.03.072.
[35]NEBU J, ANJALI DEVI J S, APARNA R S, et al. Fluorescence turn-on detection of fenitrothion using gold nanoparticle quenched fluorescein and its separation using superparamagnetic iron oxide nanoparticle[J]. Sensors and Actuators B: Chemical, 2018, 277: 271-280. DOI:10.1016/j.snb.2018.08.153.
[36]LARKI A. A novel application of carbon dots for colorimetric determination of fenitrothion insecticide based on the microextraction method[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2017, 173: 1-5. DOI:10.1016/j.saa.2016.08.048.