益生菌是寄生于宿主体内活的微生物,当达到一定数量后会对宿主健康产生有益作用的一类微生物。益生菌可通过调节免疫反应,促进有害物质的代谢以及产生抑菌物质和益生物质(如维生素、多糖等)等发挥益生作用[1],也可以通过增强营养吸收改善肠道微生物平衡[2]。益生菌的益生特性包括肠道定植、抑菌[3]、抗氧化能力[4]和安全性等[5-6]。研究最多的益生菌主要是能在胃肠道中存活的双歧杆菌和乳酸菌。乳酸菌是一类可以利用碳水化合物,并能产生乳酸的革兰氏阳性、无芽孢的一类细菌总称。乳酸菌是重要的发酵菌群,广泛存在于传统发酵食品中。赵圣明等[7]从发酵酸菜中筛选出疏水性、黏附性和自凝聚特性较好的植物乳杆菌A4,其作为辅助发酵剂可以明显提高发酵乳的活菌数和黏度。孙宁等[8]从自然发酵酸笋中筛选出6 株耐酸、耐胆盐性能好且抗氧化活性强的乳酸菌。郑柳青[9]从婴儿肠道中分离筛选出鼠李糖乳杆菌LR-ZB 1107-01的益生特性最好,并优化了菌株高密度培养条件使得活菌数达到了9.08×108 CFU/mL。陈美瑄[10]从40 份母乳样品中筛选出2 株益生特性好的乳酸菌分别为乳双歧杆菌Probio-M8和鼠李糖乳杆菌Probio-M9,之后将2 株菌与基础发酵剂(嗜热链球菌和保加利亚乳杆菌)复配发酵山羊乳,制备得到具有优良风味和口感的发酵乳。Yu Zhihui等[11]从发酵酸菜中筛选得到的植物乳杆菌S2-5和S4-1具有良好的益生特性,且能有效降低小鼠体内胆固醇含量。
雪莲菌作为传统发酵食品在西藏、青海地区有长期食用历史[12-13]。雪莲菌作为天然混菌发酵系统,在长期自然驯化过程中逐步形成由乳酸菌、酵母菌和醋酸菌等多种微生物组成的群落[14],其中乳酸菌包括副干酪乳杆菌、干酪乳杆菌、鼠李糖乳杆菌、链球菌和肠球菌等。课题组前期对雪莲菌中的微生物进行分离,得到20 株乳酸菌,本研究对其耐酸能力、模拟胃肠液耐受能力、黏附能力、抗氧化能力和抑菌能力等益生特性进行研究,旨在从中筛选得到具有潜在益生特性的菌株,为其在益生产品中的应用提供参考。
1 材料与方法
1.1 材料与试剂
20 株乳酸菌为本实验室从雪莲菌中分离得到,于-80 ℃条件下保存。
MRS培养基:蛋白胨10 g、牛肉膏10 g、葡萄糖20 g、无水乙酸钠5 g、酵母提取物5 g、柠檬酸三胺2 g、磷酸氢二钾2 g、硫酸镁0.1 g、吐温-80 1 mL,蒸馏水1 000 mL,pH 6.5,115 ℃灭菌20 min。
LB培养基:胰蛋白胨10 g、酵母粉5 g、氯化钠10 g,pH 7.0~7.2,115 ℃灭菌20 min。
胃蛋白酶、胰蛋白酶、猪胆盐 上海源叶生物科技有限公司;抗生素 北京天坛药物生物技术开发公司;脱脂棉羊血(无菌) 北京索莱宝科技有限公司;哥伦比亚血培养基 青岛高科园海博生物技术有限公司。
1.2 仪器与设备
UV-1200紫外分光光度计 上海美普达仪器有限公司;L530ZXJD-A1270培养箱、ZHJH-C1115B超净工作台 上海智城分析仪器制造有限公司;Centrifuge 5430R离心机 德国艾本德有限公司。
1.3 方法
1.3.1 菌株和培养条件
将乳酸菌菌株在MRS培养基中于37 ℃静置培养24 h,活化3 代。
1.3.2 菌悬液的制备
将1.3.1节活化3 代的菌液离心,弃上清液,用pH 7.4磷酸盐缓冲液(phosphate buffered saline,PBS)洗3 次,再加入PBS振荡均匀制成悬浮液,调节菌体浓度至1.0×108 CFU/mL(OD595 nm=1.0)。
1.3.3 乳酸菌的酸耐受性测定
按体积分数1%取菌悬液接种到MRS液体培养基中(用2 mol/L HCl溶液调节pH 3.0或2.5),37 ℃静置培养24 h后,取100 μL涂布于MRS琼脂板上,置于37 ℃培养24 h,观察平板菌落生成情况。
1.3.4 乳酸菌在模拟消化液下的存活率
1.3.4.1 乳酸菌在模拟胃液下的存活率
选取耐pH 2.5的乳酸菌按1.3.2节制成菌悬液,取1 mL菌悬液与9 mL pH 3.0模拟胃液混匀,37 ℃静置培养,分别在0、3 h后取样梯度稀释后涂布于MRS琼脂平板上,按式(1)计算存活率[15]。选择活菌数在106 CFU/mL以上的乳酸菌进行后续实验。
式中:Nm和Nn分别表示模拟胃液或肠液消化前后活菌数/(CFU/mL)。
1.3.4.2 乳酸菌在模拟肠液下的存活率
取1 mL菌悬液与9 mL pH 3.0模拟胃液混匀,37 ℃静置培养3 h后,取1 mL经模拟胃液消化后的菌液与9 mL pH 8.0模拟肠液混匀,37 ℃静置培养,分别在0、4 h取样,梯度稀释后涂布于MRS琼脂平板上,按式(1)计算存活率。
1.3.5 乳酸菌的体外黏附能力测定
1.3.5.1 疏水性测定
将乳酸菌悬液OD595 nm调整为0.8~1.0。1 mL溶剂(正己烷、二氯甲烷、乙醚或乙酸乙酯)中加入3 mL乳酸菌悬液,在37 ℃反应10 min,进行温度平衡,振荡混匀,在37 ℃培养3 h。取1 mL水相溶液,用紫外分光光度计于595 nm波长处测定OD595 nm。疏水性按式(2)计算[16]。
式中:ODi为培养0 h的OD595 nm;ODj为培养3 h的OD595 nm。
1.3.5.2 自聚集性测定
将乳酸菌悬液OD595 nm调整为0.9~1。在37 ℃培养0 h时,测定菌悬液OD595 nm,培养3 h后小心吸取溶液的上层相测定OD595 nm。按式(3)计算自凝聚率[16]:
式中:ODi为培养0 h的OD595 nm;ODj为培养3 h的OD595 nm。
1.3.6 乳酸菌的抗氧化活性测定
1.3.6.1 1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除活性
将2 mL OD595 nm为0.9~1的乳酸菌悬液与1 mL 0.2 mmol/L DPPH-无水乙醇溶液混匀,37 ℃于暗处反应30 min,6 000 r/min离心10 min,取上清液,于517 nm波长处测定吸光度A1;空白组以等体积无水乙醇代替DPPH-无水乙醇溶液,对照组则以等体积蒸馏水代替样品溶液,等体积的蒸馏水-无水乙醇混合液用于空白调零。DPPH自由基清除率按式(4)计算[17]:
式中:A0为空白组吸光度;A1为样品组吸光度;A2为对照组吸光度。
1.3.6.2 羟自由基清除活性
取5 mmol/L硫酸亚铁溶液、5 mmol/L水杨酸乙醇溶液、3 mmol/L过氧化氢溶液各1 mL加入10 mL具塞试管中,加2 mL OD595 nm为0.9~1的乳酸菌悬液,用蒸馏水补齐至刻度,37 ℃水浴中反应15 min,6 000 r/min离心10 min,取上清液,于510 nm波长处测定吸光度,蒸馏水为空白对照[18]。羟自由基清除率按式(5)计算:
式中:A0为空白组吸光度;A1为样品组吸光度。
1.3.6.3 超氧阴离子自由基清除活性
取4.5 mL 0.05 mol/L Tris-HCl缓冲液(pH 8.2,含2 mmol/L乙二胺四乙酸),25 ℃水浴反应20 min,加2.3 mL OD595 nm为0.9~1的乳酸菌悬液和2.2 mL 25 mmol/L邻苯三酚溶液,混合均匀后,25 ℃水浴反应4 min,加1 mL 10 mol/L HCl溶液终止反应,6 000 r/min离心10 min,取上清液,于320 nm波长处测定吸光度,蒸馏水为空白对照[19]。超氧阴离子自由基清除率按式(5)计算。
1.3.6.4 还原能力的测定
采用铁氰化钾法[20-21],取0.5 mL OD595 nm为0.9~1的乳酸菌悬液,加0.2 mol/L PBS及1 g/100 mL铁氰化钾溶液各0.5 mL,混合均匀。50 ℃水浴20 min,骤冷。加0.5 mL 10 g/100 mL三氯乙酸溶液,4 000 r/min离心5 min,取上清液1 mL,加超纯水、0.1 g/100 mL三氯化铁溶液各1 mL,混匀,静置10 min,于700 nm波长处测定吸光度。用PBS代替菌悬液为空白对照,还原能力按式(5)计算。
1.3.7 乳酸菌的抗菌活性测定
利用双层琼脂扩散法测定菌株的抗菌活性[22]。3种食源性病原体包括大肠杆菌、金黄色葡萄球菌、铜绿假单胞菌被用作指示菌。在灭菌平板中加入10 mL 2 g/100 mL水琼脂培养基,待水琼脂凝固后放入灭菌的牛津杯。在20 mL LB琼脂培养基中加入106~107 CFU/mL的指示菌,充分混匀后倒入平板内,待培养基凝固后,将牛津杯取出,在孔内分别加入8 株乳酸菌菌悬液180 μL,37 ℃培养24 h,观察并测量抑菌圈直径大小。
1.3.8 乳酸菌的安全性评价
1.3.8.1 抗生素敏感性
将100 μL 106~107 CFU/mL乳酸菌菌株均匀涂布于MRS培养基,将抗生素纸片贴在表面。37 ℃培养24 h,用游标卡尺测量抑菌圈直径,并将结果与美国临床和实验室标准协会(Clinical and Laboratory Standards Institute,CLSI)标准2012进行比较,评估抗生素敏感性[23]。
1.3.8.2 溶血活性
将乳酸菌在添加5%无菌脱纤维羊血的哥伦比亚血琼脂表面划线,37 ℃培养24~48 h。根据不同的光晕评估平板的溶血活性。没有明确的透明区域被确定为非溶血性[24]。
1.4 数据处理
实验均重复3 次,结果以 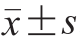 表示,使用Excel软件进行统计分析。图表绘制采用Origin 8.5软件。
表示,使用Excel软件进行统计分析。图表绘制采用Origin 8.5软件。
2 结果与分析
2.1 雪莲菌中乳酸菌的酸耐受性
耐酸性是选择益生菌菌株的重要标准。益生菌进入消化道后首先会遇到恶劣的胃肠道环境,它们必须能够在酸性环境下生存。人体胃液的pH值处于不断变化的过程中,通常维持在pH 3.0左右。大多数候选菌株的体外实验已经发展为能够耐受pH 3.0以下的低pH值条件[25],因此,本实验选择pH 2.5和3.0作为筛选候选益生菌菌株的耐酸性指标。由表1可知,从雪莲菌中分离出的20 株乳酸菌除FQ菌株,其余19 株菌株都能在pH 3.0下存活,但是只有11 株菌株能在pH 2.5的酸性条件下生长。
表1 雪莲菌中乳酸菌在pH 2.5和pH 3.0条件下生长情况
Table 1 Growth status of lactic acid bacteria isolated from Tibetan kefir grains at pH 2.5 and 3.0
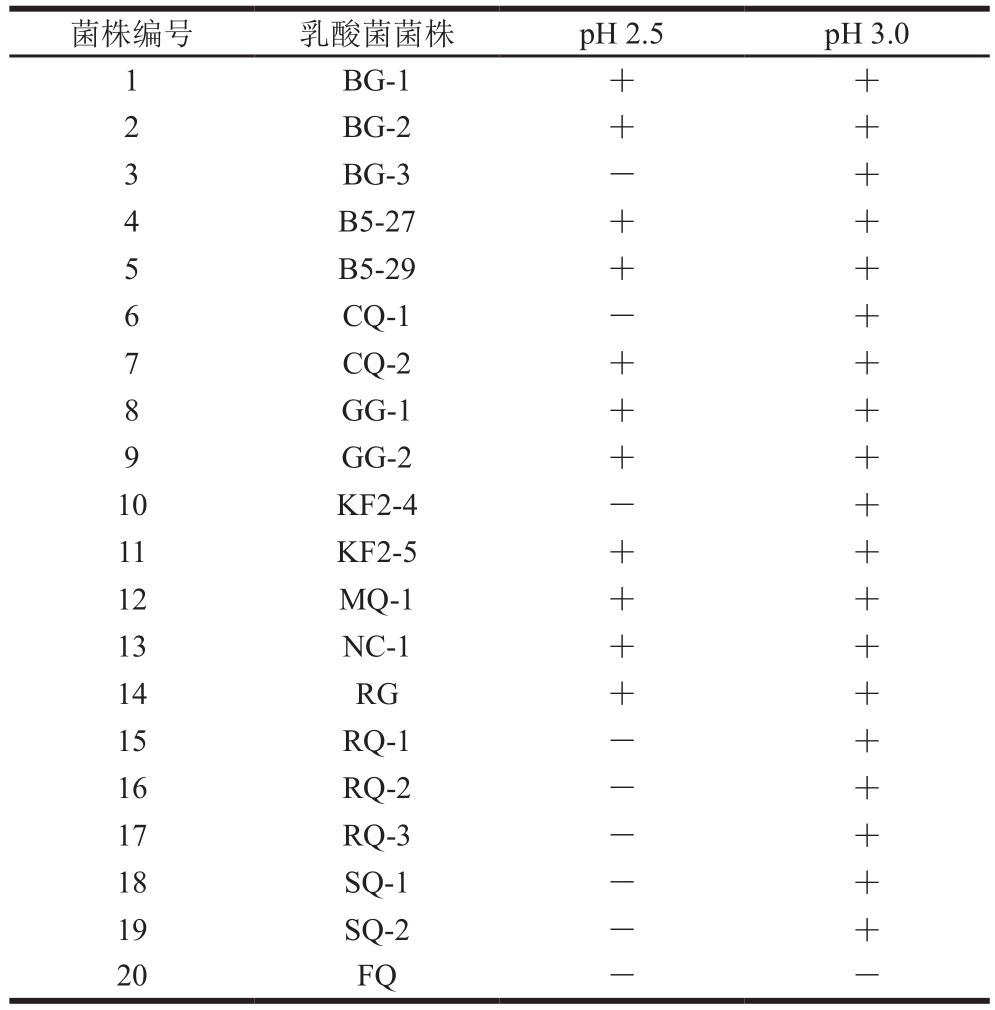
注:+.有菌落生长;-.无菌落生长。
菌株编号 乳酸菌菌株 pH 2.5 pH 3.0 1 BG-1 + +2 BG-2 + +3 BG-3 - +4 B5-27 + +5 B5-29 + +6 CQ-1 - +7 CQ-2 + +8 GG-1 + +9 GG-2 + +10 KF2-4 - +11 KF2-5 + +12 MQ-1 + +13 NC-1 + +14 RG + +15 RQ-1 - +16 RQ-2 - +17 RQ-3 - +18 SQ-1 - +19 SQ-2 - +20 FQ - -
2.2 雪莲菌中乳酸菌在模拟胃液中的存活率
选取能在pH 2.5酸性条件下生长的11 株乳酸菌用于测定模拟胃液的存活率。由图1可知,11 株乳酸菌在pH 3.0模拟胃液中处理3 h后,菌株均具有一定的耐受能力,但是差异较大。菌株BG-1、B5-27、RG、GG-2、GG-1、KF2-5在模拟胃液中存活率较高,均大于100%。CQ-2、NC-1、BG-2、B5-29存活率中等,MQ-1存活率最低为1.67%,但活菌数仍高于106 CFU/mL。
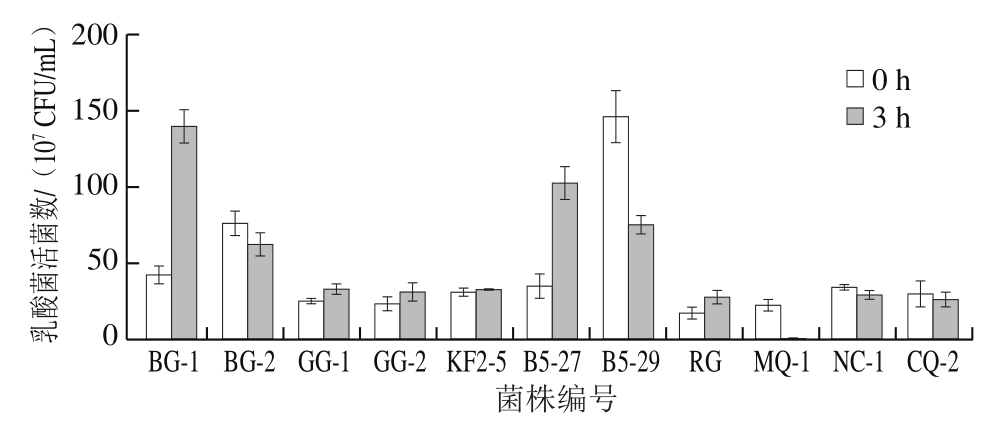
图1 模拟胃液中乳酸菌活菌数的测定结果
Fig. 1 Viable counts of LAB cultured in simulated artificial gastric fluid
2.3 雪莲菌中乳酸菌在模拟肠液中的存活率
由图2可知,经耐酸性筛选出的11 株乳酸菌,在pH 3.0模拟胃液中处理3 h后继续用pH 8.0的模拟肠液处理4 h,除菌株B5-27、B5-29和MQ-1,其余8 种菌株均具有一定的耐受能力。菌株BG-2在模拟肠液中存活率较高,为119.56%。其余8 株菌株经模拟胃肠液消化后存活率由大到小依次为GG-1、BG-1、CQ-2、NC-1、B5-29、KF2-5、GG-2、RG,活菌数均高于106 CFU/mL。
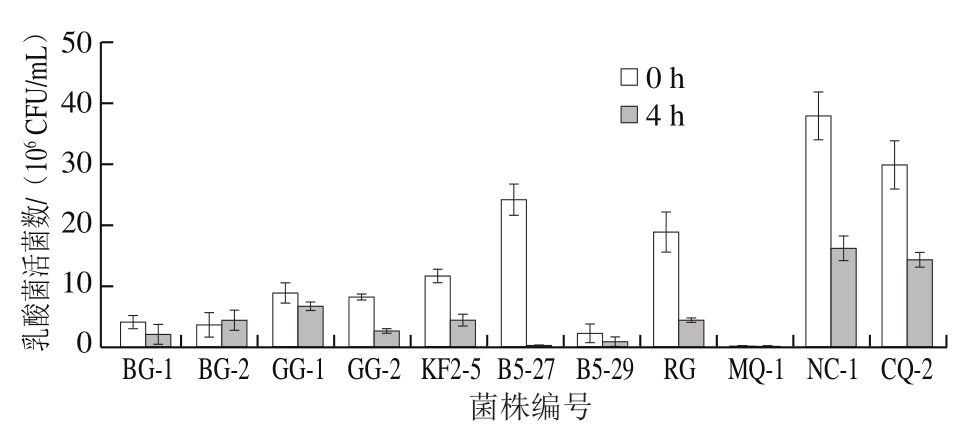
图2 模拟肠液中乳酸菌活菌数的测定结果
Fig. 2 Viable counts of LAB cultured in simulated artificial intestinal fluid
2.4 雪莲菌中乳酸菌的自凝聚性
选择经模拟胃肠液消化后活菌数仍在106 CFU/mL以上的8 株乳酸菌菌株进行后续益生特性分析。自凝聚指细胞之间的聚集,与没有自凝聚性的微生物相比,具有自凝聚性的微生物细胞在恶劣环境(如人类胃肠道)中具有竞争优势[26]。自凝聚的形成使中心细胞屏蔽了外界有害环境[27]。由图3可知,菌株RG和GG-2有较高的自凝聚性,自凝聚率分别为65.70%和63.67%。BG-1和GG-1自凝聚率分别为37.47%和35.59%,NC-1、KF2-5、BG-2和CQ-2自凝聚率分别为32.33%、30.28%、28.61%和23.99%。
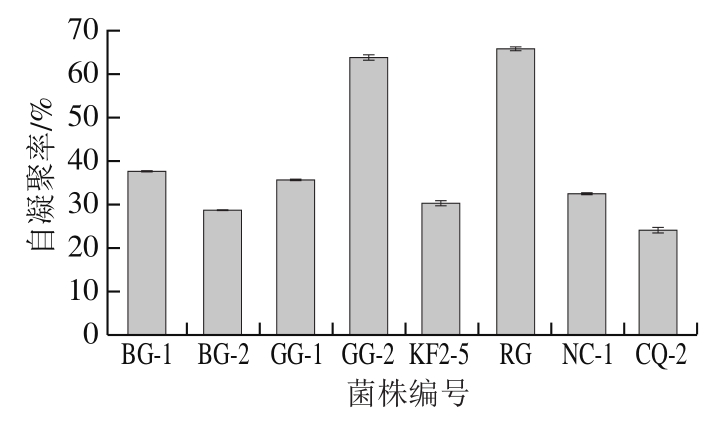
图3 雪莲菌中乳酸菌的自凝聚性
Fig. 3 Auto-aggregation capacity of LAB
2.5 雪莲菌中乳酸菌的疏水性
疏水性对于益生菌黏附在胃肠道上皮细胞上至关重要,菌株可以提供预防性和治疗性的益生作用[28]。由图4可知,BG-2、GG-2、KF2-5和RG对乙酸乙酯有较高的疏水性,分别为76.95%、73.01%、65.45%和64.66%。BG-1和RG对乙醚(47.90%和36.59%)和二氯甲烷(32.36%和32.61%)的疏水性处于中等水平。8 株乳酸菌对乙醚的疏水性都处于中等水平,对正己烷和二氯甲烷的疏水性都处于较低水平。
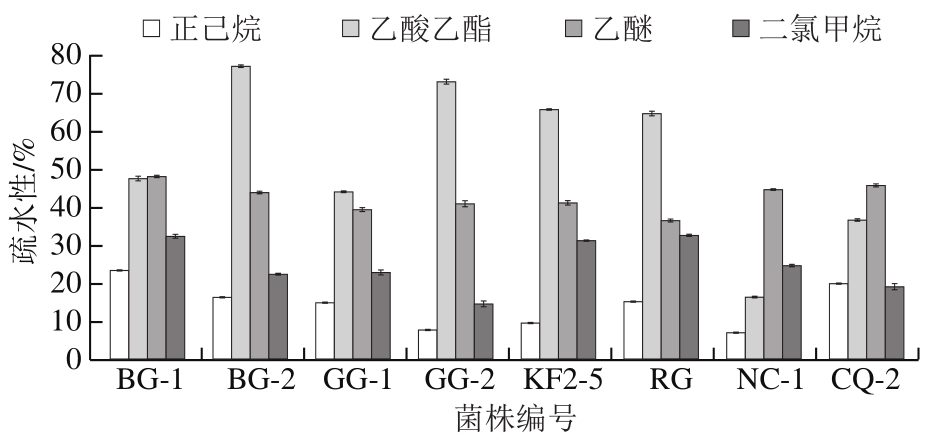
图4 雪莲菌中乳酸菌菌株的疏水性
Fig. 4 Hydrophobicity of LAB
2.6 雪莲菌中乳酸菌的抗氧化活性
由图5可知,8 株乳酸菌的DPPH自由基清除活性差异较大,菌株RG的DPPH自由基清除活性较高,为72.93%,BG-2、KF2-5和NC-1处于中等水平,分别为34.24%、32.13%和43.23%,BG-1、GG-1、GG-2和CQ-2均小于30%。8 株乳酸菌的羟自由基清除活性均大于36%,KF2-5的羟自由基清除活性最高,达60.39%,其余7 株乳酸菌羟自由基清除活性均在36%~56%。8 株乳酸菌的超氧阴离子自由基清除活性均较差,仅KF2-5和RG大于30%,其余6 株菌株均小于30%。但是8 株乳酸菌的还原能力都较强,均大于61%,RG还原能力最强,达到115.48%。
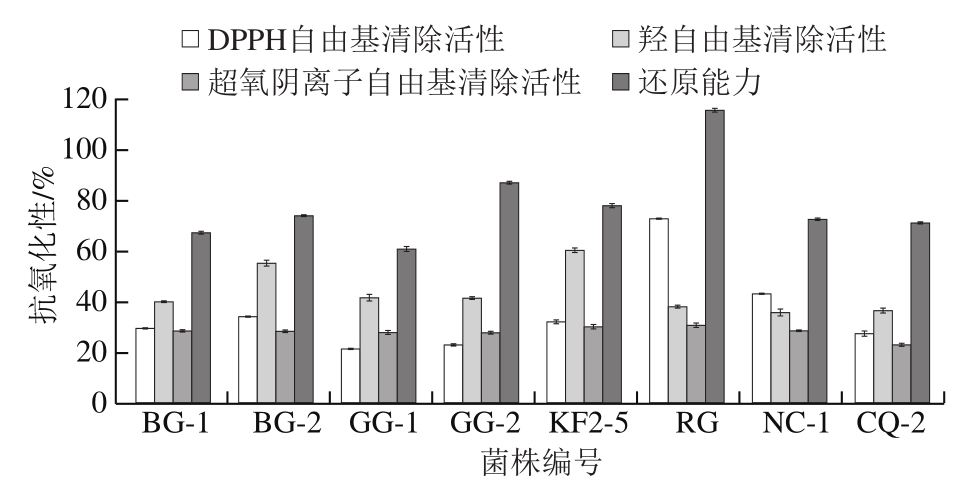
图5 雪莲菌中乳酸菌菌株的抗氧化活性
Fig. 5 Antioxidant activity of LAB
2.7 雪莲菌中乳酸菌的抑菌性
乳酸菌可以抑制病原菌的生长繁殖,有助于胃肠道环境健康[29]。8 株乳酸菌对3种指示菌的抑菌结果如表2所示。8 株乳酸菌对3种病原菌均有一定的抑制作用。8 株菌株对大肠杆菌的抑制效果较金黄色葡萄球菌和铜绿假单胞菌高,其中菌株KF2-5和RG对3种病原菌抑制效果均最好。综上,KF2-5和RG具有较好的益生特性。
表2 雪莲菌中乳酸菌菌株的抑菌活性
Table 2 Antibacterial activity of LAB
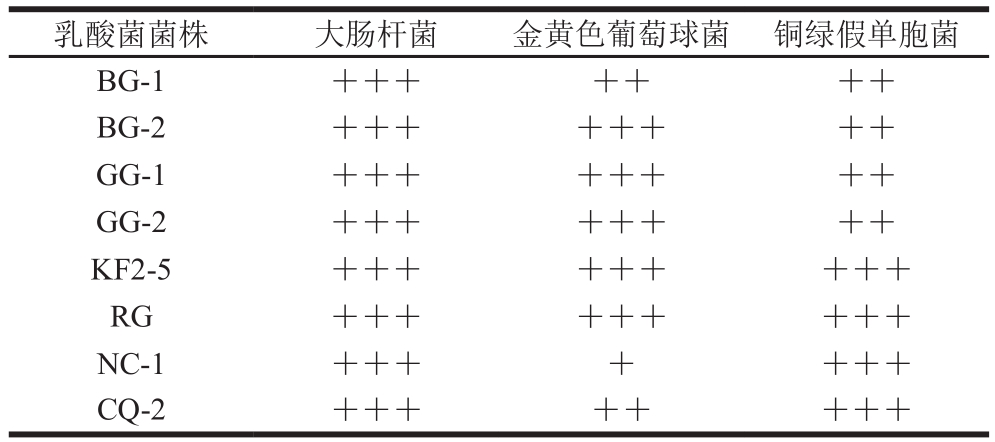
注:+++.抑菌圈直径17.0~20 mm;++.抑菌圈直径14.0~16.9 mm;+.抑菌圈直径10.0~13.9 mm。
乳酸菌菌株 大肠杆菌 金黄色葡萄球菌 铜绿假单胞菌BG-1 +++ ++ ++BG-2 +++ +++ ++GG-1 +++ +++ ++GG-2 +++ +++ ++KF2-5 +++ +++ +++RG +++ +++ +++NC-1 +++ + +++CQ-2 +++ ++ +++
2.8 雪莲菌中乳酸菌的安全性
2.8.1 抗生素敏感性
耐药性是乳酸菌在应用安全方面的重要问题[30]。抗生素虽然具有抑菌作用,但是也会使人体产生耐药性,导致肠道菌群紊乱[31]。根据CLSI标准2012对KF2-5和RG菌株进行抗生素敏感性评价,结果见表3。KF2-5和RG对红霉素、卡那霉素、氯霉素和四环素均敏感。KF2-5对链霉素和庆大霉素中度敏感,RG对环丙沙星、青霉素和头孢曲松中度敏感。KF2-5对环丙沙星、头孢曲松、头孢噻肟和万古霉素耐药,RG对链霉素、庆大霉素、头孢噻肟和万古霉素耐药。据报道很多乳酸菌对链霉素、万古霉素的耐药性是先天固有的,且这种耐药性一般不会转移传递给致病菌[32]。
表3 雪莲菌中乳酸菌菌株的抗生素敏感性
Table 3 Antibiotic susceptibility of LAB
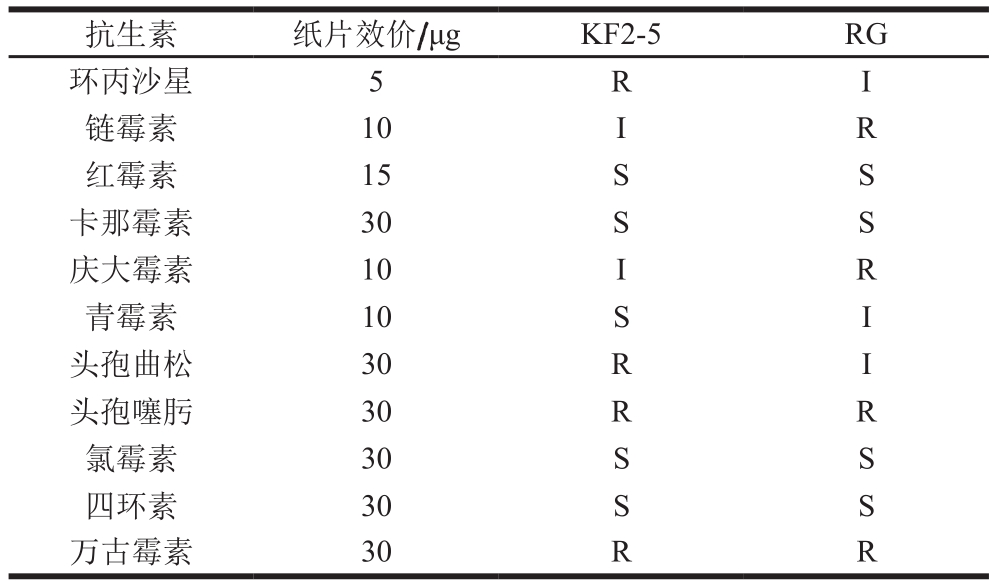
注:S.敏感;I.中度敏感;R.耐药。
抗生素 纸片效价/μg KF2-5 RG环丙沙星 5 R I链霉素 10 I R红霉素 15 S S卡那霉素 30 S S庆大霉素 10 I R青霉素 10 S I头孢曲松 30 R I头孢噻肟 30 R R氯霉素 30 S S四环素 30 S S万古霉素 30 R R
2.8.2 溶血活性
由图6可知,KF2-5和RG菌株均没有溶血现象,说明这2 株乳酸菌均是安全的,可以为之后进一步发酵提供安全性保障。
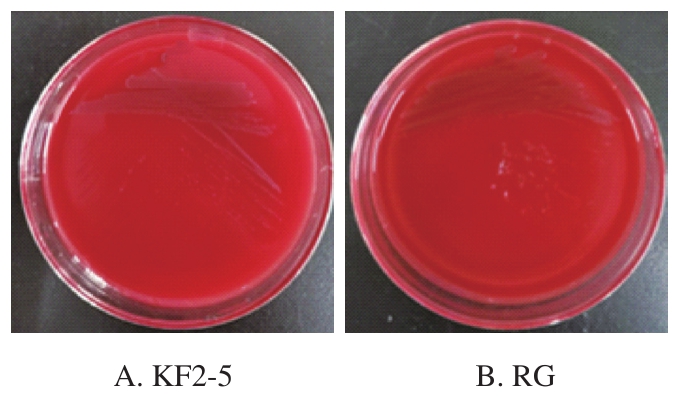
图6 雪莲菌中乳酸菌菌株的溶血活性
Fig. 6 Hemolytic activity of LAB
3 讨 论
本研究从实验室已有雪莲菌中分离得到的20 株乳酸菌中筛选出8 株具有胃肠液耐受性能力的乳酸菌,进一步对其益生特性研究,得到2 株具有潜在益生特性的乳酸菌。
目前关于益生菌的研究受到越来越多的关注,然而胃肠道系统复杂,益生菌进入胃肠道后首先要能够耐受胃肠道的恶劣环境[33],同时应具有良好的肠道黏附性能才能定植于肠道,进而发挥其益生作用,因此益生菌应该同时具有胃肠液耐受性能力与肠道黏附能力,自凝聚性和疏水性是表征益生菌肠道表皮黏附能力的重要指标。目前,从传统发酵食品中筛选益生菌是一个研究的热点。Gunyakti等[23]从发酵食品、水果、蔬菜中筛选得到戊糖片球菌CHIG、NAG1和植物乳杆菌V3F对低pH值和高胆盐均有较好的耐受性。Yu等[34]从泡菜中筛选到魏斯氏菌D29具有较强的耐酸和耐胆盐能力。本研究筛选得到8 株对胃肠液耐受性较好的乳酸菌,这些菌经过模拟胃肠液消化后活菌数均能达到106 CFU/mL以上。
自凝聚性和疏水性是细菌黏附在肠道表皮的重要指标,通常认为自凝聚性和疏水性高的菌株对细胞的黏附性也高。赵雪婷等[35]对3 株人源干酪乳杆菌进行益生特性研究,结果表明3 株干酪乳杆菌自凝聚率均为70%以上,疏水性均为86%以上。赵圣明等[7]从发酵酸菜中筛选出植物乳杆菌A44,其对氯仿和二甲苯的疏水性均大于80%。本研究筛选出的鼠李糖乳杆菌RG的自凝聚性和对乙酸乙酯的疏水性均较高,分别为65.70%和64.66%,表明其具有较好的黏附性。
肠道微生物群的生理平衡非常重要,因为许多疾病与肠道微生物群的失调有关。已有报道表明乳酸菌可通过其抗氧化活性调节肠道内微生物群的稳态[4]。本研究中KF2-5的羟自由基清除活性最高(60.39%),RG的DPPH自由基清除活性最高(72.93%),且2 株菌的还原能力也较强,RG的还原能力最强,达到115.48%,KF2-5的还原能力为77.98%。Yu等[34]从泡菜中筛选到魏斯氏菌D30具有较强的抗氧化能力,为29.53%~67.81%。后续可对益生菌调节氧化应激,改善肠道抗氧化防御系统方面[36]作进一步研究。
在健康的肠道微生物群中,有益微生物产生的抗菌化合物可以防止病原体过度生长[3,37]。本研究中KF2-5和RG对大肠杆菌、金黄色葡萄球菌和铜绿假单胞菌抑制效果最好。高云云等[38]从新疆传统乳品中筛选出植物乳杆菌1-3和1-6对大肠杆菌和金黄色葡萄球菌的抑制效果最好,其抑菌圈直径与本研究接近。抑菌作用一方面是因为产生有机酸而达到抑菌效果,另一方面可能和其产生的其他非酸性化合物有关。
抗生素敏感性和溶血活性是体外测定益生菌安全性的指标,不同菌株对抗生素的耐药性不同。目前的研究发现,大部分乳酸菌都没有溶血活性。本研究中KF2-5和RG对红霉素、卡那霉素、氯霉素和四环素均敏感,对头孢噻肟和万古霉素耐药。Nami等[24]从酸奶中筛选出的植物乳杆菌YS5对红霉素、卡那霉素和四环素等敏感,对万古霉素和环丙沙星耐药,与本实验结果相似。有研究称一些乳酸菌有溶血活性,Argyri等[39]从发酵橄榄中筛选出71 株乳酸菌进行溶血实验,发现有4 株菌有溶血活性。本实验中筛选出的2 株乳酸菌均无溶血活性,说明可以用于后续发酵。
目前,益生菌的概念已被广泛熟知和认可,然而对于益生菌的功能机理、遗传转化及代谢调控[40]仍需不断深入研究。
4 结 论
本研究对分离自雪莲菌的乳酸菌进行益生特性研究,筛选出2 株潜在益生特性较好的乳酸菌,分别为副干酪乳杆菌KF2-5和鼠李糖乳杆菌RG。菌株RG的自凝聚性、疏水性、抗氧化能力和抑菌性能均较好,菌株KF2-5的疏水性、抗氧化能力和抑菌性能较好。2 株菌对红霉素、卡那霉素、氯霉素和四环素敏感,对头孢噻肟和万古霉素耐药,并且均无溶血活性。
近年来,在国家“健康中国”战略驱动下,人们对营养健康的需求进一步提升,对益生菌调节健康的需求日益增多,益生菌产业增长较快,本研究从雪莲菌中分离的乳酸菌中筛选出2 株潜在益生特性较好的乳酸菌,后期可将这2 株乳酸菌进行动物实验研究其具体的益生性能,并应用于发酵制品或其他益生产品中。
[1]CAGIA C, DE ANGELIS M, PITINO I, et al. Probiotic features of Lactobacillus strains isolated from Ragusano and Pecorino Siciliano cheeses[J]. Food Microbiology, 2015, 50: 109-117. DOI:10.1016/j.fm.2015.03.010.
[2]HATICE S A, EAZGI D O, ZUBEYDE O. Assimilation of cholesterol and probiotic characterisation of yeast strains isolated from raw milk and fermented foods[J]. International Journal of Dairy Technology,2016, 69(1): 63-70. DOI:10.1111/1471-0307.12217.
[3]PRABHURAIESHWAR C, CHANDRAKANTH R K. Probiotic potential of lactobacilli with antagonistic activity against pathogenic strains: an in vitro validation for the production of inhibitory substances[J]. Biomedical Journal, 2017, 40(5): 270-283. DOI:10.1016/j.bj.2017.06.008.
[4]LI S, ZHAO Y, ZHANG L, et al. Antioxidant activity of Lactobacillus plantarum strains isolated from traditional Chinese fermented foods[J]. Food Chemistry, 2012, 135(3): 1914-1919. DOI:10.1016/j.foodchem.2012.06.048.
[5]GAZZOLA S, FONTANA C, BASSI D, et al. Assessment of tetracycline and erythromycin resistance transfer during sausage fermentation by culture-dependent and -independent methods[J]. Food Microbiology, 2012, 30(2): 348-354. DOI:10.1016/j.fm.2011.12.005.
[6]钟综. 浅谈益生菌的安全性问题[J]. 食品安全导刊, 2017(13): 70-71.DOI:10.16043/j.cnki.cfs.2017.13.020.
[7]赵圣明, 赵岩岩, 马汉军, 等. 发酵酸菜来源乳酸菌的益生特性及其在发酵乳中的应用研究[J]. 食品科学, 2019, 40(6): 187-194.DOI:10.7506/spkx1002-6630-20180305-050.
[8]孙宁, 雷敬玲, 吴晓青, 等. 自然发酵酸笋中乳酸菌的筛选鉴定及益生特性研究[J]. 中国酿造, 2020, 39(6): 63-68. DOI:10.11882/j.issn.0254-5071.2020.06.013.
[9]郑柳青. 鼠李糖乳杆菌LR-ZB1107的益生特性及其高密度培养的研究[D]. 广州: 华南理工大学, 2020.
[10]陈美瑄. 母乳中益生乳杆菌和双歧杆菌的初步筛选及特性研究[D].呼和浩特: 内蒙古农业大学, 2020.
[11]YU Z H, ZHANG X, LI S Y, et al. Evaluation of probiotic properties of Lactobacillus plantarum strains isolated from Chinese sauerkraut[J].World Journal of Microbiology and Biotechnology, 2013, 29(3): 489-498. DOI:10.1007/s11274-012-1202-3.
[12]冯铄涵. 藏灵菇发酵乳的营养功能及发酵特性研究现状[J]. 中国奶牛, 2012(2): 35-38. DOI:10.3969/j.issn.1004-4264.2012.02.013.
[13]薄芯, 李京霞. 西藏灵菇奶一般毒性和生殖毒性的初步探索[J]. 中国乳品工业, 2007, 35(8): 28-30. DOI:10.3969/j.issn.1001-2230.2007.08.007.
[14]聂炎炎, 杨汝德, 廖晓寰, 等. 西藏“雪莲”共生菌的分离与特性研究[J]. 广州食品工业科技, 2004, 20(增刊1): 15-19. DOI:10.3969/j.issn.1673-9078.2004.z1.005.
[15]SON S, JEON H, JEON E B, et al. Potential probiotic Lactobacillus plantarum Ln4 from kimchi: evaluation of β-galactosidase and antioxidant activities[J]. LWT-Food Science and Technology, 2017,85: 181-186. DOI:10.1016/j.lwt.2017.07.018.
[16]MALLAPPA R H, SINGH D K, ROKANA N, et al. Screening and selection of probiotic Lactobacillus strains of Indian gut origin based on assessment of desired probiotic attributes combined with principal component and heatmap analysis[J]. LWT-Food Science and Technology, 2019, 105: 272-281. DOI:10.1016/j.lwt.2019.02.002.
[17]TIAN F W, ZHAI Q X, ZHAN J X, et al. Lactobacillus plantarum CCFM8661 alleviates lead toxicity in mice[J]. Biological Trace Element Research, 2012, 150(1/3): 264-271. DOI:10.1007/s12011-012-9462-1.
[18]LIN M Y, CHANG F J. Antioxidative effect of intestinal bacteria Bifidobacterium longum ATCC 15708 and Lactobacillus acidophilus ATCC 4356[J]. Digestive Diseases and Sciences, 2000, 45(8): 1617-1622. DOI:10.1023/A:1005577330695.
[19]王曦, 罗霞, 许晓燕, 等. 不同乳酸菌菌株抗氧化能力的比较研究[J]. 食品科学, 2010, 31(9): 197-201. DOI:CNKI:SUN:SP KX.0.2010-09-046.
[20]杨静秋. 抗氧化乳酸菌的筛选及其对氧化损伤的CT-26细胞的保护作用[D]. 无锡: 江南大学, 2009.
[21]李景艳. 乳酸菌胞外多糖的抗氧化活性及其结构[D]. 无锡: 江南大学, 2013.
[22]蔺方瑞. 屎肠球菌BZ2所产抑菌物质的特性研究[D]. 呼和浩特:内蒙古农业大学, 2017.
[23]GUNYAKTI A, ASAN-O M. Lactobacillus gasseri from human milk with probiotic potential and some technological properties[J]. LWTFood Science and Technology, 2019, 109: 261-269. DOI:10.1016/j.lwt.2019.04.043.
[24]NAMI Y, VASEGHI B R, MANAFI M, et al. Hypocholesterolaemic activity of a novel autochthonous potential probiotic Lactobacillus plantarum YS5 isolated from yogurt[J]. LWT-Food Science and Technology, 2019, 111: 876-882. DOI:10.1016/j.lwt.2019.05.057.
[25]CHANDRAN A, DUARY R K, GROVER S, et al. Relative expression of bacterial and host specific genes associated with probiotic survival and viability in the mice gut fed with Lactobacillus plantarum Lp91[J].Microbiological Research, 2013, 168(9): 555-562. DOI:10.1016/j.micres.2013.04.010.
[26]BRUCKNER S, MOSCH H U. Choosing the right lifestyle: adhesion and development in Saccharomyces cerevisiae[J]. FEMS Microbiology Reviews, 2012, 36(1): 25-58. DOI:10.1111/j.1574-6976.2011.00275.x.
[27]SUVARNA S, DSOUZA J, RAGAVAN M L, et al. Potential probiotic characterization and effect of encapsulation of probiotic yeast strains on survival in simulated gastrointestinal tract condition[J]. Food Science and Biotechnology, 2018, 27(3): 745-753. DOI:10.1007/s10068-018-0310-8.
[28]FADDA M E, MOSSA V, DEPLANO M, et al. In vitro screening of Kluyveromyces strains isolated from Fiore Sardo cheese for potential use as probiotics[J]. LWT-Food Science and Technology, 2017, 75:100-106. DOI:10.1016/j.lwt.2016.08.020.
[29]LAPARRA J M, SANZ Y. Comparison of in vitro models to study bacterial adhesion to the intestinal epithelium[J]. Letters in Applied Microbiol, 2009, 49(6): 695-701. DOI:10.1111/j.1472-765X.2009.02729.x.
[30]SANDERS M E, AKKERMANS L M A, HALLER D, et al. Safety assessment of probiotics for human use[J]. Gut Microbes, 2010, 1(3):164-185. DOI:10.4161/gmic.1.3.12127.
[31]闫丹丽, 武俊瑞, 史海粟, 等. 下一代益生菌-卵形拟杆菌研究进展[J]. 乳业科学与技术, 2020, 43(1): 50-54. DOI:10.15922/j.cnki.jdst.2020.01.010.
[32]张灼阳, 刘畅, 郭晓奎. 乳酸菌耐药性的研究进展[J]. 中国微生物学杂志, 2007, 19(5): 478-480. DOI:10.13381/j.cnki.cjm.2007.05.015.
[33]BORICHA A A, SHEKH S L, PITHVA S P, et al. In vitro evaluation of probiotic properties of Lactobacillus species of food and human origin[J]. LWT-Food Science and Technology, 2019, 106: 201-208.DOI:10.1016/j.lwt.2019.02.021.
[34]YU H S, JANG H J, LEE N K, et al. Evaluation of the probiotic characteristics and prophylactic potential of Weissella cibaria strains isolated from kimchi[J]. LWT-Food Science and Technology, 2019,112: 108229. DOI:10.1016/j.lwt.2019.05.127.
[35]赵雪婷, 彭珍, 胡敏, 等. 三株人源干酪乳杆菌的益生特性[J]. 食品与发酵工业, 2019, 45(12): 15-19; 34. DOI:10.13995/j.cnki.11-1802/ts.020444.
[36]YU H S, LEE N K, CHOI A J, et al. Antagonistic and antioxidant effect of probiotic Weissella cibaria JW15[J]. Food Science and Biotechnology, 2019, 28: 851-855. DOI:10.1007/s10068-018-0519-6.
[37]KORPELA K, SALONEN A, VEPSALAINEN O, et al. Probiotic supplementation restores normal microbiota composition and function in antibiotic-treated and in caesarean-born infants[J]. Microbiome,2018, 6(1): 182. DOI:10.1186/s40168-018-0567-4.
[38]高云云, 李宝坤, 卢士玲, 等. 新疆传统乳品中产胞外多糖乳酸菌的筛选及益生特性的研究[J]. 中国酿造, 2020, 39(5): 28-34.DOI:10.11882/j.issn.0254-5071.2020.05.006.
[39]ARGYRI A A, ZOUMPOPOULOU G, KARATZAS A G, et al.Selection of potential probiotic lactic acid bacteria from fermented olives by in vitro tests[J]. Food Microbiology, 2013, 33(2): 282-291.DOI:10.1016/j.fm.2012.10.005.
[40]李楠, 刘振民. 益生菌与功能发酵乳开发研究进展[J]. 乳业科学与技术, 2020, 43(3): 31-38. DOI:10.15922/j.cnki.jdst.2020.03.007.