丙烯酰胺(arylamide,AA)是一种易溶于水、乙醇等极性溶剂的化合物,易挥发,可通过皮肤、呼吸道、食道等进入人体内,其中饮食摄入是其最主要的暴露途径。欧盟食品安全委员会(European Food Safety Authority,EFSA)最新膳食暴露评估中,AA在日常饮食摄入的平均暴露水平为0.4~1.9 μg/(kg mb·d)[1]。国家食品安全风险评估中心研究数据显示,2012年我国AA的人均摄入水平为0.319 μg/(kg mb·d),与2000年相比增长70%,呈现逐年升高趋势[2]。AA进入机体代谢后可产生肝脏毒性、神经毒性、生殖毒性和致癌性,被国际癌症研究署(International Agency for Research on Cancer,IARC)列为2A类致癌物[3],从2002年在食品中发现至今,一直为国际食品安全领域的研究热点。
咖啡是世界三大饮料之一,全球已有80多个国家和地区种植咖啡。我国咖啡种植地以云南、海南为主,云南省咖啡种植面积和产量均占全国98%以上[4-5],是我国最大的咖啡生产基地。2011—2020年,云南省和海南省咖啡年产量总体呈上升趋势(表1),咖啡原料豆及深加工产品远销欧盟、美国等55 个国家和地区。我国咖啡消费力也不容小觑,2021年我国饮用咖啡的消费者达3.3亿 人,且咖啡消费年增长率达20%,远高于全球2%的年均增长率[6],市场需求持续增加。咖啡中含有咖啡因、绿原酸、葫芦巴碱等多种生物活性成分,具有抗氧化、降血脂、降低心血管疾病风险的功效[7]。但研究表明,咖啡中AA含量较高,有的品种甚至高达890 μg/kg[8]。波兰国民膳食AA(0.43 μg/(kg mb·d))的来源中,咖啡占比19%,仅次于面包、薯片[9]。日本一项研究表明,饮用咖啡的消费者AA暴露水平(169 ng/(kg mb·d))明显高于其他消费者(75 ng/(kg mb·d))[10]。可见咖啡是摄入AA的重要来源。
表1 我国咖啡主要生产地种植面积及产量统计[11-12]
Table 1 Statistics of planting area and output of major coffee production areas in China[11-12]
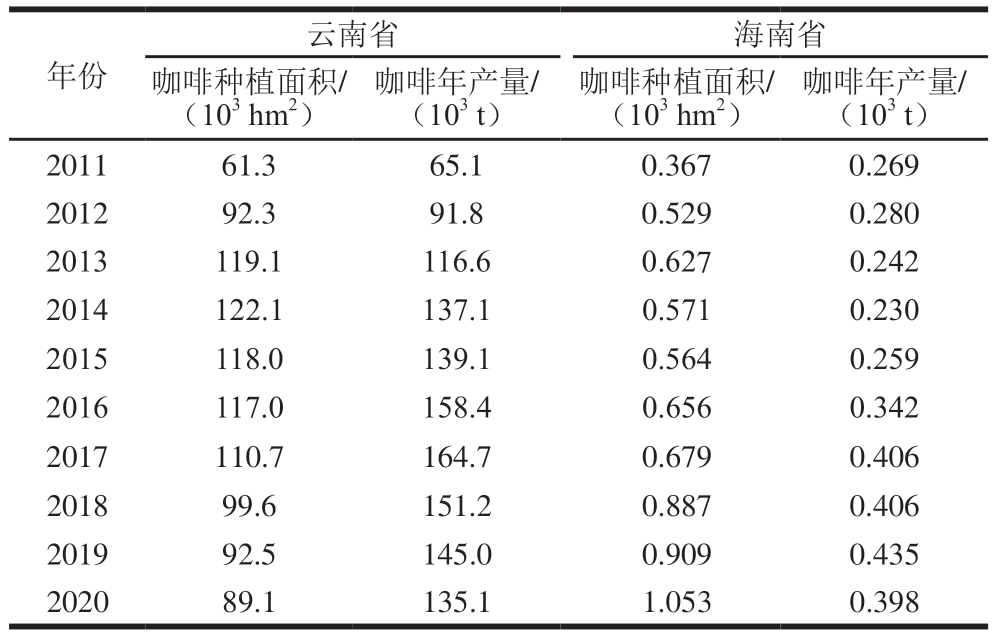
年份咖啡年产量/(103 t)2011 61.3 65.1 0.367 0.269 2012 92.3 91.8 0.529 0.280 2013 119.1 116.6 0.627 0.242 2014 122.1 137.1 0.571 0.230 2015 118.0 139.1 0.564 0.259 2016 117.0 158.4 0.656 0.342 2017 110.7 164.7 0.679 0.406 2018 99.6 151.2 0.887 0.406 2019 92.5 145.0 0.909 0.435 2020 89.1 135.1 1.053 0.398云南省 海南省咖啡种植面积/(103 hm2)咖啡年产量/(103 t)咖啡种植面积/(103 hm2)
随着咖啡消费群体数量的不断扩大,通过咖啡摄入AA的食品安全风险日益受到消费者关注。因此,本文综述了AA毒性以及咖啡中AA形成机制、关键影响因素、控制方法等方面的研究进展,并对未来管理法规及控制技术应用等进行了展望。
1 AA毒性机制
食品中的AA进入机体后,在单加氧酶细胞色素P450 2E1酶的催化下生成环氧丙酰胺(glycidamide,GA),AA与GA都可与还原性谷胱甘肽(glutathione,GSH)结合[13],导致活性氧含量增多,氧化损伤与抗氧化损伤系统之间不平衡,引发氧化应激[14-15]。AA通过引起细胞内活性氧、活性氮等含量增多[16],引发线粒体功能障碍等氧化损伤,诱导细胞凋亡,进一步对肝脏系统、神经系统、生殖系统等产生危害。
AA被机体吸收后,率先在肝脏中代谢,代谢过程中引发氧化应激,造成肝脏损伤[17-18]。采用25 mg/(kg mb·d)AA灌胃处理大鼠21 d后,大鼠肝脏中GSH、谷胱甘肽转移酶(glutathione S-transferase,GST)等氧化应激指标降低,造成肝脏细胞损伤[19]。进一步分离出大鼠肝细胞发现,AA可以激活半胱氨酸蛋白酶-3(Caspase-3),引发线粒体、溶酶体损伤,从而介导肝细胞凋亡[20]。Tan Xintong等[21]在小鼠的每日饮用水中加入质量分数0.003% AA,饲养16 周后发现AA组小鼠的肝脏线粒体呈现不规则形状,PTEN基因诱导激酶蛋白1等自噬蛋白表达水平增加,线粒体自噬加剧,从而加速细胞凋亡和坏死。可见高、低剂量的AA均能破坏线粒体结构,进一步导致肝脏细胞凋亡。肝脏能代谢和吸收90%以上的AA,被吸收的AA随血液进入机体全身。
代谢吸收的AA可对神经系统造成一定的损伤。流行病学研究表明,AA对职业暴露人群具有神经毒性。目前临床研究的慢性AA中毒患者通常表现为四肢麻木、肌力减退,甚至肢端肌肉萎缩、无法行走[22]。接触AA的工人血清中肿瘤标志物神经元特异性烯醇化酶水平显著升高[23],可进一步诱发神经母细胞瘤等神经性疾病。动物水平上,AA的急性和慢性中毒均能引起中枢和周围神经损伤,造成大鼠、小鼠的神经元退化和海马体损伤,行为学表现为四肢力量不足、运动障碍和空间记忆能力降低[24-26]。有学者持续用0.2~2.0 mg/(kg mb·d)的AA灌胃Wistar大鼠5 周,结果表明AA能激活小胶质细胞,并引起脑组织中白细胞介素(interleukin,IL)-1β、IL-6和IL-18等蛋白表达水平上调,这些促炎因子可以进一步诱导大脑皮层发生炎症反应[27],从而破坏血脑屏障,影响神经系统内的物质转运,造成神经系统的功能紊乱和代谢失调。细胞水平上,AA可通过多条通路引发神经细胞的氧化应激反应,通过激活小鼠星形胶质细胞和小胶质细胞的核因子E2相关因子2、核因子κB(nuclear factor κB,NF-κB)通路,导致细胞内活性氧与抗氧化系统失衡,进而引起细胞炎症反应,并造成细胞凋亡[14,28]。研究发现,AA可破坏神经细胞线粒体结构,造成线粒体DNA损伤、能量代谢失调[29],最终导致细胞凋亡或坏死。可见在神经系统中,氧化应激、线粒体功能障碍是AA发挥毒性的重要机制。
AA具有较强的生殖毒性,能够影响动物的生育能力和生殖器官正常活动。Haleem等[30]对雄性白化鼠进行持续8 周的AA灌胃处理(10 mg/(kg mb·d)),发现AA可激活雄性大鼠睾丸内NF-κB通路,并下调紧密连接蛋白表达,氧化应激状态的持续增强使睾丸细胞凋亡数量增多、睾丸间质细胞功能异常,导致睾丸毒性。AA灌胃Wistar雌性大鼠血清中孕酮和雌二醇等激素水平降低,不同生长阶段的卵泡均发生凋亡,卵巢内细胞凋亡和自噬增多,卵泡刺激素、黄体生成素等激素分泌异常,影响卵泡发育和黄体形成,最终导致卵巢功能障碍[31]。AA通过加剧生殖器官内氧化应激反应,引起细胞凋亡和组织病变,降低精子活力、卵巢或睾丸质量[32-34],使动物的生育能力下降。
氧化应激是AA在机体中引发各种损伤的主要途径,除肝脏毒性、神经毒性和生殖毒性外,AA也会对膀胱[35]、肾脏[36]等器官产生毒性,并能加剧肿瘤发展进程[37],还有研究表明膳食AA的摄入显著增加了子宫内膜癌和卵巢癌的发病率[38]。因此,降低AA在食品中的含量可以从源头上减少AA的毒性危害。
2 咖啡中AA的形成机制
咖啡中的AA主要来源于还原糖与天冬酰胺(asparagine,ASN)发生的美拉德反应。生咖啡豆中蔗糖相对含量占5%~9%,在烘焙中蔗糖的糖苷键断裂,分解产生果糖和葡萄糖[39-40],是生成AA的重要前体物质[41],ASN相对含量占0.70%~1.26%,与蔗糖相比相对含量较低,是AA生成的主要限制因素[42]。
高温烘焙过程中,咖啡豆处于低水分含量、酸性条件(pH 4.5~5.5)下,果糖易发生烯醇化反应,生成高活性的呋喃果糖基阳离子(fructofuranosyl cation,FFC)[43],FFC在低水分活度下极易环化脱水,形成5-羟甲基糠醛(5-hydroxymethylfurfural,HMF)[44]。葡萄糖则可以与氨基酸发生美拉德反应形成Schiff碱,随后Schiff碱发生1,2-烯醇化,生成1,2-烯胺醇[45],并进一步脱氨脱水缩合形成HMF。此外,葡萄糖可以脱水形成3-脱氧葡萄糖酮(3-deoxyglucosone,3-DG)[46],3-DG进一步脱水形成HMF。
果糖、葡萄糖通过多种途径生成的HMF,与ASN反应生成中间体3-氨基丙酰胺(3-aminopropionamide,3-APA),并经历脱氨形成AA[47-48]。在250 ℃条件下加热蔗糖,最终生成的HMF中90%来源于果糖,10%来源于葡萄糖[44],可见FFC的快速反应大大加快了果糖的消耗。此外,葡萄糖和果糖也能相互转化[49],在果糖快速消耗的情况下,葡萄糖可以烯醇化成果糖参与生成AA。HMF是美拉德反应在酸性条件下的常见产物,由于咖啡果糖烯醇化和FFC脱水成HMF的反应速率高于其他途径,因此,果糖-FFC-HMF反应途径是咖啡烘焙中AA形成的最主要途径(图1)[40,50]。
3 咖啡加工工艺对AA生成的影响
咖啡的生产制备流程主要包括原料筛选、采后处理、烘焙、研磨萃取等工艺。依据加工方式的不同,咖啡主要分为速溶咖啡和现磨咖啡,现磨咖啡又衍生出土耳其咖啡、意式咖啡、美式咖啡等多种品类。咖啡鲜果经采收、去皮、干燥、分级得到咖啡豆,咖啡豆原料中蔗糖和ASN的含量、咖啡豆研磨工艺、烘焙温度、烘焙时间以及不同的咖啡萃取冲泡方式是影响咖啡AA含量的重要因素。
3.1 原料选择
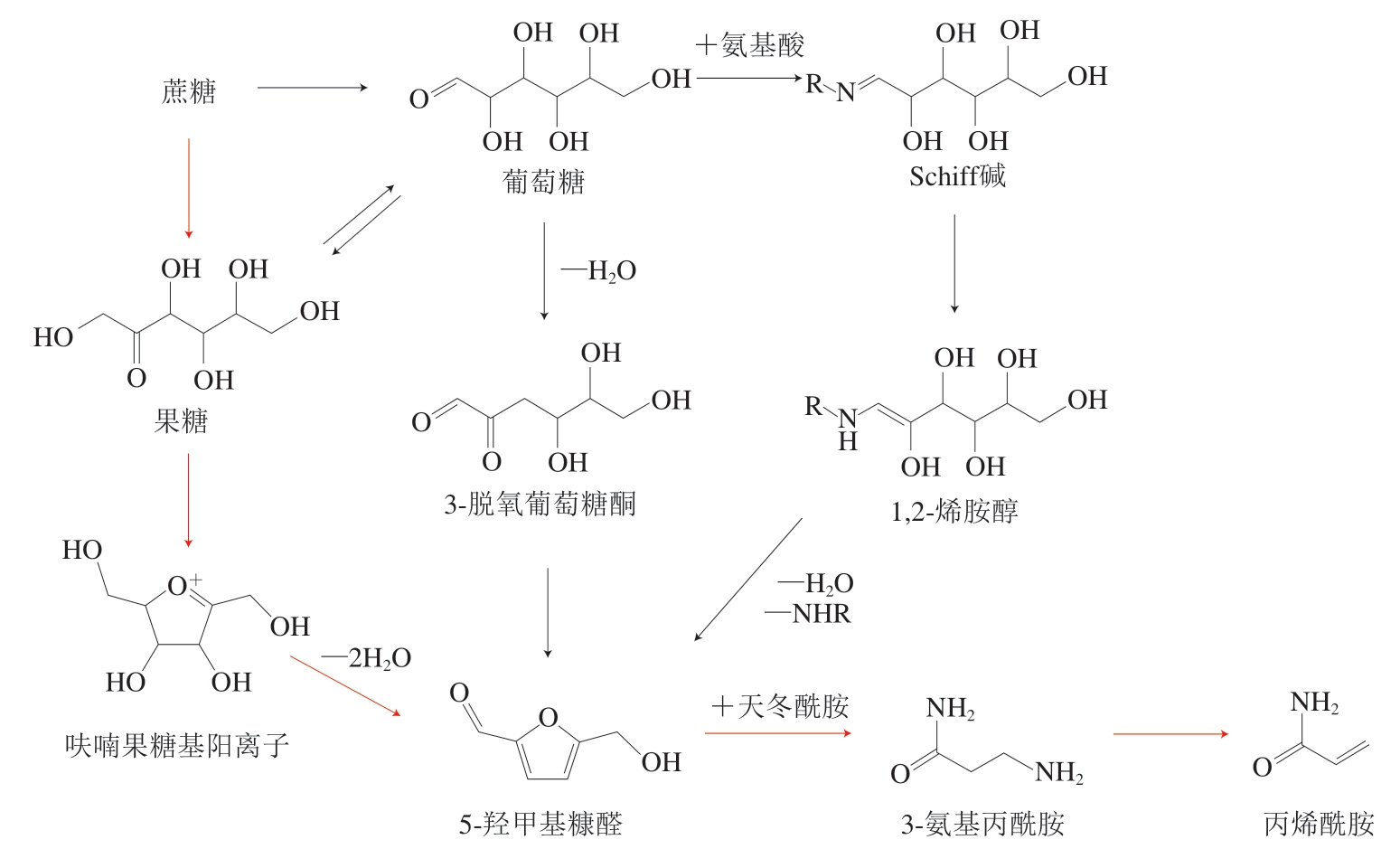
图1 咖啡中丙烯酰胺的主要形成机制
Fig. 1 Major formation mechanism of acrylamide in coffee
依据咖啡豆的种类,咖啡品种主要分为小粒种咖啡(阿拉比卡咖啡)、中粒种咖啡(罗布斯塔咖啡)和大粒种咖啡(利比里卡咖啡)。利比里卡咖啡豆由于香气差、风味苦和豆粒大小不一,不适用于商业生产,目前大面积种植的咖啡豆是阿拉比卡和罗布斯塔,前者是最主要的商用咖啡品种。不同的咖啡生产原料中AA前体含量也不相同,阿拉比卡咖啡豆的蔗糖含量为73 mg/g,高于罗布斯塔咖啡豆的蔗糖含量(45 mg/g)。氨基酸含量则与之相反,阿拉比卡咖啡豆中的ASN、苯丙氨酸和丙氨酸等多数氨基酸含量低于罗布斯塔咖啡豆[51]。因此,罗布斯塔咖啡豆比阿拉比卡咖啡豆更容易生成AA,烘焙后的罗布斯塔咖啡豆AA含量(708 ng/g)明显高于阿拉比卡咖啡豆(374 ng/g)[52-53]。
3.2 烘焙工艺
采集后的咖啡果经干制法[54]或湿制法[55]加工获得生咖啡豆,再经过烘焙获得熟咖啡豆,如图2所示。通常烘焙温度为150~200 ℃,深度烘焙温度也可高于200 ℃[56-57]。烘焙工艺不仅是咖啡风味的来源,而且是影响AA含量的关键因素。AA在烘焙过程中总体呈现先增加后减少的趋势[58-60]。Hu Huihui等[61]实时监测咖啡烘焙过程中AA含量变化发现,烘烤温度从室温升高至220 ℃的过程中,在180 ℃时咖啡豆中的AA含量最高,随后AA含量持续下降。有研究将阿拉比卡和罗布斯塔咖啡豆烘焙温度分别从90 ℃上升到215 ℃,在10 min时达到175~177 ℃,阿拉比卡和罗布斯塔咖啡的AA含量分别达到最高水平(1 045±28)μg/kg和(795±25)μg/kg,随后AA含量持续下降[62]。咖啡烘焙早期AA含量的升高与ASN大量消耗相关,同时某些氨基酸可以促进AA的形成,如咖啡中的丝氨酸可以热分解形成丙酮酸、丙烯酸和游离氨来加速AA的产生[63]。随后AA含量的下降主要有两个原因:一是AA与咖啡类黑素的化学相互作用,类黑素蛋白质骨架的亲核氨基可与AA发生迈克尔加成反应[64];二是AA具有挥发性,Badoud等[65]使用14C标记AA发现,在咖啡烘焙过程中,有28%被标记的AA降解成了挥发性化合物。
咖啡豆烘焙程度是影响AA含量的关键因素。Schouten等[59]采用热空气法烘焙阿拉比卡咖啡豆,对比了浅度烘焙(烘焙6 min、最终温度147 ℃)、中度烘焙(烘焙11 min、最终温度172 ℃)、深度烘焙(烘焙18 min、最终温度191 ℃)获得的咖啡豆中AA含量以及咖啡品质,结果发现,中度烘焙咖啡AA积累量最多[66],浅度烘焙以及深度烘焙的咖啡豆中AA含量水平相对较低。深度烘焙咖啡由于咖啡烘焙时间较长,ASN和蔗糖消耗完全,类黑素含量逐渐增多,高温促进了AA与类黑素的亲核加成反应和AA挥发,使得AA含量下降。
值得注意的是,3 种烘焙程度对咖啡豆烘焙后的品质也有显著的影响。浅度烘焙得到的咖啡酸度较高、风味欠佳,苦味和涩度不足,消费者接受度低。中度烘焙咖啡的甲硫醇、2-糠基硫醇等咖啡香气成分不断积累,产生咖啡独有的香味[56],凭借其鲜明风味为消费者所喜爱。而深度烘焙咖啡伴随逐渐浓郁的香气,2-糠基硫醇含量持续增加,二甲基硫醚及部分醛类物质水平明显降低,苦涩程度较高,口感最醇厚。浅度和中度烘焙的咖啡中AA含量分别可达600~700 μg/kg和300~1 130 μg/kg,均高于深度烘焙咖啡(100~200 μg/kg)。
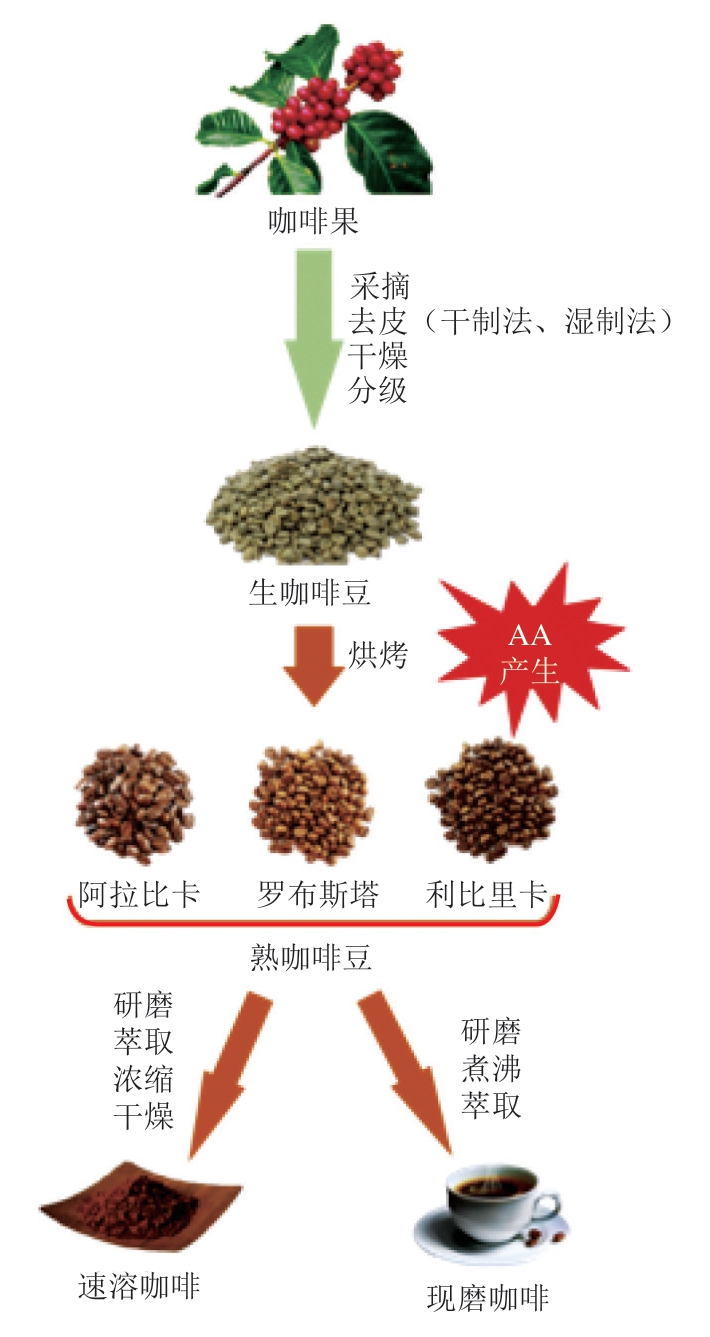
图2 咖啡的生产与加工过程
Fig. 2 Production and processing of coffee
烘焙后的咖啡在不同的贮存条件下AA含量也会发生变化。姚子升[67]将焙炒后的咖啡置于-18、-4、25、37 ℃下贮存12 个月,发现37 ℃贮存最有利于降低AA水平。Delatour等[68]发现室温下贮存烘焙后的咖啡,6~12 个月后AA含量降低40%~60%。可见烘焙咖啡中的AA并不稳定,在适宜温度下长期贮存时会缓慢分解。
3.3 咖啡加工方式
现阶段,市场上较为常见的咖啡产品有现磨咖啡和速溶咖啡两种形式。随着消费水平的提高,口感丰富的现磨咖啡倍受推崇。制备工艺的不同带来了各品类咖啡的独特风味,同时造成咖啡豆烘焙程度、咖啡浓度的差异,因此AA水平也存在显著差异。
烘焙后的咖啡豆经研磨、煮沸、萃取后即为现磨咖啡。而目前现磨咖啡的种类多样,不同国家消费者对咖啡的香气、浓度等有不同的需求,从而产生多种咖啡制作工艺,也影响了终端咖啡饮品中AA含量。例如,土耳其咖啡将咖啡豆研磨极细后直接冲泡,饮用时仍有咖啡粉沉淀,咖啡中AA含量高达50.1 mg/kg[69]。意式咖啡是通过压力诱导95 ℃热水快速冲击咖啡粉、渗透萃取出的高浓度咖啡,具有强烈的香味及苦味,AA含量为38.6 mg/kg[70]。美式咖啡则是在意式咖啡基础上加水稀释制成,或采用滴滤式咖啡壶缓慢萃取,含有较低的苦味和香味,AA含量最低,为2.1 mg/kg[71]。3 种咖啡AA含量的差异主要缘于其制备过程中咖啡豆研磨、烘焙工艺上的不同。Derossi等[71]指出3 种咖啡的AA含量差异(土耳其咖啡>意式咖啡>美式咖啡)是由于咖啡豆研磨粒径不同。3 种咖啡研磨颗粒平均粒径依次为美式咖啡(710 μm)>意式咖啡(480 μm)>土耳其咖啡(320 μm)。粒径更小则更易溶解,在萃取过程释放更多AA,因此土耳其咖啡的AA含量最高。意式咖啡普遍采用高压萃取方式,咖啡浓度高,因而AA含量较高。而美式咖啡的烘焙程度和咖啡浓度低,故AA含量较低。
速溶咖啡是在咖啡豆烘焙、研磨、萃取后,进行适当浓缩,再通过喷雾干燥或冷冻干燥得到速溶咖啡粉,包装后流向市场。与现磨咖啡相比,速溶咖啡缺乏优质的香气与风味[72],且在预干燥、喷雾干燥等环节挥发了一部分AA,速溶咖啡中AA含量为96.4~346.5 μg/kg,低于现磨咖啡的AA水平(17.7~776.1 μg/kg)[73]。
4 咖啡中AA的控制方法
咖啡中AA的形成与原料的选择、加工条件和技术等密切相关。添加外源物质通过减少咖啡豆中AA前体的含量或降解生成的AA,以降低咖啡中的AA水平;优化加工技术能影响AA的生成和反应阶段,从而控制咖啡中AA的产生。
4.1 添加外源物质
ASN含量是咖啡中AA生成的主要限制性因素,生咖啡豆中ASN的浓度与烘焙咖啡的AA浓度呈正相关[74]。添加天冬酰胺酶可以降低ASN水平,进而降低咖啡中的AA含量[75-76]。Correa等[77]用5 000 U/kg天冬酰胺酶(EC 3.5.1.1)处理阿拉比卡咖啡豆2 h,烘焙得到的咖啡中AA水平下降59%,并且酶处理对咖啡中绿原酸、咖啡因、咖啡酸等活性物质含量没有显著性影响。有研究从青霉菌NMKA511中分离出的L-天冬酰胺酶(2 000 U/kg)处理阿拉比卡咖啡豆后,分别进行浅度(210 ℃、20 min)和深度烘焙(240 ℃、25 min),最终两种咖啡产品中AA相对含量分别降低了80.7%和75.8%[78]。天冬酰胺酶通过降低ASN水平从而阻碍了AA生成,而添加丙烯酰胺酶可以将生成的AA降解。从真养产碱杆菌AUM-01中提取出的丙烯酰胺酶可以将AA降解成丙烯酸和氨,采用该酶在70 ℃下处理咖啡,咖啡中AA浓度降低50%~70%(初始浓度1.4 mmol/L)[79]。Bedade等[80]使用壳聚糖和海藻酸钙制成海藻酸盐-壳聚糖复合微珠,将从草酸盐贪铜菌ICTDB921中提取的丙烯酰胺酶共价固定化,随后作用于含有质量浓度100~500 mg/L AA的速溶咖啡,30~65 ℃下60 min内可以完全降解AA。与游离酶处理相比,固定化酶可以扩大酶的最适作用温度范围,更有助于减少咖啡中AA的积累。酶可以高效地作用于相应底物,从而降低AA含量,但成本相对较高,不利于在食品工业生产中推广。
添加某些氨基酸也能减少咖啡中AA的含量。在含质量浓度6.2 μg/L AA的罐装黑咖啡中添加1.05 mg/g半胱氨酸,121 ℃下处理6 min,半胱氨酸的巯基基团能与AA的碳碳双键发生亲核加成[81-82],AA相对含量降低至原本的90%[83]。赖氨酸、甘氨酸降低AA含量的效果弱于半胱氨酸,而胱氨酸、酪氨酸的加入对AA的形成没有显著影响[84]。但半胱氨酸加热会释放出硫化氢,可能会对咖啡的风味产生不良影响。
除了降解AA前体和降解AA,在AA产生的进程中阻碍HMF的反应也是有效降低AA含量的方法。在180 ℃下,儿茶素可与HMF缩合形成二聚体加合物,从而减少AA的合成,将质量浓度5 mg/mL儿茶素添加到HMF+ASN(均为10 mmol/L)模型中,能降低70%的AA水平[85]。由此推测,将儿茶素加入到咖啡中也能有效控制AA的形成,同时降低另一危害物HMF的含量。此外,酵母菌既可以将AA前体HMF转化为羟甲基糠醇,也能将AA降解成丙烯酸。研究发现,在含1 020 μg/kg AA的速溶咖啡中加入1%酵母和10%蔗糖,发酵72 h后AA含量降低62%[86],蔗糖可为酵母细胞提供充足碳源,酵母菌发酵对人类无害且易于适配咖啡生产线,但其对咖啡风味和口感的影响仍需探究。
综上,在咖啡中添加天冬酰胺酶、丙烯酰胺酶、含有巯基的氨基酸或蛋白质、酵母菌、儿茶素等外源物质可以有效降低AA含量,但添加时需考虑对美拉德反应的促进作用和对咖啡风味的影响。
4.2 优化加工技术
咖啡的工业化生产中,常采用滚筒烘焙机常压加热咖啡豆,而新型咖啡加工技术可以在提高烘焙效率、缩短烘焙时间的同时降低AA的含量。Rattanarat等[87]采用250 ℃的过热蒸汽烘焙罗布斯塔咖啡豆,与常规的热空气烘焙法相比,烘焙温度和水分活度显著提高,烘焙时间显著缩短,同时过高温度下AA挥发和分解增强,所获得的中度烘焙(亮度值25)和深度烘焙(亮度值20)的咖啡中AA相对含量分别降低了84%和75%。此外,真空烘焙也是减少咖啡中AA含量的有效手段,低压条件下水分蒸发速率加快,对水溶性低分子质量化合物产生汽提作用,从而提高了AA的挥发速率。与常压烘焙的咖啡相比,200 ℃下真空烘焙(0.15 kPa)的阿拉比卡咖啡豆中AA相对含量减少约50%[88]。
抑制咖啡中AA形成的措施多种多样,适当地联合采用多种措施还有一定的协同作用,例如在使用天冬酰胺酶之前先用热蒸汽法预处理咖啡豆,可以增大咖啡豆内部孔隙直径,从而增大酶与咖啡豆中ASN接触的表面积,提高酶的利用率[77]。添加天冬酰胺酶、丙烯酰胺酶、酵母等外源物质,以及应用过热蒸汽、真空处理等新型加工技术均有利于减少咖啡产品中AA含量,但相关研究尚不完善,未来可增加对多种加工手段对比或协同作用的研究,咖啡工业生产中AA的控制措施仍值得探讨。
5 结 语
咖啡作为风靡全球的饮品,欧美、阿拉伯地区的众多国家饮用咖啡已成日常习惯,近年来我国咖啡的消耗量也持续增大。咖啡摄入已成为膳食中AA暴露的重要来源之一,会给人体带来不容忽视的AA毒性风险。欧盟委员会在2017年提出食品中AA抑制措施的应用建议和AA的推荐限定水平,其中建议咖啡中AA含量应当低于400 μg/kg[89]。而我国现有的食品安全法规尚未明确食品中AA的安全限量和抑制措施。此外,我国咖啡产量近10 年来已大幅上升,以云南小粒咖啡为代表的中国咖啡正逐渐扩大市场,而我国本土的咖啡加工技术、AA等危害物控制研究较少。本文总结了AA的毒性和咖啡中AA控制的工艺和技术,可为推动制定我国相关食品AA安全限量标准提供一定的参考。
从减少AA摄入考虑,更推荐消费者饮用深度烘焙咖啡,但不同国家和地区的消费者对咖啡烘焙程度存在一定的偏好性,例如美国消费者更喜欢轻度烘焙咖啡,中度和深度烘焙咖啡更受南欧消费者青睐,引导消费者统一选择深度烘焙咖啡并不现实,应当采取一定的措施减少各种类型咖啡中AA的形成,从而降低通过咖啡摄入AA的风险。然而,目前咖啡中AA的控制研究还停留在实验阶段,尚未在工业化生产规模中得到验证,对于是否会产生其他有害物质也未全面探究。因此,咖啡中AA的抑制措施仍是亟待解决的食品安全问题。未来针对AA在食品工业化生产中的控制措施及作用机理仍需进一步深入探究,以便后续为科学评估和合理制定食品中危害物限值提供科学依据。
[1]European Food Safety Authority (EFSA). Scientific opinion on acrylamide in food[J]. EFSA Journal, 2015, 13(6): 4104. DOI:10.2903/j.efsa.2015.4104.
[2]GAO Jie, ZHAO Yunfeng, ZHU Feng, et al. Dietary exposure of acrylamide from the fifth Chinese total diet study[J]. Food and Chemical Toxicology, 2016, 87: 97-102. DOI:10.1016/j.fct.2015.11.013.
[3]International Agency for Research on Cancer (IARC). IARC monographs on the evaluation of the carcinogenic risk of chemicals to humans[M]. Lyon: IARC. 1994: 389-433.
[4]丁莉, 侯媛媛. 中国咖啡产业形势分析及发展建议[J]. 热带农业科学, 2019, 39(3): 105-109.
[5]李维锐, 周仕峥. 我国咖啡产业发展现状及前景[J]. 热带农业科学,2011, 31(10): 105-108. DOI:10.3969/j.issn.1009-2196.2011.10.025.
[6]文志华, 毕晓菲, 鲁维艳. 中国咖啡消费趋势浅谈[J]. 农产品加工,2018(2): 69-70.
[7]MARTINI D, DEL BO C, TASSOTTI M, et al. Coffee consumption and oxidative stress: a review of human intervention studies[J].Molecules, 2016, 21(8): 979. DOI:10.3390/molecules21080979.
[8]European Food Safety Authority (EFSA). Update on acrylamide levels in food from monitoring years 2007 to 2010[J]. EFSA Journal, 2012,10(10): 2938. DOI:10.2903/j.efsa.2012.2938.
[9]MOJSKA H, GIELECINSKA I, SZPONAR L, et al. Estimation of the dietary acrylamide exposure of the Polish population[J]. Food and Chemical Toxicology, 2010, 48(8/9): 2090-2096. DOI:10.1016/j.fct.2010.05.009.
[10]KAWAHARA J, ZHENG Y Z, TERUI M, et al. Dietary exposure to acrylamide in a group of Japanese adults based on 24-hour duplicate diet samples[J]. Food Additives and Contaminants Part A-Chemistry Analysis Control Exposure and Risk Assessment, 2019, 36(1): 15-25.DOI:10.1080/19440049.2018.1555378.
[11]云南省统计局. 橡胶、咖啡和香料作物面积和产量[EB/OL].(2021-12-23)[2021-12-25]. http://stats.yn.gov.cn/tjsj/tjnj/202112/t20211223_1071686.html.
[12]海南省统计局. 各市县主要热带作物面积和产量[EB/OL].(2021-10-27)[2021-12-25]. http://stats.hainan.gov.cn/tjj/tjsu/ndsj/2021/index.html.
[13]KWOLEK-MIREK M, ZADRĄG-TĘCZA R, BEDNARSKA S, et al. Yeast saccharomyces cerevisiae devoid of Cu, Znsuperoxide dismutase as a cellular model to study acrylamide toxicity[J]. Toxicology in Vitro, 2011, 25(2): 573-579. DOI:10.1016/j.tiv.2010.12.007.
[14]ZHAO Mengyao, WANG F S L, HU Xiaosong, et al. Effect of acrylamide-induced neurotoxicity in a primary astrocytes/microglial co-culture model[J]. Toxicology in Vitro, 2017, 39: 119-125.DOI:10.1016/j.tiv.2016.11.007.
[15]HAJIMOHAMMADI B, ATHARI S M, ABDOLLAHI M, et al. Oral administration of acrylamide worsens the inflammatory responses in the airways of asthmatic mice through agitation of oxidative stress in the lungs[J]. Frontiers in Immunology, 2020, 11: 1940. DOI:10.3389/fimmu.2020.01940.
[16]杨柳青, 董丽, 罗颖华, 等. 氧化应激参与丙烯酰胺致神经细胞凋亡及炎症反应的研究进展[J]. 食品安全质量检测学报, 2020, 11(18):6265-6270. DOI:10.19812/j.cnki.jfsq11-5956/ts.2020.18.001.
[17]RESHMITHA T R, NISHA P. Lycopene mitigates acrylamide and glycidamide induced cellular toxicity via oxidative stress modulation in HepG2 cells[J]. Journal of Functional Foods, 2021, 80(4): 104390.DOI:10.1016/j.jff.2021.104390.
[18]江国勇, 雷艾彤, 杨莹, 等. 黑灵芝多糖对丙烯酰胺致大鼠肝脏氧化损伤的保护作用[J]. 食品科学, 2020, 41(1): 121-126. DOI:10.7506/spkx1002-6630-20190623-269.
[19]ALTINOZ E, TURKOZ Y, VARDI N. The protective effect of N-acetylcysteine against acrylamide toxicity in liver and small and large intestine tissues[J]. Bratislava Medical Journal, 2015, 116(4):252-258. DOI:10.4149/bll_2015_049.
[20]SEYDI E, RAJABI M, SALIMI A, et al. Involvement of mitochondrialmediated caspase-3 activation and lysosomal labilization in acrylamide-induced liver toxicity[J]. Toxicological and Environmental Chemistry, 2015, 97(5): 563-575. DOI:10.1080/02772248.2015.1047671.
[21]TAN Xintong, ZHAO Tong, WANG Zihan, et al. Acrylamide defects the expression pattern of the circadian clock and mitochondrial dynamics in C57BL/6J mice liver and HepG2 cells[J]. Journal of Agricultural and Food Chemistry, 2018, 66(39): 10252-10266.DOI:10.1021/acs.jafc.8b02473.
[22]牛燕英, 韩萍, 菅向东, 等. 慢性丙烯酰胺中毒早期综合康复治疗的疗效观察[J]. 中国工业医学杂志, 2021, 34(4): 317-319.DOI:10.13631/j.cnki.zggyyx.2021.04.010.
[23]鄂蒙, 王淑娥, 耿岩, 等. 丙烯酰胺接触工人血清神经元特异性烯醇化酶活力及影响因素[J]. 环境与健康杂志, 2013, 30(5): 414-416.DOI:10.16241/j.cnki.1001-5914.2013.05.023.
[24]TAN Xintong, YE Jin, LIU Weiqi, et al. Acrylamide aggravates cognitive deficits at night period via the gut-brain axis by reprogramming the brain circadian clock[J]. Archives of Toxicology,2019, 93(2): 467-486. DOI:10.1007/s00204-018-2340-7.
[25]FAROUK S M, GAD F A, ALMEER R, et al. Exploring the possible neuroprotective and antioxidant potency of lycopene against acrylamide-induced neurotoxicity in rats’ brain[J]. Biomedicine and Pharmacotherapy, 2021, 138(5): 111458. DOI:10.1016/j.biopha.2021.111458.
[26]FARAG O M, ABD-ELSALAM R M, OGALY H A, et al.Metabolomic profiling and neuroprotective effects of purslane seeds extract against acrylamide toxicity in rat’s brain[J]. Neurochemical Research, 2021, 46(4): 819-842. DOI:10.1007/s11064-020-03209-6.
[27]ZONG C, HASEGAWA R, URUSHITANI M, et al. Role of microglial activation and neuroinflammation in neurotoxicity of acrylamide in vivo and in vitro[J]. Archives of Toxicology, 2019, 93(7): 2007-2019.DOI:10.1007/s00204-019-02471-0.
[28]BU Qian, HUANG Yan, LI Meng, et al. Acrylamide exposure represses neuronal differentiation, induces cell apoptosis and promotes tau hyperphosphorylation in hESC-derived 3D cerebral organoids[J]. Food and Chemical Toxicology, 2020, 144: 111643. DOI:10.1016/j.fct.2020.111643.
[29]CHEN Jonghang, YANG Chenghsien, WANG Yanshiu, et al.Acrylamide-induced mitochondria collapse and apoptosis in human astrocytoma cells[J]. Food and Chemical Toxicology, 2013, 51(1):446-452. DOI:10.1016/j.fct.2012.10.025.
[30]HALEEM E N A A, HASAN W Y S, ARAFA H M M. Therapeutic effects of thymoquinone or capsaicin on acrylamide-induced reproductive toxicity in rats mediated by their effect on oxidative stress, inflammation, and tight junction integrity[J]. Drug and Chemical Toxicology, 2021, 2021: 1-13. DOI:10.1080/01480545.2021.1942485.
[31]ALDAWOOD N, ALREZAKI A, ALANAZI S, et al. Acrylamide impairs ovarian function by promoting apoptosis and affecting reproductive hormone release, steroidogenesis and autophagy-related genes: an in vivo study[J]. Ecotoxicology and Environmental Safety,2020, 197: 110595. DOI:10.1016/j.ecoenv.2020.110595.
[32]DUAN Xing, WANG Qiaochu, CHEN Kunlin, et al. Acrylamide toxic effects on mouse oocyte quality and fertility in vivo[J]. Scientific Reports, 2015, 5: 11562. DOI:10.1038/srep11562.
[33]ALKARIM S, ELASSOULI S, ALI S, et al. Effects of low dose acrylamide on the rat reproductive organs structure, fertility and gene integrity[J]. Asian Pacific Journal of Reproduction, 2015, 4(3): 179-187. DOI:10.1016/j.apjr.2015.05.001.
[34]杨建一, 杨媛媛, 马红莲, 等. 丙烯酰胺致小鼠睾丸和附睾组织氧化损伤作用的研究[J]. 毒理学杂志, 2011, 25(3): 211-213.DOI:10.16421/j.cnki.1002-3127.2011.03.013.
[35]IKEDA S, SOBUE T, KITAMURA T, et al. Dietary acrylamide intake and the risks of renal cell, prostate, and bladder cancers: a Japan public health center-based prospective study[J]. Nutrients, 2021, 13(3): 780.DOI:10.3390/nu13030780.
[36]RAJEH N A, AL-DHAHERI N M. Antioxidant effect of vitamin E and 5-aminosalicylic acid on acrylamide induced kidney injury in rats[J]. Saudi Medical Journal, 2017, 38(2): 132-137. DOI:10.15537/smj.2017.2.16049.
[37]JOHNSON K A, GORZINSKI S J, BODNER K M, et al. Chronic toxicity and oncogenicity study on acrylamide incorporated in the drinking water of Fischer 344 rats[J]. Toxicology and Applied Pharmacology, 1986,85(2): 154-168. DOI:10.1016/0041-008x(86)90109-2.
[38]OBÓN-SANTACANA M, KAAKS R, SLIMANI N, et al. Dietary intake of acrylamide and endometrial cancer risk in the European prospective investigation into cancer and nutrition cohort[J]. British Journal of Cancer, 2014, 111(5): 987-997. DOI:10.1038/bjc.2014.328.
[39]GÖNCÜOĞLU T N, GÖKMEN V. Maillard reaction and caramelization during hazelnut roasting: a multiresponse kinetic study[J]. Food Chemistry, 2017, 221: 1911-1922. DOI:10.1016/j.foodchem.2016.11.159.
[40]HAMZALIOĞLU A, GÖKMEN V. 5-Hydroxymethylfurfural accumulation plays a critical role on acrylamide formation in coffee during roasting as confirmed by multiresponse kinetic modelling[J]. Food Chemistry, 2020, 318: 126467. DOI:10.1016/j.foodchem.2020.126467.
[41]SCHOUTEN M A, TAPPI S, ROMANI S. Acrylamide in coffee:formation and possible mitigation strategies: a review[J]. Critical Reviews in Food Science and Nutrition, 2020, 60(22): 3807-3821.DOI:10.1016/j.foodchem.2020.128514.
[42]PEDRESCHI F, MARIOTTI M S, GRANBY K. Current issues in dietary acrylamide: formation, mitigation and risk assessment[J].Journal of the Science of Food and Agriculture, 2014, 94(1): 9-20.DOI:10.1002/jsfa.6349.
[43]DELATOUR T, HUERTAS-PÉREZ J F, DUBOIS M, et al. Thermal degradation of 2-furoic acid and furfuryl alcohol as pathways in the formation of furan and 2-methylfuran in food[J]. Food Chemistry,2020, 303: 125406. DOI:10.1016/j.foodchem.2019.125406.
[44]LOCAS C P, YAYLAYAN V A. Isotope labeling studies on the formation of 5-(hydroxymethyl)-2-furaldehyde (HMF) from sucrose by pyrolysis-GC/MS[J]. Journal of Agricultural and Food Chemistry,2008, 56(15): 6717-6123. DOI:10.1021/jf8010245.
[45]HODGE J E. Dehydrated foods, chemistry of browning reactions in model systems[J]. Journal of Agricultural and Food Chemistry, 1953,1(15): 928-943. DOI:10.1021/jf60015a004.
[46]BERK E, HAMZALIOĞLU A, GÖKMEN V. Multiresponse kinetic modelling of 5-hydroxymethylfurfural and acrylamide formation in sesame (Sesamum indicum L.) seeds during roasting[J]. European Food Research and Technology, 2020, 246(12): 2399-2410. DOI:10.1007/s00217-020-03583-z.
[47]GÖKMEN V, KOCADAĞLI T, GÖNCCÜOĞLU N, et al. Model studies on the role of 5-hydroxymethyl-2-furfural in acrylamide formation from asparagine[J]. Food Chemistry, 2012, 132(1): 168-174.DOI:10.1016/j.foodchem.2011.10.048.
[48]GRANVOGL M, SCHIEBERLE P. Thermally generated 3-aminopropionamide as a transient intermediate in the formation of acrylamide[J]. Journal of Agricultural and Food Chemistry, 2006,54(16): 5933-5938. DOI:10.1021/jf061150h.
[49]BRANDS C M J, VAN BOEKEL M A J S. Reactions of monosaccharides during heating of sugar-casein systems: building of a reaction network model[J]. Journal of Agricultural and Food Chemistry, 2001, 49(10): 4667-4675. DOI:10.1021/jf001430b.
[50]CAI Yun, ZHANG Zhenhua, JIANG Shanshan, et al. Chlorogenic acid increased acrylamide formation through promotion of HMF formation and 3-aminopropionamide deamination[J]. Journal of Hazardous Materials, 2014, 268: 1-5. DOI:10.1016/j.jhazmat.2013.12.067.
[51]MURKOVIC M, DERLER K. Analysis of amino acids and carbohydrates in green coffee[J]. Journal of Biochemical and Biophysical Methods, 2006, 69(1/2): 25-32. DOI:10.1016/j.jbbm.2006.02.001.
[52]BAGDONAITE K, DERLER K, MURKOVIC M. Determination of acrylamide during roasting of coffee[J]. Journal of Agricultural and Food Chemistry, 2008, 56(15): 6081-6086. DOI:10.1021/jf073051p.
[53]ALVES R C, SOARES C, CASAL S, et al. Acrylamide in espresso coffee: influence of species, roast degree and brew length[J]. Food Chemistry, 2010, 119(3): 929-934. DOI:10.1016/j.foodchem.2009.07.051.
[54]DO CARMO K B, DO CARMO J C B, KRAUSE M R, et al.Quality of arabic coffee under different processing systems, drying methods and altitudes[J]. Bioscience Journal, 2020, 36(4): 1116-1125.DOI:10.14393/BJ-v36n4a2020-47890.
[55]董红红. 云南小粒咖啡湿法发酵中微生物的研究[D]. 北京: 北京化工大学, 2013: 5-6.
[56]BAGGENSTOSS J, POISSON L, KAEGI R, et al. Coffee roasting and aroma formation: application of different time-temperature conditions[J]. Journal of Agricultural and Food Chemistry, 2008,56(14): 5836-5846. DOI:10.1021/jf800327j.
[57]PRAMUDITA D, ARAKI T, SAGARA Y, et al. Roasting and colouring curves for coffee beans with broad time-temperature variations[J]. Food and Bioprocess Technology, 2017, 10(8): 1509-1520. DOI:10.1007/s11947-017-1912-5.
[58]BAHAR I, DELKER U, ENGELHARDT U H. Acrylamide, furan and methylfurans in coffees with different degree of roast[J]. Deutsche Lebensmittel-Rundschau, 2020, 116(10): 435-440.
[59]SCHOUTEN M A, TAPPI S, ANGELONI S, et al. Acrylamide formation and antioxidant activity in coffee during roasting:a systematic study[J]. Food Chemistry, 2021, 343: 128514.DOI:10.1016/j.foodchem.2020.128514.
[60]GÖKMEN V, ŞENYUVA H Z. Study of colour and acrylamide formation in coffee, wheat flour and potato chips during heating[J]. Food Chemistry, 2006, 99(2): 238-243. DOI:10.1016/j.foodchem.2005.06.054.
[61]HU Huihui, LIU Xiaoling, JIANG Lian, et al. The relationship between acrylamide and various components during coffee roasting and effect of amino acids on acrylamide formation[J]. Journal of Food Processing and Preservation, 2021, 45(5): 1. DOI:10.1111/jfpp.15421.
[62]BERTUZZI T, MARTINELLI E, MULAZZI A, et al. Acrylamide determination during an industrial roasting process of coffee and the influence of asparagine and low molecular weight sugars[J]. Food Chemistry, 2020, 303: 125372. DOI:10.1016/j.foodchem.2019.125372.
[63]YAYLAYAN V A, STADLER R H. Acrylamide formation in food:a mechanistic perspective[J]. Journal of AOAC International, 2005,88(1): 262-267. DOI:10.5555/jaoi.2005.88.1.262.
[64]PASTORIZA S, RUFIAN-HENARES J A, MORALES F J. Reactivity of acrylamide with coffee melanoidins in model systems[J]. LWTFood Science and Technology, 2012, 45(2): 198-203. DOI:10.1016/j.lwt.2011.08.004.
[65]BADOUD F, GOECKENER B, SEVERIN K, et al. Fate of acrylamide during coffee roasting and in vitro digestion assessed with carbon 14-and carbon 13-labeled materials[J]. Food Chemistry, 2020, 320:126601. DOI:10.1016/j.foodchem.2020.126601.
[66]GRANBY K, FAGT S. Analysis of acrylamide in coffee and dietary exposure to acrylamide from coffee[J]. Analytica Chimica Acta, 2004,520(1/2): 177-182. DOI:10.1016/j.aca.2004.05.064.
[67]姚子升. 降低焙炒咖啡中丙烯酰胺含量的方法研究[J]. 轻工标准与质量, 2018(6): 44-45. DOI:10.19541/j.cnki.issn1004-4108.2018.06.017.
[68]DELATOUR T, PÉRISSET A, GOLDMANN T, et al. Improved sample preparation to determine acrylamide in difficult matrixes such as chocolate powder, cocoa, and coffee by liquid chromatography tandem mass spectroscopy[J]. Journal of Agricultural and Food Chemistry, 2004, 52(15): 4625-4631. DOI:10.1021/jf0498362.
[69]NAOUS G E Z, MERHI A, ABBOUD M I, et al. Carcinogenic and neurotoxic risks of acrylamide consumed through caffeinated beverages among the lebanese population[J]. Chemosphere, 2018, 208:352-357. DOI:10.1016/j.chemosphere.2018.05.185.
[70]CAPORASO N, GENOVESE A, CANELA M D, et al. Neapolitan coffee brew chemical analysis in comparison to espresso, moka and American brews[J]. Food Research International, 2014, 61: 152-160.DOI:10.1016/j.foodres.2014.01.020.
[71]DEROSSI A, RICCI I, CAPORIZZI R, et al. How grinding level and brewing method (Espresso, American, Turkish) could affect the antioxidant activity and bioactive compounds in a coffee cup[J].Journal of the Science of Food and Agriculture, 2018, 98(8): 3198-3207. DOI:10.1002/jsfa.8826.
[72]STOKES C N, O’SULLIVAN M G, KERRY J P. Hedonic and descriptive sensory evaluation of instant and fresh coffee products[J].European Food Research and Technology, 2017, 243(2): 331-340.DOI:10.1007/s00217-016-2747-4.
[73]SURMA M, SADOWSKA-ROCIEK A, CIESLIK E, et al.Optimization of QuEChERS sample preparation method for acrylamide level determination in coffee and coffee substitutes[J]. Microchemical Journal, 2017, 131: 98-102. DOI:10.1016/j.microc.2016.11.021.
[74]AKGÜN B, ARICI M, CAVUŞ F, et al. Application of L-asparaginase to produce high-quality Turkish coffee and the role of precursors in acrylamide formation[J]. Journal of Food Processing and Preservation,2021, 45(6): 1. DOI:10.1111/jfpp.15486.
[75]ALAM S, PRANAW K, TIWARI R, et al. Recent development in the uses of asparaginase as food enzyme[M]// PARAMESWARAN B.Green bio-processes. Berlin: Springer, 2019: 55-81. DOI:10.1007/978-981-13-3263-0_5.
[76]PORTO A C V, FREITAS-SILVA O, SOUZA E F D, et al. Effect of asparaginase enzyme in the reduction of asparagine in green coffee[J].Beverages, 2019, 5(2): 32. DOI:10.3390/beverages5020032.
[77]CORREA C L O, PENHA E D, DOS ANJOS M R, et al. Use of asparaginase for acrylamide mitigation in coffee and its influence on the content of caffeine, chlorogenic acid, and caffeic acid[J]. Food Chemistry, 2021, 338: 128045. DOI:10.1016/j.foodchem.2020.128045.
[78]KHALIL N M, RODRIGUEZ-COUTO S, ABD EL-GHANY M N.Characterization of Penicillium crustosum L-asparaginase and its acrylamide alleviation efficiency in roasted coffee beans at noncytotoxic levels[J]. Archives of Microbiology, 2021, 203(5): 2625-2637. DOI:10.1007/s00203-021-02198-6.
[79]CHA M. Enzymatic control of the acrylamide level in coffee[J].European Food Research and Technology, 2013, 236(3): 567-571.DOI:10.1007/s00217-013-1927-8.
[80]BEDADE D K, SUTAR Y B, SINGHAL R S. Chitosan coated calcium alginate beads for covalent immobilization of acrylamidase: process parameters and removal of acrylamide from coffee[J]. Food Chemistry,2019, 275: 95-104. DOI:10.1016/j.foodchem.2018.09.090.
[81]HIDALGO F J, DELGADO R M, ZAMORA R. Positive interaction between amino and sulfhydryl groups for acrylamide removal[J].Food Research International, 2011, 44(4): 1083-1087. DOI:10.1016/j.foodres.2011.03.013.
[82]ADAMS A, HAMDANI S, VAN LANCKER F, et al. Stability of acrylamide in model systems and its reactivity with selected nucleophiles[J]. Food Research International, 2010, 43(5): 1517-1522.DOI:10.1016/j.foodres.2010.04.033.
[83]NARITA Y, INOUYE K. Decrease in the acrylamide content in canned coffee by heat treatment with the addition of cysteine[J]. Journal of Agricultural and Food Chemistry, 2014, 62(50): 12218-12222.DOI:10.1021/jf5035288.
[84]MESTDAGH F, MAERTENS J, CUCU T, et al. Impact of additives to lower the formation of acrylamide in a potato model system through pH reduction and other mechanisms[J]. Food Chemistry, 2008, 107(1):26-31. DOI:10.1016/j.foodchem.2007.07.013.
[85]QI Yajing, ZHANG Hui, ZHANG Hao, et al. Epicatechin adducting with 5-hydroxymethylfurfural as an inhibitory mechanism against acrylamide formation in maillard reactions[J]. Journal of Agricultural and Food Chemistry, 2018, 66(47): 12536-12543. DOI:10.1021/acs.jafc.8b03952.
[86]AKILLIOGLU H G, GOKMEN V. Mitigation of acrylamide and hydroxymethyl furfural in instant coffee by yeast fermentation[J].Food Research International, 2014, 61: 252-256. DOI:10.1016/j.foodres.2013.07.057.
[87]RATTANARAT P, CHINDAPAN N, DEVAHASTIN S. Comparative evaluation of acrylamide and polycyclic aromatic hydrocarbons contents in Robusta coffee beans roasted by hot air and superheated steam[J]. Food Chemistry, 2021, 341(1): 128266. DOI:10.1016/j.foodchem.2020.128266.
[88]ANESE M, NICOLI M C, VERARDO G, et al. Effect of vacuum roasting on acrylamide formation and reduction in coffee beans[J]. Food Chemistry, 2014, 145: 168-172. DOI:10.1016/j.foodchem.2013.08.047.
[89]European Commission. Commission Regulation (EU) 2017/2158 of 20 November 2017 establishing mitigation measures and benchmark levels for the reduction of the presence of acrylamide in food[J].Official Journal of the European Union, 2017, L304: 24-44.