许多生物活性物质如维生素、氨基酸、功能性油脂等有助于人体健康,尤其是一些具有抗氧化、降血脂和增强免疫力等功效的功能因子可以改善人们的健康状态,因此功能食品的发展具有现实意义[1]。但是许多具有重要生理功能的生物活性物质因具有一些缺陷而导致应用受限,如具有不良风味(如苦味和涩味)、具有环境敏感性(环境中的氧气、光线、温度以及pH值变化都会影响其稳定性),此外物质与其他食品成分之间的相互作用也会影响其生物活性。为了突破这些物质的应用限制,人们将目光转向传递体系的开发。在过去的研究中,负载敏感物质载体的研究与开发已取得重要进展。通过传递体系的构建,壁材能够将负载物质与周围环境隔离,在降低苛刻加工条件与不良贮藏环境负面影响的同时还能够有针对性地递送到特定部位,延长生物活性物质的释放时间,最终提高稳定性和生物利用率[2]。在过去几十年的研究中,人们已经设计了诸如脂质体、胶束、水凝胶和纳米颗粒等多种传递体系。其中水凝胶是由水溶性聚合物构成的具有三维网络结构的交联聚合物,水凝胶能够在水中溶胀,并且具有一定的孔隙率,以负载水溶性功能因子,而功能因子的释放特性则可以通过控制凝胶自身结构及其在不同环境作用下的结构变化来调节[3],目前已在食品和医药领域中得到广泛应用。
在众多应用于制备水凝胶的食品级多糖中,海藻酸盐作为一种天然的阴离子聚合物,具有无毒性、生物黏附性、生物降解性以及良好的凝胶特性。海藻酸盐凝胶还具有pH值敏感性,能够在人体胃肠道中进行溶胀从而有效控制功能因子的释放。因此,海藻酸盐水凝胶作为传递体系广泛应用于食品和药品中[4],可以实现风味改良[5-6]、功能因子包埋[7-8]和控制释放[9]等目的。
尽管海藻酸盐水凝胶已经得到较为深入的研究,其作为功能因子递送体系也有诸多报道,但该领域缺少系统而全面的总结。本文综述了近年来基于海藻酸盐凝胶包埋体系的最新研究进展,分类介绍了不同海藻酸盐复配凝胶传递体系,并针对不同传递形式的凝胶进行了说明。
1 海藻酸钠及其凝胶的基本性质
1.1 结构与特征
海藻酸钠又被称为褐藻酸钠或海藻胶,通常来自于马尾藻或褐藻类的海带提取碘和甘露醇后的副产物[10]。海藻酸钠是一种无毒的水溶性膳食纤维素,能够调节人体新陈代谢,并且具有降血脂、降血压、增加饱腹感等多种保健功能[11]。
作为一种天然多糖高分子共聚物,海藻酸钠分子由β-D-甘露糖醛酸(M单元)与其立体异构体α-L-古罗糖醛酸(G单元)依靠β-1,4-糖苷键连接而成[12](图1)。它们排列组成3 种不同形式的聚合物链:GG链段、MM链段和交替的MG链段[4]。海藻酸钠中每种聚合物链段的含量通常与其产地以及季节相关[13]。而M单元与G单元的构象不同导致3 种链段性质不完全相同:MM链段分子呈现伸展的线性结构,因而具有良好的弹性;GG链段呈现螺旋卷曲的刚性形态;MG交替链段则是介于两者之间[14]。因此,MM链段含量较高的海藻酸钠形成的凝胶弹性较好,而高GG链段含量则有利于生成坚硬易碎、具有更高热稳定性和水分保持能力的海藻酸盐凝胶[15],由此可见,海藻酸钠的组成(M/G之比)、序列、GG链段的长度和分子质量是影响海藻酸钠及其所制备水凝胶性质的关键因素[16],而这些性质显著影响凝胶的稳定性、释放速率等应用特性。如已有研究发现,低古罗糖醛酸和低分子质量的海藻酸盐凝胶可以使包埋其中的蛋白质以更快的速度释放[17]。
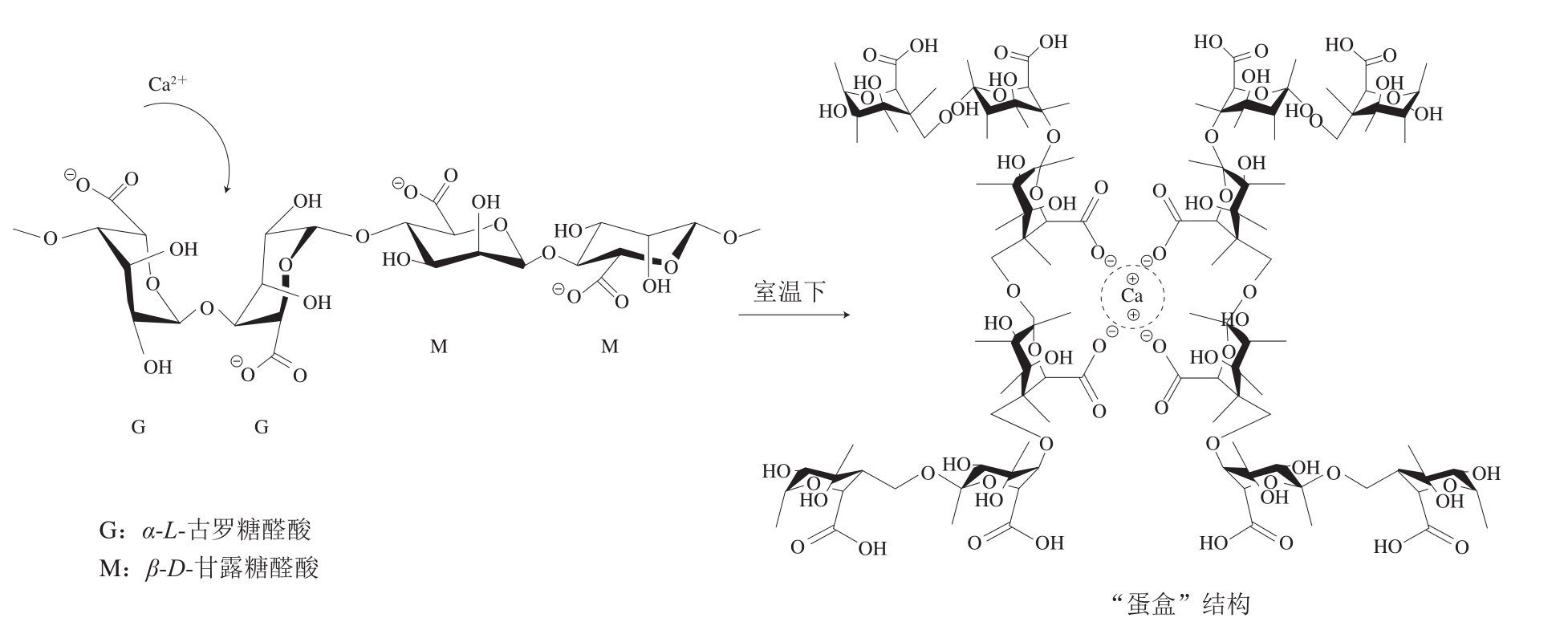
图1 海藻酸钠的结构特征与海藻酸钙凝胶中“蛋盒”结构的示意图[18]
Fig.1 Structural characteristics of alginates and “egg-box” structure of calcium alginate gel[18]
1.2 凝胶性质
海藻酸钠独特的凝胶特性赋予其在传递体系中独特的价值,在多价阳离子存在的情况下,Na+会被阳离子置换并形成具有一定机械强度的海藻酸盐水凝胶。这种离子成胶方式十分温和并适用于热敏感性生物活性物质(如益生菌、微生物和蛋白质等)的负载。海藻酸钠对二价离子的亲和力降序排列:Pb2+>Cu2+>Cd2+>Ba2+>Sr2+>Ca2+>Co2+、Ni2+、Zn2+>Mn2+[19],其中一些阳离子(如Pb2+、Cu2+和Cd2+)因有剧毒而使用受到限制[20]。Ca2+无毒,到目前为止是使用最广泛的交联离子,本文将主要关注通过离子法制备的海藻酸钙凝胶。
当形成海藻酸盐凝胶时,由于G单元和M单元具有异构现象,它们在Ca2+形成水凝胶过程中所起的作用也不同。Ca2+以连续并轴向连接的G单元形成的空腔作为结合位点,形成“蛋盒”(egg-box)结构[15,21](图1)。MM链段因其结构韧性较大难以弯曲而无法与Ca2+形成该结构,GM链段则是主要起连接各嵌段的作用[22]。
对于实际应用而言,钙离子浓度以及引入方式会对凝胶的理化特性和传递效果产生影响。可以用Ca2+与G单元浓度之比(R值)来分析Ca2+浓度对海藻酸盐凝胶的影响,当R值低于0.55(饱和值)时,海藻酸盐凝胶硬度随Ca2+浓度的增加而增加;而当R值超过饱和值时,过量的Ca2+将导致凝胶收缩,凝胶的热力学稳定性也会降低[15,23-24]。
海藻酸钙凝胶的形成可以根据钙离子的引入方式分成外部和内部凝胶两种形式[25]。外部交联法是指Ca2+从外部向海藻酸钠溶液内部扩散从而交联形成凝胶,通常使用水溶性良好的钙盐(如CaCl2)作为钙源,形成的凝胶具有光滑的表面和致密的内部结构。内部交联法一般分为两步,首先将不溶性钙盐(如CaCO3、CaSO4和柠檬酸钙等)分散于海藻酸钠溶液中,随后通过添加有机酸(如冰醋酸)或内酯(如葡萄糖酸-δ-内酯)降低环境pH值使不溶性钙盐解离释放出Ca2+从而引发交联。相较于外部交联法,内部交联法的凝胶行为同时发生在多个部位,因而成胶均匀,适合需要与外部环境进行物质交换的活细胞以及用于催化反应酶的包埋,但也存在凝胶结构疏松、孔径较大、表面较粗糙和制备过程耗时较长的缺点[26-27]。
离子交联法也存在一定的局限性,当凝胶存在于一价离子溶液或是含有钙离子螯合剂(如柠檬酸盐、磷酸盐和乳酸盐)等环境时会不稳定甚至溶解。
1.3 环境响应性
海藻酸盐凝胶的pH值敏感性源于其结构中的羧基。在pH值低于其pKa(pH<3.4)的环境下,凝胶结构中羧酸基团以非离子形式(—COOH)存在,电离度降低,分子链收缩并且孔径减小,包埋物质扩散受限,因而起到一定的保护作用;当pH值升高时,羧基将发生离子化(—COO-)导致负电荷间的静电排斥作用增强,引起溶胀现象[18,28-29](图2)。基于此特性,海藻酸盐凝胶常作为传递载体以增强功能因子在胃环境中的稳定性并实现肠内的控制释放,在口服药物治疗领域具有良好的应用潜力[30]。
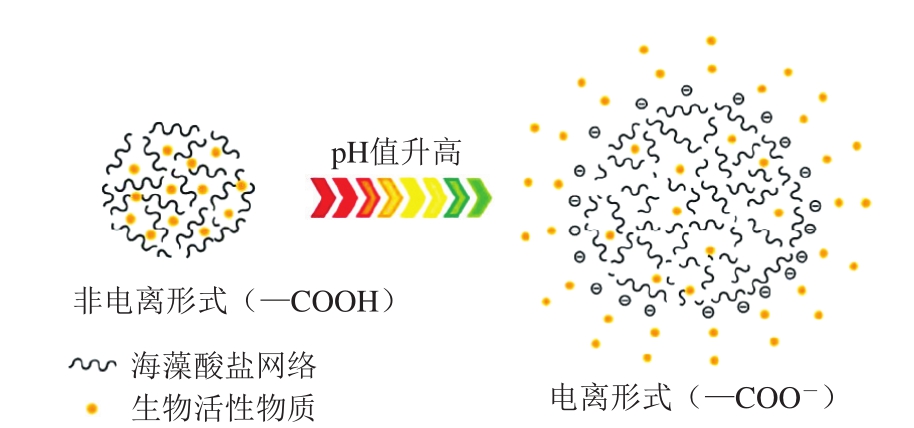
图2 海藻酸盐凝胶的pH值响应示意图[18]
Fig.2 Schematic diagram of the pH response of alginate gel[18]
除了海藻酸钠本身具有的pH值敏感性,它还可以通过与其他环境响应性物质复配形成具有其他敏感性的智能凝胶,这种凝胶能够通过体积的溶胀或收缩从而响应外界环境如温度、pH值、离子强度、电场强度、光强度或特异性化学物质的变化[31]。当引入温度敏感型高分子化合物如聚N-异丙基丙烯酰胺等物质时[32],能够获得具有pH值和温度双重敏感性的复合凝胶,由于病灶部位环境的pH值和温度都有可能发生变化,因此,这类水凝胶在医药领域具有较大的应用潜力[10]。包埋磁性物质如Fe3O4后海藻酸盐水凝胶将具备磁敏感性,这赋予水凝胶更好的靶向性。此外将这种磁性高分子物质作为酶的固定化载体还具有提高稳定性和利于回收的优点[33]。
1.4 生物相容性
生物相容性一般指非活性或活性材料与宿主之间的相容性,包括组织相容性和血液相容性[34]。一般制备药物运输载体的材料需具备良好的生物相容性,即不引起或仅引起很轻的过敏、炎症等生物体异常反应。
目前海藻酸盐在食品领域已被作为增稠剂、稳定剂等广泛使用,美国食品与药品管理局将海藻酸钠归为“通常认为是安全的化合物类”[16]。海藻酸钠的生物相容性受到多种因素的影响,其中G段与M段的含量与海藻酸钠浓度等对其影响较为显著,通常选用M段较少、G段较多的海藻酸钠来制备生物体内物质释放载体[35]。
1.5 生物黏附性
对于药物传递系统而言,良好的生物黏附性有利于延长药物在吸收部位的停留时间[16]。海藻酸钠结构中含有大量的羧基,生物黏附性与亲水官能团(—COOH)和黏液糖蛋白之间的氢键作用有关,因而海藻酸盐作为一类阴离子黏膜黏附物,在传递体系中有着很大的应用潜力[35-36]。海藻酸盐的黏附特性使其可以黏附在黏膜组织表面,借此能够延长药物的停留释放时间,进而达到改善药物生物利用度的目的。
2 基于海藻酸盐复合凝胶的传递体系
海藻酸盐凝胶能够保护活性成分免受环境影响,并能够响应环境变化而多用于传递体系,但是目前研究发现单一海藻酸盐水凝胶依旧存在一些局限性,包括海藻酸盐水凝胶孔径较大、一些负载的小分子表现出与在水中相似的扩散特性以及低保留率与较差的控释能力,这些限制了其作为控释载体的应用[37];海藻酸盐凝胶在较高pH值范围内的溶解可能导致生物活性物质的突然释放,不利于有效运载;海藻酸钠的亲水性较强,对疏水性药物的负载也因此受到限制;单一海藻酸盐凝胶的机械性能和力学性能不理想,在大量一价离子、Ca2+螯合剂的存在下会出现崩解现象从而影响传递效率。
目前已采用多种方法克服这些局限性,如利用化学法对海藻酸钠进行修饰,但利用化学法制备的传递体系中往往存在有毒试剂残留的问题,因而不适合在食品和医药等领域中应用。近年来基于天然物质与海藻酸钠的复配传递体系得到了广泛关注,研究表明通过复配使用能够实现机械强度、凝胶性能、孔隙率和细胞亲和性等结构或性能的改善,同时拓宽其应用范围[4,25]。
2.1 与其他多糖复配
已有研究表明海藻酸盐与其他聚合物如卡拉胶、果胶和壳聚糖等多糖复配使用能够有效解决生物活性物质的浸出问题,降低海藻酸钠凝胶的孔隙率,增强凝胶的机械稳定性[38]。
目前研究较广泛的是壳聚糖与海藻酸盐复配传递体系。壳聚糖是通过甲壳素脱乙酰基化制得的一种具有黏膜黏附性、生物相容性和pH值敏感性等特性的天然高分子直链多糖,常被用于功能因子控制释放体系[16,39]。其分子链上的伯氨基能够通过分子间作用力与海藻酸钠分子链段上的羧基形成聚电解质复合物[40],因而能够降低凝胶网络的孔隙度并且减少负载物质的泄漏[39]。此外,壳聚糖在低pH值(<6)下溶解而在高pH值(≥6)下不溶,通过此特性还可以缓解海藻酸钠在高pH值下的溶解现象[16,25]。可以通过控制壳聚糖分子质量与浓度、制备环境中pH值和离子强度等因素来调整壳聚糖所带电荷、空间构象以及与海藻酸钠负电荷结合位点数,最终制备出具有理想控释效果的微胶囊。
制备海藻酸钠-壳聚糖凝胶的方法有很多。其中较为常见的是将壳聚糖与海藻酸钠以及负载物质混合,随后滴入氯化钙凝固浴中成胶。在制得的凝胶中,壳聚糖往往用于修饰海藻酸盐凝胶结构,同海藻酸盐凝胶形成互穿网络聚合物(interpenetrating polymer networks,IPN)[41](图3)。IPN是两种聚合物以网络的形式互相贯穿但彼此之间不共价结合的聚集态结构[42]。IPN具有相对致密的水凝胶基质,相比于单一的凝胶,它具有更多可控制的物理特性并能更有效地进行药物传递[3]。Lin等[41]研究发现海藻酸钙-N,O-羧甲基壳聚糖凝胶珠具有优良的pH值敏感性并且在不同pH值下的溶胀特性得到了良好的改善,适用于肠道中特定位点生物活性蛋白质的传递。
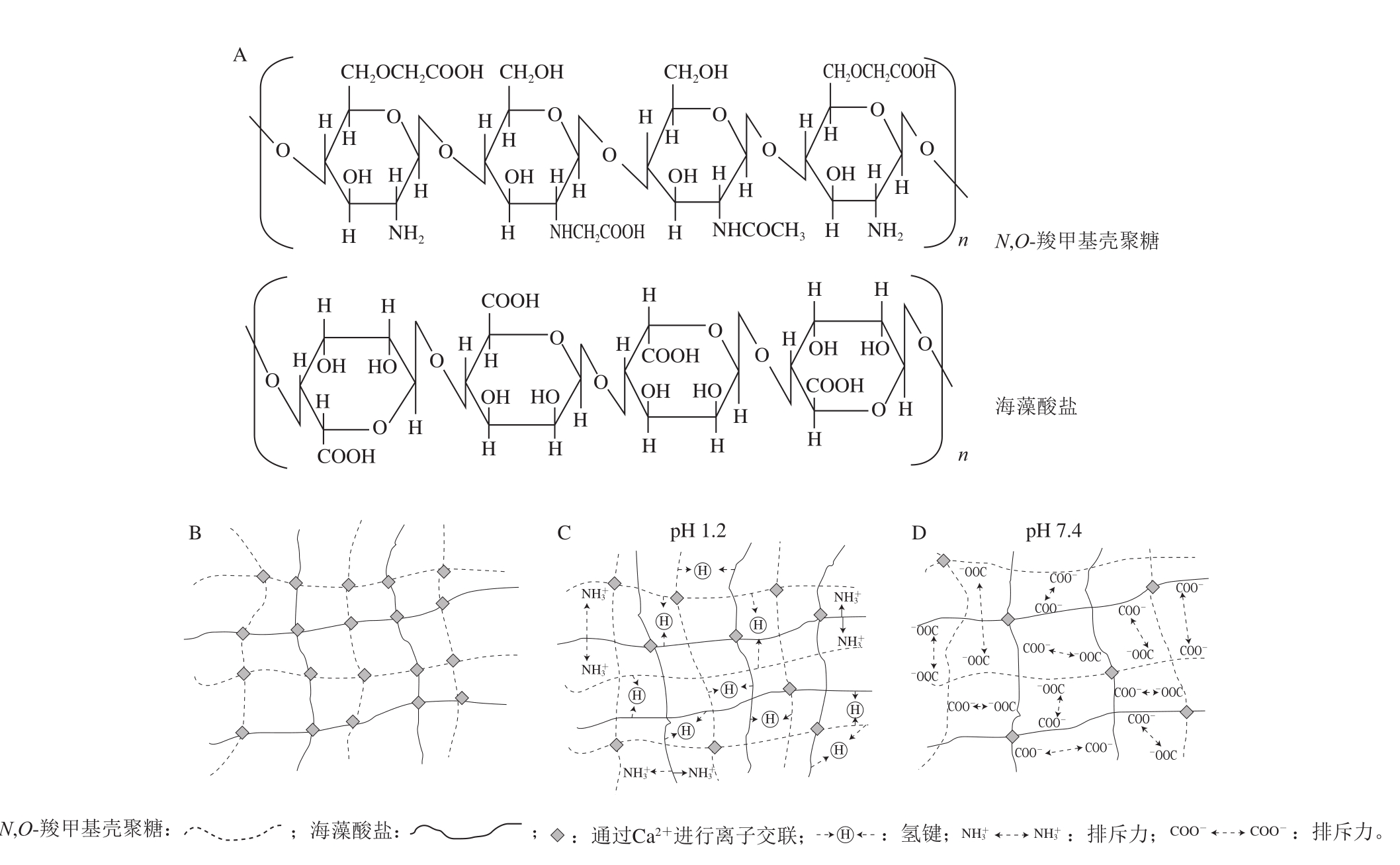
图3 海藻酸钠与N,O-羧甲基壳聚糖的结构式(A)、钙离子交联的海藻酸盐-N,O-羧甲基壳聚糖互穿网络水凝胶(B)以及pH 1.2和pH 7.4下海藻酸钙-N,O-羧甲基壳聚糖水凝胶的结构示意图(C、D)[41]
Fig.3 Structural formulas of sodium alginate and N,O-carboxymethyl chitosan (A), formation of Ca2+ interpenetrating polymer network by alginate and N,O-carboxymethyl chitosan (B) and schematic illustrations of the physical structures of alginate/N,O-carboxymethyl chitosan hydrogels at pH 1.2 and pH 7.4 (C, D)[41]
此外,还可以通过表面修饰形成具有屏障保护作用的壳聚糖涂层,涂层的存在将改善海藻酸盐凝胶的机械特性、溶胀特性、控释特性和表面的细菌黏附性等[37,43]。通过将海藻酸钠与负载物质混合后滴入含有壳聚糖和氯化钙的凝固液中形成微凝胶,或者是先将海藻酸钠溶液滴入凝固液中成胶,再将形成的微凝胶转移至壳聚糖溶液中进一步反应。前者制备过程简易,物质不易在制备过程中损失,适合于传递蛋白质分子,而后者制备出的微凝珠呈球性与光洁度更好,胶囊不易黏聚,但制备过程较为繁琐,并且在第一步中存在损耗问题,更适合运载细胞[39]。与无壳聚糖包衣的微凝胶相比,具有壳聚糖包衣的传递体系能够提高水杨酸甲酯的包埋率,水杨酸甲酯在模拟唾液中的释放速率较缓慢,由此可知,该体系更适合水杨酸甲酯在唾液中的长时间传递,以提供持续的感官体验[37]。此外,壳聚糖涂层还能有效掩盖一些物质的不良风味[6]。
除了壳聚糖外,还有多种多糖类物质可以与海藻酸钠复配使用以改善凝胶特性。已有研究发现不同复配体系的黏度、机械特性和对活性物质的运载效率都不尽相同[6]。Li Qian等[44]研究了与不同多糖复配的海藻酸盐微凝胶对茶多酚传递效率的影响,发现相比纯海藻酸盐微凝胶(茶多酚包埋率38.51%),与不同多糖(菊粉、阿拉伯胶和壳聚糖)复配的海藻酸盐微凝胶对茶多酚的包埋率发生变化(茶多酚包埋率分别为36.48%、48.56%和57.76%),结果表明选择合适的填充材料能有效提高生物活性物质的封装效率。Krasaekoopt等[45]研究发现使用不同的涂层材料类型对微凝胶的尺寸没有影响,但对于益生菌在胆盐中的保护效果不同,相比海藻酸盐和聚氨基酸,壳聚糖涂层提高了嗜酸乳杆菌、两歧双歧杆菌和干酪乳杆菌的D值(每杀死90%原有残存活菌数时所需要的时间),说明壳聚糖的保护效果最好。因此可以根据实际的应用需要选择合适的多糖以及工艺参数,从而得到理想的传递体系。
2.2 与蛋白质复配
蛋白质在食品体系中是一类具有重要营养价值的物质,能够提供人体所需的氨基酸,是生命的物质基础。此外,蛋白质还具有良好的功能特性(如乳化性、凝胶性、起泡性和保水性),是生物活性物质的良好载体[46]。
研究发现蛋白质-海藻酸盐凝胶具有广泛的应用前景与优势,蛋白质和阴离子多糖的复配物能够改变凝胶的质构特性,并且能够实现一些与蛋白质发生相互作用的物质如绿茶多酚的有效传递[47]。Chen Lingyun等[48]在以核黄素作为模型药物的研究中发现,单一使用海藻酸钠或是乳清蛋白微球都不能对胃液中的模型药物起到较好的保护作用,然而二者复配使用却能够大大改善诸多功能特性,如生物化合物的稳定性、分散性和抗氧化能力[49]。天然蛋白质和海藻酸盐的复合物还具有良好的生物相容性,与由多种氨基酸和糖基大分子组成的组织细胞外基质相似,因此它们在生物体系中的应用具有重要意义[50]。
目前研究已发现一些蛋白质如大豆分离蛋白(soy protein isolate,SPI)[51]能够强化海藻酸盐凝胶体系以更好地递送物质,复合物不仅具有海藻酸盐的pH值敏感性,还具有蛋白质的生物活性和乳化性。Volić等[52]将海藻酸钠与SPI共混,经静电挤出和钙离子凝胶化制备出负载百里香挥发油的复配微凝珠。研究发现与SPI复配使用利于凝胶在模拟肠液中溶胀性的提高,使得生物活性物质释放时间得以延长。
蛋白质的性质(如溶解性和两亲性等)、种类和环境(pH值、离子强度和生物聚合物相对浓度等)等因素往往会直接影响海藻酸盐与蛋白质的相互作用,从而影响蛋白质-海藻酸盐复合物的物质传递能力和释放特性[8,53-54]。就环境因素而言,pH值影响较大。由于甘露糖醛酸(M单元)和古罗糖醛酸(G单元)单体的解离常数分别为3.38和3.65,因此在较大范围的pH值下海藻酸盐将带负电荷[55]。在低离子强度或中性pH值条件下,蛋白质和多糖都带负电荷,尽管蛋白质的阳离子基团与海藻酸盐的羧酸阴离子基团可能存在相互作用,但是在低浓度下它们还是共溶状态,不会出现离散型相分离现象;当环境pH值接近蛋白质等电点(pI)时,蛋白质与多糖将通过静电作用力形成可溶性的蛋白质-多糖体系;当pH值进一步降低(小于pI时),两者间的静电相互作用增强,将发生聚集而生成复合凝聚物,体系出现缔合型相分离[16,53,56-57]。
不同种类的蛋白质-海藻酸盐基载体也表现出不同的质地特性和负载潜力。已有研究发现与大豆蛋白或大麻籽蛋白复配制备出的蛋白质-海藻酸盐基载体颗粒粒径大且硬度高,而用乳清蛋白或牛血清白蛋白与海藻酸钠复配则生成球型度较好、质地较软的蛋白质-海藻酸盐基载体颗粒;同时还发现不同海藻酸钠-蛋白质体系对于生物活性物质的保留能力也不同,相比于牛血清白蛋白、大麻籽蛋白和大豆蛋白等,酪蛋白酸钙与海藻酸盐复配体系对黄烷-3-醇的包埋效果更好,包埋率可达77.34%[47]。
2.3 与脂类复配
许多人体无法合成的脂溶性活性分子在营养和健康中发挥着重要作用,但部分物质(如不饱和脂肪酸、精油、油溶性维生素和多酚等)囿于有限的溶解度、理化性质不稳定以及具有不良气味等缺点[58-59],单一海藻酸钠凝胶不适合作为输送疏水化合物的载体,因此需要通过双亲性传递体系中的油相进行传递。双亲性传递体系是一种通过乳化剂稳定的油相和水相共存的体系。
乳液凝胶体系是常见的双亲性传递体系之一,是通过将内部乳化的脂质液滴固定于水凝胶网络中形成的具有凝胶网络结构和类似于固体机械特性的凝胶[60-61]。乳液凝胶体系在应用时具有优于乳液和水凝胶的优势,相比于乳液,乳液凝胶质地得到改善并具有双重控释性以及良好的热力学稳定性[58];相比于纯水凝胶,由于含有脂质,乳液凝胶密度较低,具有良好的浮力,当用于胃靶向药物传递系统时能够降低给药频率并提高活性物质的生物利用度,具有更大的应用潜力[62]。
海藻酸盐基乳液凝胶可以通过两步制备获得。第一步是制备稳定的水包油乳液,通常需要加入合成乳化剂或天然乳化剂来降低界面张力稳定乳状液;第二步是在乳液的基础上再加入交联离子使连续相形成一定的空间网络结构从而形成凝胶。Xu Wei等[63]通过自乳化和离子凝胶化的方法,在海藻酸盐凝胶的基础上制备了负载姜黄素的乳液填充微凝珠,研究发现99.15%的姜黄素被包埋在乳液填充的海藻酸钠凝胶珠中,装载量达到7.25 mg/g,证明乳液填充的凝胶珠对于疏水性功能因子具有良好的封装能力。
凝胶原料比例、乳化剂的种类、液滴之间的相互作用和制备方法等均会对乳液凝胶的机械性能、消化性能和稳定性产生影响[64]。Lin Duanquan等[8]研究了乳清分离蛋白(whey protein isolate,WPI)与SPI对海藻酸盐基乳液凝珠机械性能和体外消化特性的影响,结果发现WPI与SPI均能有效延缓番茄红素从乳液凝胶中的释放,通过流变特性测定结果得知海藻酸盐与WPI之间存在较强的相互作用,而与SPI的相互作用则较弱,因而相较于单一海藻酸盐乳液凝胶,WPI-海藻酸盐乳液凝胶的杨氏模量增加,而SPI-海藻酸盐乳液凝胶则呈现相反的趋势。
乳液凝胶也存在一定的缺陷,如连续相和分散相两相机械性能不匹配造成的稳定性差的问题,Sagiri等[65]研究发现双凝胶相较于乳液凝胶的油浸出量更低,因此可以通过制备双凝胶来解决上述问题。
双凝胶是一种新型的半固体材料,是由水基凝胶和油基凝胶在一定温度下剪切混合而成的双相体系[66](图4)。油凝胶是一种可以作为亲脂性化合物传递载体的软物质[67]。双凝胶含不同极性的两相而兼具传递亲水性和疏水性药物的能力,并有较好的分散性、稳定性、保湿性和可水洗性,能够提高药物的皮肤渗透性,控制负载药物的释放速率[68],多用于药物传递领域、化妆品和食品行业。Rehman等[69]研究发现与纯水凝胶相比,由海藻酸钠和鱼油制备的双凝胶具有更高的药物渗透率,具有成为局部和经皮给药载体的潜力,当油凝胶和水凝胶质量比为1∶9时,双凝胶展现出的药物释放特性和机械性能最好。
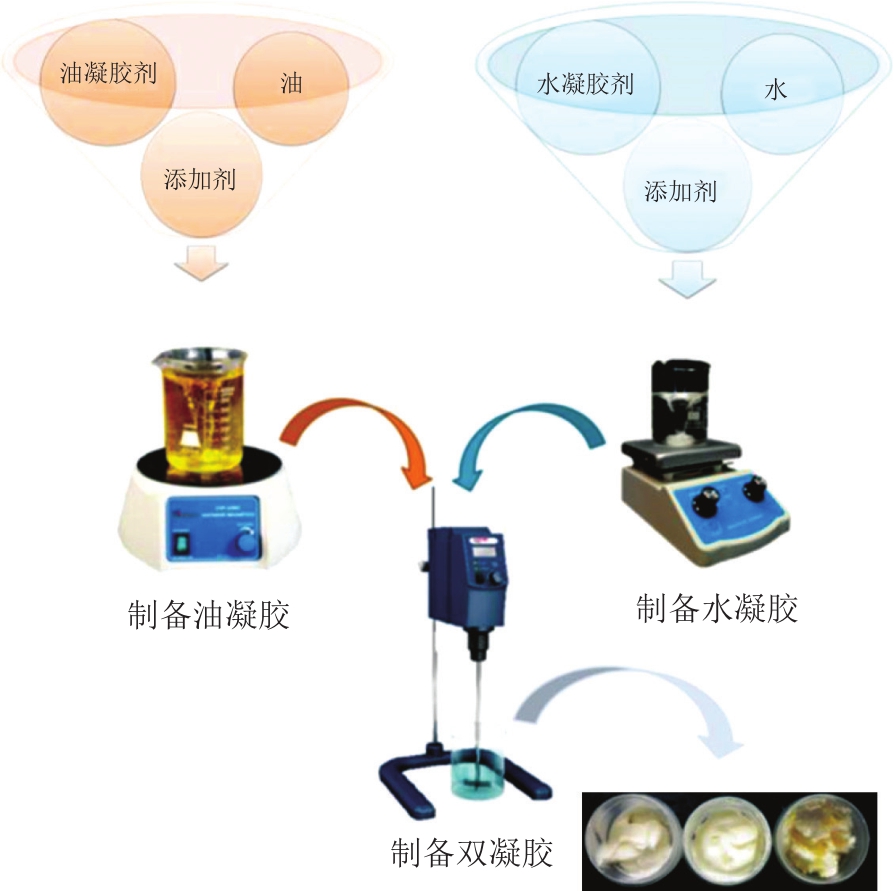
图4 双凝胶制备示意图[68]
Fig.4 Schematic diagram of the preparation of bigel[68]
3 基于海藻酸盐凝胶传递体系的应用
由于制备工艺与应用目的的不同,目前已成功制备出多种形态的海藻酸盐复配凝胶。常见的应用于食品与药品传递体系中的凝胶形态有微凝胶和可食用膜等,它们各自适用于不同的应用领域。
3.1 微凝胶
海藻酸盐微凝胶可以细分为微凝珠、微胶囊、微粒、纳米颗粒和多膜水凝胶等[26]。Ching等[20]总结了目前用于生产藻酸盐微凝胶的主要方法。微凝胶的应用方向与其理化性质紧密相关,在许多应用中需要控制传递体系的粒径、粒径分布和形状,以满足应用需要。如为了减少微凝胶掺入酸奶后带来的负面感官影响,通常选择平均粒径为30 μm的微粒负载益生菌,以达到在保持食品原有风味和口感的同时提高其中生物活性成分的目的,大粒径凝胶则更加适用于一些具有天然粗糙结构的食品[70]。再如当活细胞被固定化作为生物催化剂时,微胶囊结构相较于微凝珠结构更适合作为将细胞与培养基完全隔离的凝胶形式[71]。
微凝珠或微球通常指粒径大于1 000 μm的凝胶颗粒,可以通过简单挤压法制备,将生物聚合物以液滴的形式通过喷嘴或注射器滴入凝固浴液中成胶从而得到产品。其中制备工艺参数与其应用特性密切相关,不同的生产条件将对凝胶的粒径、机械性能、化学稳定性、溶胀特性和包埋特性产生影响。Chan等[72]借助图像分析建立了胶凝前后海藻酸盐液滴形状与大小同工艺变量之间的关系。Hu Liandong等[73]发现高质量分数的海藻酸钠和CaCl2可以提高姜黄素的包埋效率,最优工艺参数为海藻酸钠质量分数2.06%和CaCl2质量分数24.33%。
微粒的粒径没有明确统一定论,其定义从小于1 000 μm到小于100 μm都曾有报道。在本文中将粒径范围为0.2~1 000.0 μm的微凝胶归为微粒。其制备方法较多,包括喷射破碎挤压法、旋转离心造粒法、喷雾法、撞击气溶胶成胶法和乳化法等。对于同一制备方法而言,通过控制生产过程中的参数可以调节形成微粒的大小和形状。以电喷雾技术为例,这是一种通过静电力克服聚合物溶液表面张力和黏度从而制备尺寸可调载体颗粒的方法,其中凝胶尺寸与施加电压、喷嘴孔径、收集距离以及流速有关,生成的微凝胶粒径从微米级别到毫米级别不等[74]。此外采用不同方法生产的凝胶粒径也不同,需要根据实际需要进行选择。Albertini等[75]研究发现,对于负载嗜酸乳杆菌和乳酸双歧杆菌体系而言,通过挤出法制备的凝胶粒径为1~2 mm,而通过气动喷雾法制备的微粒粒径小于100 μm,并且研究表明传递体系粒径的降低和表面积的增加可以增强体系抵抗胃环境的能力。Chandramouli等[76]研究了不同粒径(200、450、1 000 μm)海藻酸盐微凝胶对嗜酸乳杆菌CSCC 2400在模拟胃液中生存能力的影响,结果表明被包埋的乳杆菌生存能力随着海藻酸盐微凝胶粒径的增加而增加。
纳米凝胶通常指直径小于200 nm的凝胶,基于纳米凝胶载体的相关研究是食品和医药行业中的新领域[20,77]。Liu Qingguan等[78]成功制备出了负载姜黄素的玉米蛋白-酪蛋白酸盐-海藻酸钠纳米颗粒,包埋效率高达92.55%,此外研究结果还证明纳米颗粒能够改善功能因子的光化学稳定性和抗氧化活性,并且能够在肠胃液中实现控制释放,具有作为着色剂和功能性添加剂用于食品领域的潜力。此外,Mokhtari等[79]通过乳化与内部凝胶法制备了负载薄荷酚类提取物的海藻酸盐纳米微凝胶,探究了制备因素对于纳米凝胶载体尺寸和包埋效率的影响,研究发现海藻酸钠含量、CaCl2浓度、油与表面活性剂含量均会对纳米颗粒的尺寸和包埋能力产生影响。
常见海藻酸盐微凝胶制备方法、类型与大小以及海藻酸盐微凝胶的部分应用情况分别如表1和表2所示。
表1 常见海藻酸盐微凝胶制备方法、类型与大小
Table 1 Sizes and types of alginate microgels prepared by different techniques
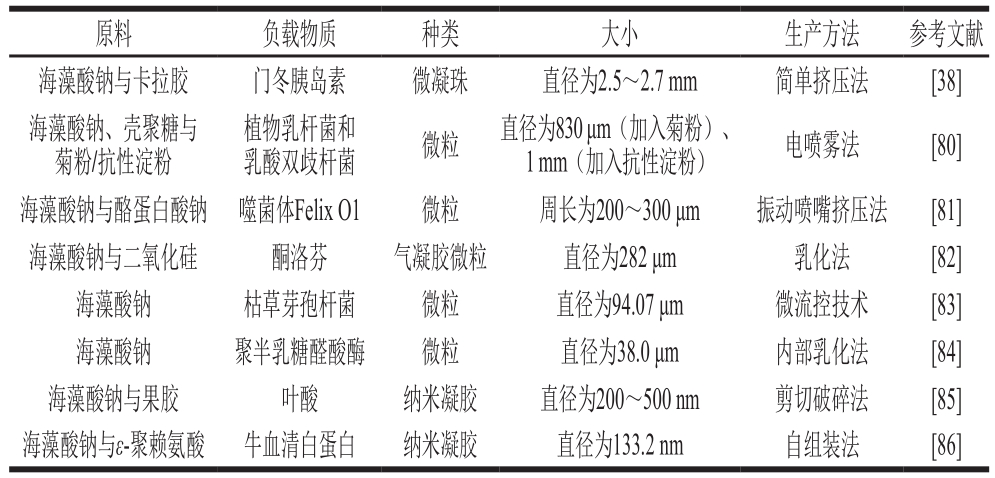
原料 负载物质 种类 大小 生产方法 参考文献海藻酸钠与卡拉胶 门冬胰岛素 微凝珠 直径为2.5~2.7 mm 简单挤压法 [38]海藻酸钠、壳聚糖与菊粉/抗性淀粉植物乳杆菌和乳酸双歧杆菌 微粒 直径为830 μm(加入菊粉)、1 mm(加入抗性淀粉) 电喷雾法 [80]海藻酸钠与酪蛋白酸钠 噬菌体Felix O1 微粒 周长为200~300 μm 振动喷嘴挤压法 [81]海藻酸钠与二氧化硅 酮洛芬 气凝胶微粒 直径为282 μm 乳化法 [82]海藻酸钠 枯草芽孢杆菌 微粒 直径为94.07 μm 微流控技术 [83]海藻酸钠 聚半乳糖醛酸酶 微粒 直径为38.0 μm 内部乳化法 [84]海藻酸钠与果胶 叶酸 纳米凝胶 直径为200~500 nm 剪切破碎法 [85]海藻酸钠与ε-聚赖氨酸 牛血清白蛋白 纳米凝胶 直径为133.2 nm 自组装法 [86]
表2 海藻酸盐微凝胶的部分应用
Table 2 Selected applications of alginate microgels as delivery systems

原料 负载物质 种类 作用主要发现参考文献海藻酸钠巴西葡萄树果皮提取物与蜂胶提取物(花色苷和酚类物质)微凝胶 生物活性物质的负载微凝胶可以有效缓解花色苷的降解从而维持其特有的颜色,能够提高蜂胶提取物中酚类化合物的稳定性。具有成为口服物质传递体系的潜力,并且可以通过这些具有天然抗氧化性的色素来代替人工色素添加剂在食品中的使用[87]海藻酸钠与聚乙烯醇 柠檬苦素降解酶 微凝珠酶的固定化用于酶法脱苦领域。柠檬苦素是柑橘类果汁后期加工产生“后苦味”这种不良风味的原因,将柠檬苦素降解酶固定于微凝珠并优化其在连续化生产上的应用,有效改善了酶稳定性差、易变性失活和与反应物难以分离的问题,在柑橘汁生产中有重要意义[88]海藻酸钠 麦芽糖淀粉酶 微凝珠可以用于物质合成领域。将麦芽糖淀粉酶负载于海藻酸盐凝珠中,产生的传递体系可以提高酶的稳定性、耐受性、负载率和抵抗外界恶劣条件的能力,并能够重复使用,有望作为麦芽低聚糖连续生产的生物催化剂,满足其在食品中作为益生元的市场需求[89]海藻酸钠 果胶酶 微凝珠可以应用于果蔬汁澄清以及葡萄酒生产加工领域。将果胶酶固定在海藻酸盐微凝胶中,相较于游离酶,固定化的果胶酶的热稳定性有所提高,重复利用一定次数后还具有较高的活性,并且在极端pH值下具有比游离酶更高的活性,因此可作为生物反应器[90]海藻酸钠与乳清蛋白植物乳杆菌和干酪乳杆菌 微凝珠微生物的负载可以用于益生菌微胶囊传递领域。微凝胶体系能够保护益生菌免受胃部酸性条件的影响并将其递送至肠道,并且改善了贮藏稳定性,维持益生菌在贮藏期间的活性 [91]海藻酸钠 干酪乳杆菌ATCC 393 微粒用于功能性酸奶的生产。微凝胶能够保护益生菌免受胃肠道不良条件影响,并且在酸奶加工和贮存过程中也表现出较高的存活率,有效地维持了益生菌在冷藏过程中的活性,对产品的感官特性没有显著的影响,未来可以应用于生产新型功能性发酵乳[92]海藻酸钠 肠球菌CECT 410 微凝珠 用于生产益生菌发酵香肠。能够保护在香肠基质中(含有盐、亚硝酸盐和低pH值与水分活度环境)的益生菌在干燥发酵过程的有效活性,为改进肉制品生产加工提供了可能性 [93]海藻酸钠 黑籽油 微粒 精油的负载 提高了黑籽油中活性物质胸腺醌的稳定性,并且能够掩盖黑籽油的苦味和刺激性气味,使不良感官特性得到了很好的改善 [94]
3.2 可食用膜
在食品贮藏过程中,由于与周围介质之间的接触以及复合食品中不同成分之间的迁移,食品品质会有所下降,而食品包装对于维持食品质量至关重要。目前塑料薄膜作为食品包装使用较多,但塑料制品难以降解,已经造成了严重的“白色污染”问题,国际包装工业发展情况统计显示破坏环境的垃圾中塑料占72%,而其中很大一部分来源于食品塑料包装废弃物[95]。随着人们环保意识的增强以及对食品保鲜与食品品质要求的提高,目前利用天然生物材料制备的安全、绿色、可降解的可食用包装膜已经成为了研究热点。
可食用膜是以可食用天然生物聚合物为主要原料,辅以增塑剂,通过一定的处理工序形成的凝胶膜材料。海藻酸钠作为一种天然多糖成膜性能好,与交联剂Ca2+反应形成的可食性膜或涂膜具有保水性和阻隔性能强的优点,加入增塑剂改善其机械特性(如弹性和可加工性能)后常被用作食品包装材料[96]。
海藻酸钠可食用膜具有两大功能:1)将食品与周围环境阻隔,避免食品与外界环境中的水分、氧气和芳香成分等接触而发生变质,避免风味物质的挥发,从而延长食品的货架期[97]。凭此特性,目前海藻酸钠可食用膜已在果蔬、肉品以及海产品中得到了广泛的应用。通过形成保护性的薄膜,防止外界的微生物与食品相接触,改变食品表面的气调环境的同时有效缓解水分流失以及脂肪氧化等问题,从而有效地进行食品保鲜。王琦琦等[98]以海藻酸钠为成膜基质,将其与起协同作用的刺槐豆胶复配,以甘油和乳酸钙为增塑剂和交联剂制备了生物全降解海藻酸钠保鲜膜以用于西瓜的短期贮藏,研究发现在维持可溶性固形物含量、番茄红素含量和控制微生物生长情况方面,海藻酸钠薄膜相较于市售聚乙烯保鲜膜具有更好的保鲜效果。2)多糖可食用膜可以负载一些特殊功能成分(如抗氧化剂、防腐剂、食品风味剂、甜味剂和营养强化剂等食品添加剂),或是作为药物的传递体系,使食用膜在隔绝外界环境的同时具有特定活性和功效,以及提高食品的营养价值[97,99]。此外,还可以通过在海藻酸钠中添加保鲜剂制备功能性膜,在保鲜剂的作用下实现抗菌以及延长货架期的功效。马青青[100]探究了含抗氧化剂茶多酚的海藻酸盐涂膜对冷藏鸡胸肉的保鲜效果,研究发现含有茶多酚的涂膜能够有效抑制脂肪一级氧化、提高鸡胸肉的总抗氧化能力并减少鸡胸肉的干耗从而延长货架期。
目前已有研究发现原料、增塑剂以及添加剂的含量与种类都与可食用薄膜的理化性质与负载特性相关,包括制备条件的改变也会对薄膜的机械性能、不透明度和水分以及气体的渗透性等性质产生影响,为了满足对食品的保护需求、消费者的接受水平以及食品运输中的机械性质的要求[101],目前已有大量探究不同因素对薄膜应用特性影响的研究,并且优化出了最优配方。海藻酸盐的分子质量、结构中的甘露糖醛酸与古罗糖醛酸组成比以及CaCl2添加量会对薄膜厚度、水分含量、透湿性以及机械强度等性能产生影响[102]。此外,不同的复配物质对于薄膜而言也有独特的功能特性,如油的添加对可食用膜的一些特性,特别是透湿性有一定的影响[103]。Shahrampour等[104]研究发现在干燥过程中,相较于甘油,当增塑剂为山梨糖醇时,负载益生菌的海藻酸钠-果胶复配可食用膜表现出更好的益生菌保护特性,而果胶比例的增加能够提高复合膜的厚度、不透明度、透气性和含水率,同时降低益生菌的生存能力。此外,功能因子含量的变化同样影响着可食用膜的应用特性,如随着茶多酚含量在可食用膜中的增加,薄膜的拉伸强度、断裂应变和透湿性都有所增加,但透光率却有所下降[105]。海藻酸盐基可食用膜部分其他应用情况如表3所示。
表3 海藻酸盐基可食用膜的应用
Table 3 Applications of alginate edible films as delivery systems
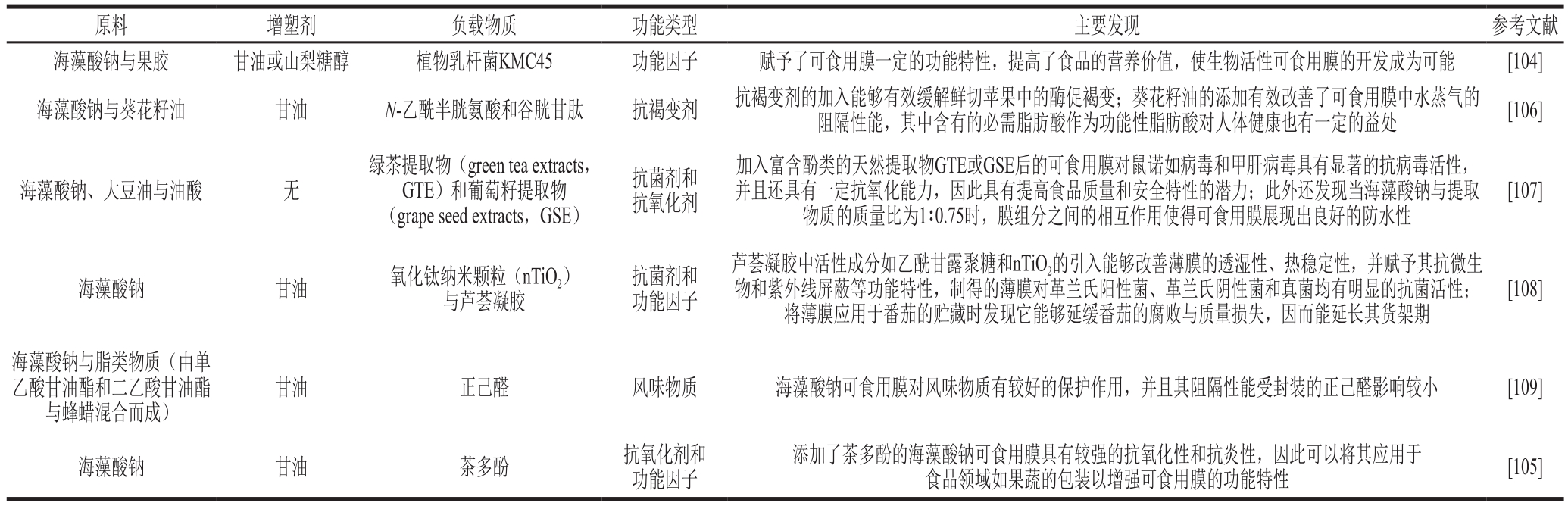
原料 增塑剂 负载物质 功能类型 主要发现 参考文献海藻酸钠与果胶 甘油或山梨糖醇 植物乳杆菌KMC45 功能因子 赋予了可食用膜一定的功能特性,提高了食品的营养价值,使生物活性可食用膜的开发成为可能 [104]海藻酸钠与葵花籽油 甘油 N-乙酰半胱氨酸和谷胱甘肽 抗褐变剂 抗褐变剂的加入能够有效缓解鲜切苹果中的酶促褐变;葵花籽油的添加有效改善了可食用膜中水蒸气的阻隔性能,其中含有的必需脂肪酸作为功能性脂肪酸对人体健康也有一定的益处 [106]海藻酸钠、大豆油与油酸 无绿茶提取物(green tea extracts,GTE)和葡萄籽提取物(grape seed extracts,GSE)抗菌剂和抗氧化剂加入富含酚类的天然提取物GTE或GSE后的可食用膜对鼠诺如病毒和甲肝病毒具有显著的抗病毒活性,并且还具有一定抗氧化能力,因此具有提高食品质量和安全特性的潜力;此外还发现当海藻酸钠与提取物质的质量比为1∶0.75时,膜组分之间的相互作用使得可食用膜展现出良好的防水性[107]海藻酸钠 甘油 氧化钛纳米颗粒(nTiO2)与芦荟凝胶抗菌剂和功能因子芦荟凝胶中活性成分如乙酰甘露聚糖和nTiO2的引入能够改善薄膜的透湿性、热稳定性,并赋予其抗微生物和紫外线屏蔽等功能特性,制得的薄膜对革兰氏阳性菌、革兰氏阴性菌和真菌均有明显的抗菌活性;将薄膜应用于番茄的贮藏时发现它能够延缓番茄的腐败与质量损失,因而能延长其货架期[108]海藻酸钠与脂类物质(由单乙酸甘油酯和二乙酸甘油酯与蜂蜡混合而成)甘油 正己醛 风味物质 海藻酸钠可食用膜对风味物质有较好的保护作用,并且其阻隔性能受封装的正己醛影响较小 [109]海藻酸钠 甘油 茶多酚 抗氧化剂和功能因子添加了茶多酚的海藻酸钠可食用膜具有较强的抗氧化性和抗炎性,因此可以将其应用于食品领域如果蔬的包装以增强可食用膜的功能特性 [105]
3.3 3D打印凝胶
3D打印技术又称为增材制造技术,是运用计算机辅助设计通过数控的逐层堆积技术构造复杂三维实体的过程[110]。目前在食品领域发展迅速,具有生产特殊质地和营养特性定制食品的潜力,能够满足特定消费者(如吞咽困难人群)的需求。因3D打印支架具有机械特性、生物相容性、生物降解性和多孔结构等特点,3D打印技术在组织工程和药物输送领域中也受到了广泛的关注,可以生产具有可调节外观(如面积、厚度和孔径)的伤口敷料或满足患者个性化需求的药物传递体系[111]。
海藻酸钠作为一种天然聚合物具有高生物相容性、优异的生物黏附性和可操作性,经复配后还具备一定的控释能力,常作为3D打印技术的生物墨水。Kuo等[112]以明胶-海藻酸盐混合凝胶作为3D打印的生物墨水制备模拟食品,扫描电子显微镜结果表明样品中有多孔结构,具有传递生物活性化合物如酶、维生素和益生菌的潜力。Ilhan等[113]利用3D打印技术成功制备了负载植物提取物的海藻酸盐-聚乙二醇复合支架,综合样品孔隙率、抗菌实验以及细胞毒性实验等研究结果,发现该复合支架有望应用于组织工程和伤口敷料领域。
4 结 语
近年来我国食品工业发展进入中高速增长阶段,城乡居民在食品上的消费观念已由原来的生存型转向健康型和享受型。消费者对于功能食品的认可使其成为近年来食品领域的研究重点。海藻酸盐凝胶作为一种良好的功能因子传递体系的研究已经取得了一定的进展。本文概述了海藻酸盐凝胶常见的复配方式与应用形式,未来需要进一步寻找潜在的复配原料并深入了解海藻酸钠以及各复配原料相互作用的机理,优化制备参数,得到性能良好的凝胶传递体系,并探索海藻酸盐复配凝胶在具体复杂食品或药品体系中的应用情况。目前单一物质的递送已经无法满足现有行业需求,未来能够实现双载或多载的海藻酸盐基复配体系将具有更广阔的应用前景。
[1] 许朵霞, 曹雁平, 齐雅萌, 等.食品功能因子输送体系的研究进展[J].食品工业科技, 2014, 35(11): 368-371.DOI:10.13386/j.issn1002-0306.2014.11.073.
[2] LUO Y, ZHANG B, WHENT M, et al.Preparation and characterization of zein/chitosan complex for encapsulation of α-tocopherol, and its in vitro controlled release study[J].Colloids and Surfaces B: Biointerfaces, 2011, 85(2): 145-152.DOI:10.1016/j.colsurfb.2011.02.020.
[3] HOARE T R, KOHANE D S.Hydrogels in drug delivery: progress and challenges[J].Polymer, 2008, 49(8): 1993-2007.DOI:10.1016/j.polymer.2008.01.027.
[4] SUN J, TAN H.Alginate-based biomaterials for regenerative medicine applications[J].Materials, 2013, 6(4): 1285-1309.DOI:10.3390/ma6041285.
[5] LI J, KIM S Y, CHEN X, et al.Calcium-alginate beads loaded with gallic acid: preparation and characterization[J].LWT-Food Science and Technology, 2016, 68: 667-673.DOI:10.1016/j.lwt.2016.01.012.
[6] BELŠČAK-CVITANOVIĆ A, KOMES D, KARLOVIĆ S, et al.Improving the controlled delivery formulations of caffeine in alginate hydrogel beads combined with pectin, carrageenan, chitosan and psyllium[J].Food Chemistry, 2015, 167: 378-386.DOI:10.1016/j.foodchem.2014.07.011.
[7] WANG H, GONG X, GUO X, et al.Characterization, release, and antioxidant activity of curcumin-loaded sodium alginate/ZnO hydrogel beads[J].International Journal of Biological Macromolecules, 2019,121: 1118-1125.DOI:10.1016/j.ijbiomac.2018.10.121.
[8] LIN Duanquan, KELLY A L, MAIDANNYK V, et al.Effect of structuring emulsion gels by whey or soy protein isolate on the structure, mechanical properties, and in-vitro digestion of alginatebased emulsion gel beads[J].Food Hydrocolloids, 2021, 110: 106165.DOI:10.1016/j.foodhyd.2020.106165.
[9] RASHIDZADEH B, SHOKRI E, MAHDAVINIA G R, et al.Preparation and characterization of antibacterial magnetic-/pH-sensitive alginate/Ag/Fe3O4 hydrogel beads for controlled drug release[J].International Journal of Biological Macromolecules, 2020,154: 134-141.DOI:10.1016/j.ijbiomac.2020.03.028.
[10] 高春梅.海藻酸钠基pH值和温度敏感性水凝胶的制备及其性能研究[D].兰州: 兰州大学, 2011: 1-2.
[11] 张运铎.海藻酸钠功能特性应用研究进展[J].河南科技, 2011(17):56-57.DOI:10.3969/j.issn.1003-5168.2011.09.042.
[12] 王秀娟, 张坤生, 任云霞, 等.海藻酸钠凝胶特性的研究[J].食品工业科技, 2008(2): 259-262.
[13] 韩庆娇.海藻酸钠及其复合微球的制备、微结构调控及性能研究[D].保定: 河北大学, 2018: 1.
[14] 李红兵.海藻酸钠理化性质研究和特种品种制备[D].天津: 天津大学, 2005: 10.
[15] CAO L, LU W, MATA A, et al.Egg-box model-based gelation of alginate and pectin: a review[J].Carbohydrate Polymers, 2020, 242:116389.DOI:10.1016/j.carbpol.2020.116389.
[16] GEORGE M, ABRAHAM T E.Polyionic hydrocolloids for the intestinal delivery of protein drugs: alginate and chitosan: a review[J].Journal of Controlled Release, 2006, 114(1): 1-14.DOI:10.1016/j.jconrel.2006.04.017.
[17] MURATA Y, NAKADA K, MIYAMOTO E, et al.Influence of erosion of calcium-induced alginate gel matrix on the release of Brilliant Blue[J].Journal of Controlled Release, 1993, 23(1): 21-26.DOI:10.1016/0168-3659(93)90067-F.
[18] AGÜERO L, ZALDIVAR-SILVA D, PEÑA L, et al.Alginate microparticles as oral colon drug delivery device: a review[J].Carbohydrate Polymers, 2017, 168: 32-43.DOI:10.1016/j.carbpol.2017.03.033.
[19] PAWAR S N, EDGAR K J.Alginate derivatization: a review of chemistry, properties and applications[J].Biomaterials, 2012, 33(11):3279-3305.DOI:10.1016/j.biomaterials.2012.01.007.
[20] CHING S H, BANSAL N, BHANDARI B.Alginate gel particles: a review of production techniques and physical properties[J].Critical Reviews in Food Science and Nutrition, 2017, 57(6): 1133-1152.DOI:10.1080/10408398.2014.965773.
[21] CUADROS T R, SKURTYS O, AGUILERA J M.Mechanical properties of calcium alginate fibers produced with a microfluidic device[J].Carbohydrate Polymers, 2012, 89(4): 1198-1206.DOI:10.1016/j.carbpol.2012.03.094.
[22] 姜恒丽, 崔元璐, 齐学洁, 等.海藻酸钠-壳聚糖微胶囊载体在组织工程研究中的应用[J].中国组织工程研究, 2014, 18(3): 412-419.DOI:10.3969/j.issn.2095-4344.2014.03.014.
[23] FARRÉS I F, NORTON I T.Formation kinetics and rheology of alginate fluid gels produced by in-situ calcium release[J].Food Hydrocolloids, 2014, 40: 76-84.DOI:10.1016/j.foodhyd.2014.02.005.
[24] FANG Y P, SAPHWAN A, PHILLIPS G O, et al.Multiple steps and critical behaviors of the binding of calcium to alginate[J].The Journal of Physical Chemistry B, 2007, 111(10): 2456-2462.DOI:10.1021/jp0689870.
[25] RAMDHAN T, CHING S H, PRAKASH S, et al.Physical and mechanical properties of alginate based composite gels[J].Trends in Food Science & Technology, 2020, 106: 150-159.DOI:10.1016/j.tifs.2020.10.002.
[26] LEONG J, LAM W, HO K, et al.Advances in fabricating spherical alginate hydrogels with controlled particle designs by ionotropic gelation as encapsulation systems[J].Particuology, 2016, 24: 44-60.DOI:10.1016/j.partic.2015.09.004.
[27] PUGUAN J M C, YU X, KIM H.Characterization of structure,physico-chemical properties and diffusion behavior of Ca-alginate gel beads prepared by different gelation methods[J].Journal of Colloid and Interface Science, 2014, 432: 109-116.DOI:10.1016/j.jcis.2014.06.048.
[28] KAYGUSUZ H, ERIM F B.Alginate/BSA/montmorillonite composites with enhanced protein entrapment and controlled releaseefficiency[J].Reactive and Functional Polymers, 2013, 73(11): 1420-1425.DOI:10.1016/j.reactfunctpolym.2013.07.014.
[29] 高春梅, 柳明珠, 吕少瑜, 等.海藻酸钠水凝胶的制备及其在药物释放中的应用[J].化学进展, 2013, 25(6): 1012-1022.DOI:10.7536/pc120953.
[30] LIN L, WENDONG Y, YUEFENG R, et al.pH-Responsive carriers for oral drug delivery: challenges and opportunities of current platforms[J].Drug Delivery, 2017, 24(1): 569.DOI:10.1080/10717544.2017.1279238.
[31] 石艳丽.温度及pH敏感天然高分子水凝胶的制备及结构性能表征[D].上海: 东华大学, 2005: 1-5.
[32] 许立新.温度、pH双敏感海藻酸钠/PNIPAAm智能材料的制备、性能及药物控释应用[D].北京: 北京化工大学, 2005: 5-11.
[33] 石凤, 李丕武, 董瑞真.磁性Fe3O4协同海藻酸钠固定化葡萄糖氧化酶[J].食品科技, 2018, 43(1): 262-266.DOI:10.13684/j.cnki.spkj.2018.01.047.
[34] 杨晓芳, 奚廷斐.生物材料生物相容性评价研究进展[J].生物医学工程学杂志, 2001(1): 123-128.DOI:10.3321/j.issn:1001-5515.2001.01.033.
[35] 吴吟秋, 林礼智, 陈达永, 等.基于海藻酸钠的生物医用微球材料研究进展[J].新型工业化, 2018, 8(6): 56-63.DOI:10.19335/j.cnki.2095-6649.2018.6.011.
[36] CHICKERING D E, MATHIOWITZ E.Bioadhesive microspheres: I.A novel electrobalance-based method to study adhesive interactions between individual microspheres and intestinal mucosa[J].Journal of Controlled Release, 1995, 34(3): 251-262.DOI:10.1016/0168-3659(95)00011-V.
[37] TAMILVANAN S, KARMEGAM S.In vitro evaluation of chitosan coated- and uncoated-calcium alginate beads containing methyl salicylate-lactose physical mixture[J].Pharmaceutical Development and Technology, 2012, 17(4): 494-501.DOI:10.3109/10837450.2010.550622.
[38] LIM H, OOI C, TEY B, et al.Controlled delivery of oral insulin aspart using pH-responsive alginate/κ-carrageenan composite hydrogel beads[J].Reactive and Functional Polymers, 2017, 120: 20-29.DOI:10.1016/j.reactfunctpolym.2017.08.015.
[39] 王勇, 解玉冰, 马小军.壳聚糖/海藻酸钠生物微胶囊的研究进展[J].生物工程进展, 1999(2): 3-5.DOI:10.13523/j.cb.19990203.
[40] 何荣军, 杨爽, 孙培龙, 等.海藻酸钠/壳聚糖微胶囊的制备及其应用研究进展[J].食品与机械, 2010, 26(2): 166-169.DOI:10.13652/j.issn.1003-5788.2010.02.046.
[41] LIN Y, LIANG H, CHUNG C, et al.Physically crosslinked alginate/N,O-carboxymethyl chitosan hydrogels with calcium for oral delivery of protein drugs[J].Biomaterials, 2005, 26(14): 2105-2113.DOI:10.1016/j.biomaterials.2004.06.011.
[42] 张敏, 李碧婵, 陈良壁.互穿网络聚合物水凝胶的制备及其吸附研究进展[J].化工进展, 2015, 34(4): 1043-1049.DOI:10.16085/j.issn.1000-6613.2015.04.024.
[43] PARK S, LEE Y, CHO S, et al.Effect of chitosan coating on a bacteria-based alginate microrobot[J].Biotechnology and Bioengineering, 2015, 112(4): 769-776.DOI:10.1002/bit.25476.
[44] LI Qian, DUAN Mengran, HOU Dan, et al.Fabrication and characterization of Ca(II)-alginate-based beads combined with different polysaccharides as vehicles for delivery, release and storage of tea polyphenols[J].Food Hydrocolloids, 2021, 112: 106274.DOI:10.1016/j.foodhyd.2020.106274.
[45] KRASAEKOOPT W, BHANDARI B, DEETH H.The influence of coating materials on some properties of alginate beads and survivability of microencapsulated probiotic bacteria[J].International Dairy Journal,2004, 14(8): 737-743.DOI:10.1016/j.idairyj.2004.01.004.
[46] CHEN L, REMONDETTO G E, SUBIRADE M.Food protein-based materials as nutraceutical delivery systems[J].Trends in Food Science &Technology, 2005, 17(5): 272-283.DOI:10.1016/j.tifs.2005.12.011.
[47] BELŠČAK-CVITANOVIĆ A, ĐORĐEVIĆ V, KARLOVIĆ S, et al.Protein-reinforced and chitosan-pectin coated alginate microparticles for delivery of flavan-3-ol antioxidants and caffeine from green tea extract[J].Food Hydrocolloids, 2015, 51: 361-374.DOI:10.1016/j.foodhyd.2015.05.039.
[48] CHEN Lingyun, SUBIRADE M.Alginate-whey protein granular microspheres as oral delivery vehicles for bioactive compounds[J].Biomaterials, 2006, 27(26): 4646-4654.DOI:10.1016/j.biomaterials.2006.04.037.
[49] FLAMMINII F, DI MATTIA C D, NARDELLA M, et al.Structuring alginate beads with different biopolymers for the development of functional ingredients loaded with olive leaves phenolic extract[J].Food Hydrocolloids, 2020, 108: 105849.DOI:10.1016/j.foodhyd.2020.105849.
[50] BIJI B A J.Self-cross-linking biopolymers as injectable in situ forming biodegradable scaffolds[J].Biomaterials, 2005, 26(18): 3941-3951.DOI:10.1016/j.biomaterials.2004.10.005.
[51] ZHENG H, ZHOU Z, CHEN Y, et al.pH-sensitive alginate/soy protein microspheres as drug transporter[J].Journal of Applied Polymer Science, 2010, 106(2): 1034-1041.DOI:10.1002/app.26725.
[52] VOLIĆ M, PAJIĆ-LIJAKOVIĆ I, DJORDJEVIĆ V, et al.Alginate/soy protein system for essential oil encapsulation with intestinal delivery[J].Carbohydrate Polymers, 2018, 200: 15-24.DOI:10.1016/j.carbpol.2018.07.033.
[53] FIORAMONTI S A, PEREZ A A, ARÍNGOLI E E, et al.Design and characterization of soluble biopolymer complexes produced by electrostatic self-assembly of a whey protein isolate and sodium alginate[J].Food Hydrocolloids, 2014, 35: 129-136.DOI:10.1016/j.foodhyd.2013.05.001.
[54] LIN D, LU W, KELLY A L, et al.Interactions of vegetable proteins with other polymers: structure-function relationships and applications in the food industry[J].Trends in Food Science & Technology, 2017,68: 130-144.DOI:10.1016/j.tifs.2017.08.006.
[55] HARNSILAWAT T, PONGSAWATMANIT R, MCCLEMENTS D J.Characterization of β-lactoglobulin-sodium alginate interactions in aqueous solutions: a calorimetry, light scattering, electrophoretic mobility and solubility study[J].Food Hydrocolloids, 2006, 20(5):577-585.DOI:10.1016/j.foodhyd.2005.05.005.
[56] PEREZ A A, CARRARA C R, SÁNCHEZ C C, et al.Interactions between milk whey protein and polysaccharide in solution[J].Food Chemistry, 2009, 116(1): 104-113.DOI:10.1016/j.foodchem.2009.02.017.
[57] 刘丽娅.酪蛋白酸钠-多糖界面相互作用及其对乳状液稳定性的影响[D].广州: 华南理工大学, 2011: 20-21.
[58] TORRES O, MURRAY B, SARKAR A.Emulsion microgel particles:novel encapsulation strategy for lipophilic molecules[J].Trends in Food Science & Technology, 2016, 55: 98-108.DOI:10.1016/j.tifs.2016.07.006.
[59] 王颖, 赵萌, 黄雪, 等.复合凝聚法包埋功能性食品组分的研究进展[J].食品科学, 2018, 39(9): 265-271.DOI:10.7506/spkx1002-6630-201809040.
[60] DICKINSON E.Stabilising emulsion-based colloidal structures with mixed food ingredients[J].Journal of the Science of Food and Agriculture, 2013, 93(4): 710-721.DOI:10.1002/jsfa.6013.
[61] FARJAMI T, MADADLOU A.An overview on preparation of emulsion-filled gels and emulsion particulate gels[J].Trends inFood Science & Technology, 2019, 86: 85-94.DOI:10.1016/j.tifs.2019.02.043.
[62] DAIHOM B A, BENDAS E R, MOHAMED M I, et al.Development and in vitro evaluation of domperidone/Dowex resinate embedded gastro-floatable emulgel and effervescent alginate beads[J].Journal of Drug Delivery Science and Technology, 2020, 59: 101941.DOI:10.1016/j.jddst.2020.101941.
[63] XU Wei, HUANG Lu, JIN Weiping, et al.Encapsulation and release behavior of curcumin based on nanoemulsions-filled alginate hydrogel beads[J].International Journal of Biological Macromolecules, 2019,134: 210-215.DOI:10.1016/j.ijbiomac.2019.04.200.
[64] LIN D, KELLY A L, MAIDANNYK V, et al.Effect of concentrations of alginate, soy protein isolate and sunflower oil on water loss,shrinkage, elastic and structural properties of alginate-based emulsion gel beads during gelation[J].Food Hydrocolloids, 2020, 108: 105998.DOI:10.1016/j.foodhyd.2020.105998.
[65] SAGIRI S S, SINGH V K, KULANTHAIVEL S, et al.Stearate organogel-gelatin hydrogel based bigels: physicochemical, thermal,mechanical characterizations and in vitro drug delivery applications[J].Journal of the Mechanical Behavior of Biomedical Materials, 2015,43: 1-17.DOI:10.1016/j.jmbbm.2014.11.026.
[66] REHMAN K, ZULFAKAR M H.Recent advances in gel technologies for topical and transdermal drug delivery[J].Drug Development and Industrial Pharmacy, 2014, 40(4): 433-440.DOI:10.3109/03639045.2013.828219.
[67] MARTINS A J, SILVA P, MACIEL F, et al.Hybrid gels: Influence of oleogel/hydrogel ratio on rheological and textural properties[J].Food Research International, 2019, 116: 1298-1305.DOI:10.1016/j.foodres.2018.10.019.
[68] SHAKEEL A, FAROOQ U, IQBA T, et al.Key characteristics and modelling of bigels systems: a review[J].Materials Science &Engineering C, 2019, 97: 932-953.DOI:10.1016/j.msec.2018.12.075.
[69] REHMAN K, AMIN M C I M, ZULFAKAR M H.Development and physical characterization of polymer-fish oil bigel (hydrogel/oleogel)system as a transdermal drug delivery vehicle[J].Journal of Oleo Science, 2014, 63(10): 961-970.DOI:10.5650/jos.ess14101.
[70] HEIDEBACH T, FÖRST P, KULOZIK U.Microencapsulation of probiotic cells for food applications[J].Critical Reviews in Food Science and Nutrition, 2012, 52(4): 291-311.DOI:10.1080/10408398.2010.499801.
[71] YOO I, SEONG G H, CHANG H N, et al.Encapsulation of Lactobacillus casei cells in liquid-core alginate capsules for lactic acid production[J].Enzyme and Microbial Technology, 1996, 19(6): 428-433.DOI:10.1016/S0141-0229(96)00016-6.
[72] CHAN E, LEE B, RAVINDRA P, et al.Prediction models for shape and size of Ca-alginate macrobeads produced through extrusiondripping method[J].Journal of Colloid and Interface Science, 2009,338(1): 63-72.DOI:10.1016/j.jcis.2009.05.027.
[73] HU Liandong, KONG Ddongqian, HU Qiaofeng, et al.Preparation and optimization of a novel microbead formulation to improve solubility and stability of curcumin[J].Particulate Science and Technology,2017, 35(4): 448-454.DOI:10.1080/02726351.2016.1165322.
[74] TAPIA-HERNÁNDEZ J A, TORRES-CHÁVEZ P I, RAMÍREZWONG B, et al.Micro- and nanoparticles by electrospray: advances and applications in foods[J].Journal of Agricultural and Food Chemistry, 2015, 63(19): 4699-4707.DOI:10.1021/acs.jafc.5b01403.
[75] ALBERTINI B, VITALI B, PASSERINI N, et al.Development of microparticulate systems for intestinal delivery of Lactobacillus acidophilus and Bifidobacterium lactis[J].European Journal of Pharmaceutical Sciences, 2010, 40(4): 359-366.DOI:10.1016/j.ejps.2010.04.011.
[76] CHANDRAMOULI V, KAILASAPATHY K, PEIRIS P, et al.An improved method of microencapsulation and its evaluation to protect Lactobacillus spp.in simulated gastric conditions[J].Journal of Microbiological Methods, 2004, 56(1): 27-35.DOI:10.1016/j.mimet.2003.09.002.
[77] KATOUZIAN I, JAFARI S M.Nano-encapsulation as a promising approach for targeted delivery and controlled release of vitamins[J].Trends in Food Science & Technology, 2016, 53: 34-48.DOI:10.1016/j.tifs.2016.05.002.
[78] LIU Qingguan, JING Yuequn, HAN Cuiping, et al.Encapsulation of curcumin in zein/caseinate/sodium alginate nanoparticles with improved physicochemical and controlled release properties[J].Food Hydrocolloids,2019, 93: 432-442.DOI:10.1016/j.foodhyd.2019.02.003.
[79] MOKHTARI S, JAFARI S M, ASSADPOUR E.Development of a nutraceutical nano-delivery system through emulsification/internal gelation of alginate[J].Food Chemistry, 2017, 229: 286-295.DOI:10.1016/j.foodchem.2017.02.071.
[80] ZAEIM D, SARABI-JAMAB M, GHORANI B, et al.Double layer co-encapsulation of probiotics and prebiotics by electro-hydrodynamic atomization[J].LWT-Food Science and Technology, 2019, 110: 102-109.DOI:10.1016/j.lwt.2019.04.040.
[81] ERGIN F, ATAMER Z, GÖCER E M C, et al.Optimization of Salmonella bacteriophage microencapsulation in alginate-caseinate formulation using vibrational nozzle technique[J].Food Hydrocolloids,2020, 113: 106456.DOI:10.1016/j.foodhyd.2020.106456.
[82] BUGNONE C A, RONCHETTI S, MANNA L, et al.An emulsification/internal setting technique for the preparation of coated and uncoated hybrid silica/alginate aerogel beads for controlled drug delivery[J].The Journal of Supercritical Fluids, 2018, 142: 1-9.DOI:10.1016/j.supflu.2018.07.007.
[83] OLIVEIRA A F, BASTOS R G, TORRE L G D L.Bacillus subtilis immobilization in alginate microfluidic-based microparticles aiming to improve lipase productivity[J].Biochemical Engineering Journal,2019, 143: 110-120.DOI:10.1016/j.bej.2018.12.014.
[84] DENG Z, WANG F, ZHOU B, et al.Immobilization of pectinases into calcium alginate microspheres for fruit juice application[J].Food Hydrocolloids, 2018, 89: 691-699.DOI:10.1016/j.foodhyd.2018.11.031.
[85] PAMUNUWA G, ANJALEE N, KUKULEWA D, et al.Tailoring of release properties of folic acid encapsulated nanoparticles via changing alginate and pectin composition in the matrix[J].Carbohydrate Polymer Technologies and Applications, 2020, 1: 100008.DOI:10.1016/j.carpta.2020.100008.
[86] YUAN J, GUO L, WANG S, et al.Preparation of self-assembled nanoparticles of ε-polylysine-sodium alginate: a sustained-release carrier for antigen delivery[J].Colloids and surfaces B: Biointerfaces,2018, 171: 406-412.DOI:10.1016/j.colsurfb.2018.07.058.
[87] DALLABONA I D, DE LIMA G G, CESTARO B I, et al.Development of alginate beads with encapsulated jabuticaba peel and propolis extracts to achieve a new natural colorant antioxidant additive[J].International Journal of Biological Macromolecules, 2020,163: 1421-1432.DOI:10.1016/j.ijbiomac.2020.07.256.
[88] 詹晨, 贺霞霞, 郑亚煜, 等.响应面法优化柠檬苦素降解酶的固定工艺[J].食品安全质量检测学报, 2020, 11(19): 7074-7080.DOI:10.19812/j.cnki.jfsq11-5956/ts.2020.19.061.
[89] NAWAWI N N, HASHIM Z, RAHMAN R A, et al.Entrapment of porous cross-linked enzyme aggregates of maltogenic amylase fromBacillus lehensis G1 into calcium alginate for maltooligosaccharides synthesis[J].International Journal of Biological Macromolecules,2020, 150: 80-89.DOI:10.1016/j.ijbiomac.2020.02.032.
[90] REHMAN H U, AMAN A, SILIPO A, et al.Degradation of complex carbohydrate: Immobilization of pectinase from Bacillus licheniformis KIBGE-IB21 using calcium alginate as a support[J].Food Chemistry,2013, 139(1): 1081-1086.DOI:10.1016/j.foodchem.2013.01.069.
[91] 周莉, 王晓瑞, 谭静, 等.海藻酸钠-乳清蛋白复合益生菌微胶囊的构建及性能评价[J].中国食品添加剂, 2020 31(4): 108-113.DOI:10.19804/j.issn1006-2513.2020.04.012.
[92] DIMITRELLOU D, KANDYLIS P, LEVIĆ S, et al.Encapsulation of Lactobacillus casei ATCC 393 in alginate capsules for probiotic fermented milk production[J].LWT-Food Science and Technology,2019, 116: 108501.DOI:10.1016/j.lwt.2019.108501.
[93] CAVALHEIRO C P, RUIZ-CAPILLAS C, HERRERO A M, et al.Dry-fermented sausages inoculated with Enterococcus faecium CECT 410 as free cells or in alginate beads[J].LWT-Food Science and Technology, 2020, 139: 110561.DOI:10.1016/j.lwt.2020.110561.
[94] ALKHATIB H, MOHAMED F, AKKAWI M E, et al.Microencapsulation of black seed oil in alginate beads for stability and taste masking[J].Journal of Drug Delivery Science and Technology,2020, 60: 102030.DOI:10.1016/j.jddst.2020.102030.
[95] 阚建全, 陈永红, 陈宗道, 等.提高明胶可食膜机械强度和热封强度的研究[J].食品与发酵工业, 1999(2): 3-5.DOI:10.3321/j.issn:0253-990X.1999.02.007.
[96] 牟春娅, 朱伟, 汪学荣.可食性海藻酸钠膜的制备工艺条件[J].食品与发酵工业, 2009, 35(1): 106-110.DOI:10.13995/j.cnki.11-1802/ts.2009.01.033.
[97] 张华丹, 梁鹏.多糖类可食用膜材料的研究进展[J].食品安全导刊,2018(18): 131.DOI:10.16043/j.cnki.cfs.2018.18.104.
[98] 王琦琦, 许加超, 高昕, 等.生物全降解海藻酸钠保鲜膜制备及应用研究[J].食品工业, 2017, 38(7): 88-92.
[99] 卢星池, 肖茜, 邓放明.多糖类可食用膜研究进展[J].食品与机械,2014, 30(4): 261-265.DOI:10.13652/j.issn.1003-5788.2014.04.065.
[100] 马青青.海藻酸钠涂膜对冷却鸡胸肉保鲜效果的影响[D].南京:南京农业大学, 2011: 33-52.
[101] FALGUERA V, QUINTERO J P, JIMÉNEZ A, et al.Edible films and coatings: Structures, active functions and trends in their use[J].Trends in Food Science & Technology, 2011, 22(6): 292-303.DOI:10.1016/j.tifs.2011.02.004.
[102] COSTA M J, MARQUES A M, PASTRANA L M, et al.Physicochemical properties of alginate-based films: Effect of ionic crosslinking and mannuronic and guluronic acid ratio[J].Food Hydrocolloids, 2018, 81: 442-448.DOI:10.1016/j.foodhyd.2018.03.014.
[103] GUTIÉRREZ-JARA C, BILBAO-SAINZ C, MCHUGH T, et al.Physical, mechanical and transport properties of emulsified films based on alginate with soybean oil: Effects of soybean oil concentration, number of passes and degree of surface crosslinking[J].Food Hydrocolloids, 2020, 109: 106133.DOI:10.1016/j.foodhyd.2020.106133.
[104] SHAHRAMPOUR D, KHOMEIRI M, RAZAVI S M A, et al.Development and characterization of alginate/pectin edible films containing Lactobacillus plantarum KMC 45[J].LWT-Food Science and Technology, 2020, 118: 108758.DOI:10.1016/j.lwt.2019.108758.
[105] YUAN B, CAO Y, TANG Q, et al.Enhanced performance and functionality of active edible films by incorporating tea polyphenols into thin calcium alginate hydrogels[J].Food Hydrocolloids, 2019, 97:105197.DOI:10.1016/j.foodhyd.2019.105197.
[106] ROJAS-GRAUE M A, TAPIA M S, RODRIGUEZ F J, et al.Alginate and gellan-based edible coatings as carriers of antibrowning agents applied on fresh-cut Fuji apples[J].Food Hydrocolloids, 2007, 21(1):118-127.DOI:10.1016/j.foodhyd.2006.03.001.
[107] FABRA M J, FALCO I, RANDAZZO W, et al.Antiviral and antioxidant properties of active alginate edible films containing phenolic extracts[J].Food Hydrocolloids, 2018, 81: 96-103.DOI:10.1016/j.foodhyd.2018.02.026.
[108] SALAMA H E, AZIZ M S A.Optimized alginate and Aloe vera gel edible coating reinforced with nTiO2 for the shelf-life extension of tomatoes[J].International Journal of Biological Macromolecules,2020, 165: 2693-2701.DOI:10.1016/j.ijbiomac.2020.10.108.
[109] HAMBLETON A, DEBEAUFORT F, BONNOTTE A, et al.Influence of alginate emulsion-based films structure on its barrier properties and on the protection of microencapsulated aroma compound[J].Food Hydrocolloids, 2009, 23(8): 2116-2124.DOI:10.1016/j.foodhyd.2009.04.001.
[110] 刘俊, 孙璐姗, 王钱钱, 等.3D打印生物质基复合材料研究进展及应用前景[J].生物产业技术, 2017(3): 68-81.DOI:10.3969/j.issn.1674-0319.2017.03.010.
[111] LONG J, ETXEBERRIA A E, NAND A V, et al.A 3D printed chitosan-pectin hydrogel wound dressing for lidocaine hydrochloride delivery[J].Materials Science & Engineering C, 2019, 104: 109873.DOI:10.1016/j.msec.2019.109873.
[112] KUO C C, QIN H, CHENG Y, et al.An integrated manufacturing strategy to fabricate delivery system using gelatin/alginate hybrid hydrogels: 3D printing and freeze-drying[J].Food Hydrocolloids,2020, 111: 106262.DOI:10.1016/j.foodhyd.2020.106262.
[113] ILHAN E, CESUR S, GULER E, et al.Development of Satureja cuneifolia-loaded sodium alginate/polyethylene glycol scaffolds produced by 3D-printing technology as a diabetic wound dressing material[J].International Journal of Biological Macromolecules, 2020,161: 1040-1054.DOI:10.1016/j.ijbiomac.2020.06.086.