茯苓是多孔菌科茯苓属真菌茯苓(Poria cocos(Schw.)Wolf)的干燥菌核,常寄生在马尾松或赤松的根上。茯苓性平,味甘、淡,归入心、肺、脾、肾经,入药具有渗湿利水,益脾和胃、安魂养神的功效[1],是重要的药食同源原料。茯苓主要活性成分有茯苓多糖、三萜类化合物,还含蛋白质、氨基酸、脂肪酸、茯苓酸、胆碱等其他成分[2]。大部分茯苓多糖是水溶性较差的碱溶性多糖,活性低且几乎无抗肿瘤活性[3],而改性后的茯苓多糖水溶性和生物活性提高,具有调节免疫、抗氧化、抗炎抑菌、祛湿消肿、保肝健脾、抗抑郁等多方面的生物活性[4],是保健品和药品开发的重要原料。因此,茯苓多糖的构效关系以及如何提高茯苓多糖生物活性等成为研究热点。本文总结茯苓多糖的活性机制,探讨茯苓多糖结构和活性的关系,以期为茯苓多糖的进一步研究、开发和应用提供思路。
1 茯苓多糖的结构研究
1.1 茯苓多糖的化学结构
茯苓多糖初级结构研究已比较成熟,许多结构研究揭示了茯苓多糖的分子质量、单糖组成、糖环类型、糖苷键类型、糖链末端及分支组成等特征。但多糖复杂的空间结构还难以揭示,大多数表征方法(如原子力显微镜、电子显微镜、X射线衍射法(X-ray diffraction,XRD)、圆二色光谱法和刚果红法[5])只能确定其基本特征。测定多糖的特性黏度、旋光度、重均分子质量等参数,通过理论算法可以分析多糖链刚性及在溶液中的构象[6]。
茯苓多糖来源于茯苓的子实体、菌丝和发酵液,液体发酵分泌到培养基中的多糖称为胞外多糖,从子实体和菌丝提取的多糖称为胞内多糖[7]。这些多糖根据单糖组成不同可分为两类,一类为含有少量或不含1→6和1→2支链的β-(1→3)-D-葡聚糖,水溶性较差,占茯苓菌核的93%[8],分子质量在2.33~4486.00 kDa。另一类是以葡萄糖(glucose,Glu)为主,兼有果糖(fructose,Fru)、阿拉伯糖(arabinose,Ara)、木糖(xylose,Xyl)、半乳糖(galactose,Gal)、甘露糖(mannose,Man)的杂多糖,其水溶性良好[9],分子质量在10.6~208.0 kDa。此外,茯苓多糖含量是茯苓品质评价的主要依据,与茯苓的部位、产地、炮制和干燥方式密切相关,但在这些影响因素下茯苓多糖的化学结构和活性差异并没有得到深入研究。因此,完善茯苓评价标准,加强对不同产地、来源和加工方式茯苓多糖的结构研究意义重大。
茯苓多糖在不同溶剂和条件下溶解性和聚集情况不同,高级结构会存在差异。茯苓葡聚糖能溶于碱液和二甲基亚砜(dimethyl sulfoxide,DMSO),在0.5 mol/L NaOH溶液和0.2 mol/L尿素溶液中呈柔性线型链[10]。茯苓多糖经过改性后在水溶液中可形成三螺旋、球状和类球状等高级结构。Liu Feng等[11]利用刚果红法进行研究,发现两种羧甲基茯苓多糖(carboxymethyl pachymaran,CMP)均为三螺旋结构,通过高分辨率的透射电子显微镜(transmission electron microscope,TEM)观察,在超纯水中CMP-1呈尺寸不一的不规则球形,CMP-2呈规则的球形构象。茯苓多糖在0.25 mol/L的LiCl/DMSO中,40 ℃时呈现部分聚集形态,80 ℃时以单链形式存在,而根据Mark-Houwink方程可知,在DMSO中茯苓多糖可能呈随机线圈状[12]。多糖构象如三螺旋结构在不同极性溶剂、温度和递送体系等因素下的组装聚集或变性解旋会导致其生物活性改变,明确这些因素如何导致多糖生物活性产生差异是未来活性多糖研究的趋势之一,而茯苓多糖相关方面的研究仍处于起步阶段。因此,明晰不同介质中茯苓多糖的结构变化和活性变化是其成功应用于食品、保健品和药品的关键。
1.2 茯苓多糖的结构改性
水溶性茯苓多糖具有抗肿瘤、抗炎等活性,但含量极低且提取困难,而茯苓中碱溶性多糖β-(1→3)-D-葡聚糖含量最高,可水溶性差、生物活性低,几乎无抗肿瘤活性[8],这使得茯苓碱性多糖结构改性成为研究热点。
茯苓多糖化学改性常见的是羧甲基化、硫酸酯化,还包括磷酸化、阿魏酸化[8]和2,2,6,6-四甲基哌啶-氮-氧化物(2,2,6,6-tetramethyl-1-1piperidinyloxy,TEMPO)/NaBr/NaClO体系对茯苓多糖进行氧化降解[13]。Wang Yifeng等[14]对茯苓碱性多糖(分子质量123 kDa)C2、C4、C6位羟基进行5 种化学修饰,其中硫酸化茯苓多糖分子质量降低至38 kDa,羧甲基化茯苓多糖分子质量升高至189 kDa,这两种多糖不同位号碳原子的取代度(degree of substitution,DS)依次为C6>C4>C2,二者在水溶液中溶解性良好,以相对膨胀链形式存在,链刚度有所提高。但化学改性会产生污染环境的废料废液,且化学残留难以去除,存在极大的安全隐患。因此,生物修饰和物理改性逐渐成为研究热点。
生物修饰包括发酵法和酶解法。茯苓液态发酵可解决传统培植时间长、松材消耗大的问题,更适合工业化生产[15]。廖彦[16]通过单因素试验优化茯苓液态发酵条件,确定了合成茯苓多糖的培养基,如碳源、氮源、金属离子、辅助因子组成及配比。此外,培养基组成不同可影响茯苓多糖的结构特性,Jin Yong等[17]通过发酵获得了10 种水溶性多糖,发现玉米浆培养基发酵的茯苓多糖能够比麸皮发酵茯苓多糖结合更多的蛋白质,Man和Gal含量更高。茯苓多糖的酶法修饰主要采用β-葡聚糖酶,Wu Peng等[18]用黑曲霉中的β-葡聚糖酶降解特定糖苷键,获得较低分子质量的多糖或寡糖,显著提高了多糖的产率。
茯苓多糖物理改性方法主要有超微粉碎、辐照、超声波、蒸汽爆破等方法。梅光明等[19]对茯苓粉和茯苓多糖进行超微粉碎,发现机械剪切力使碱溶性茯苓多糖主链或侧链部分被打断,导致分子质量降低,产生可溶性多糖,提高多糖溶出率。龚志华[20]采用60Co辐照茯苓,降解产生的水溶性多糖的随辐照剂量增加而显著增加,其中1000 kGy处理后水溶性多糖得率最高。近年来,鲜见新的和具有突破性的新技术应用到茯苓多糖的提取和改性中。
现有文献中茯苓多糖的结构特征及生物活性如表1所示。
表1 茯苓多糖的结构特征
Table 1 Structural information of P.cocos polysaccharides
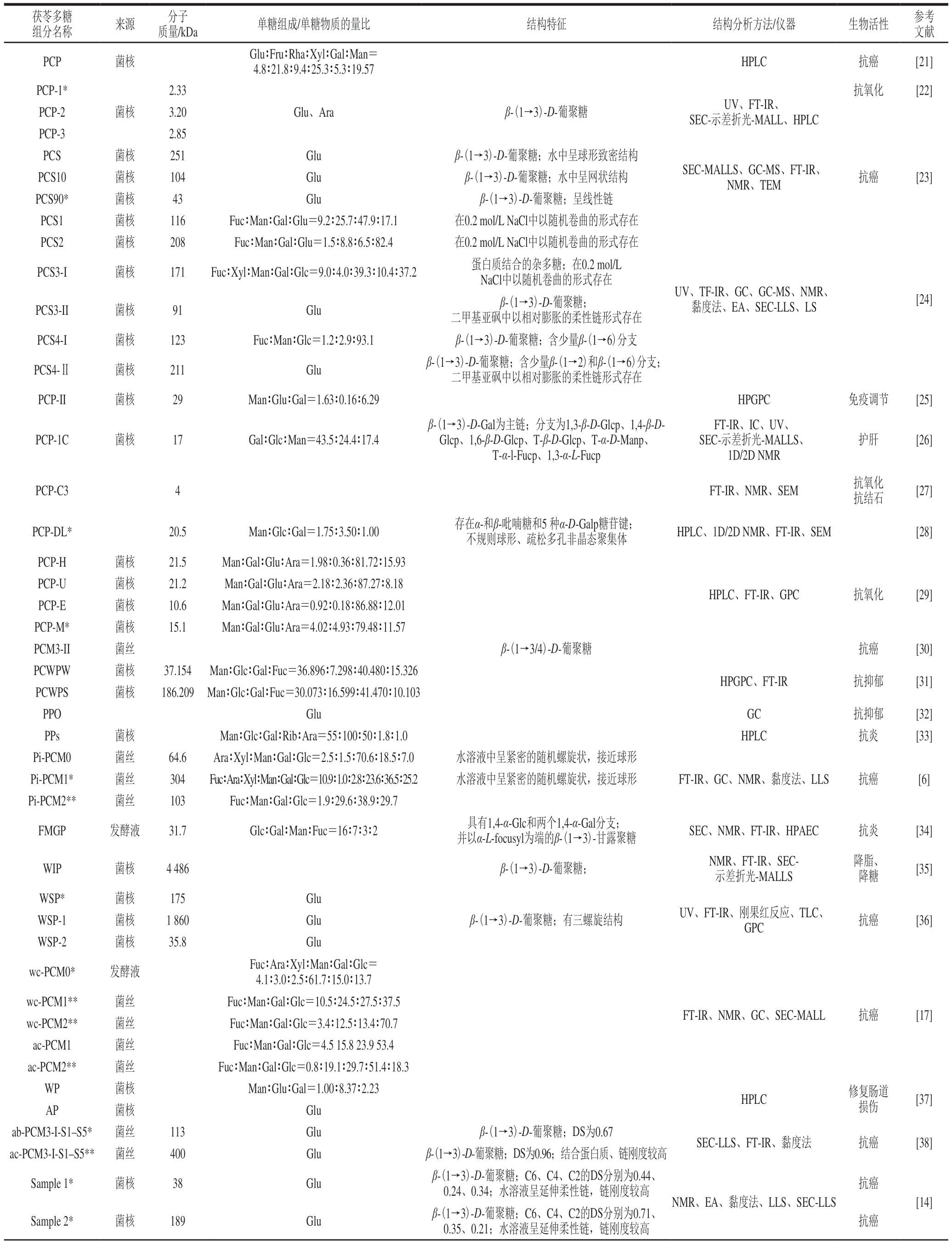
续表1
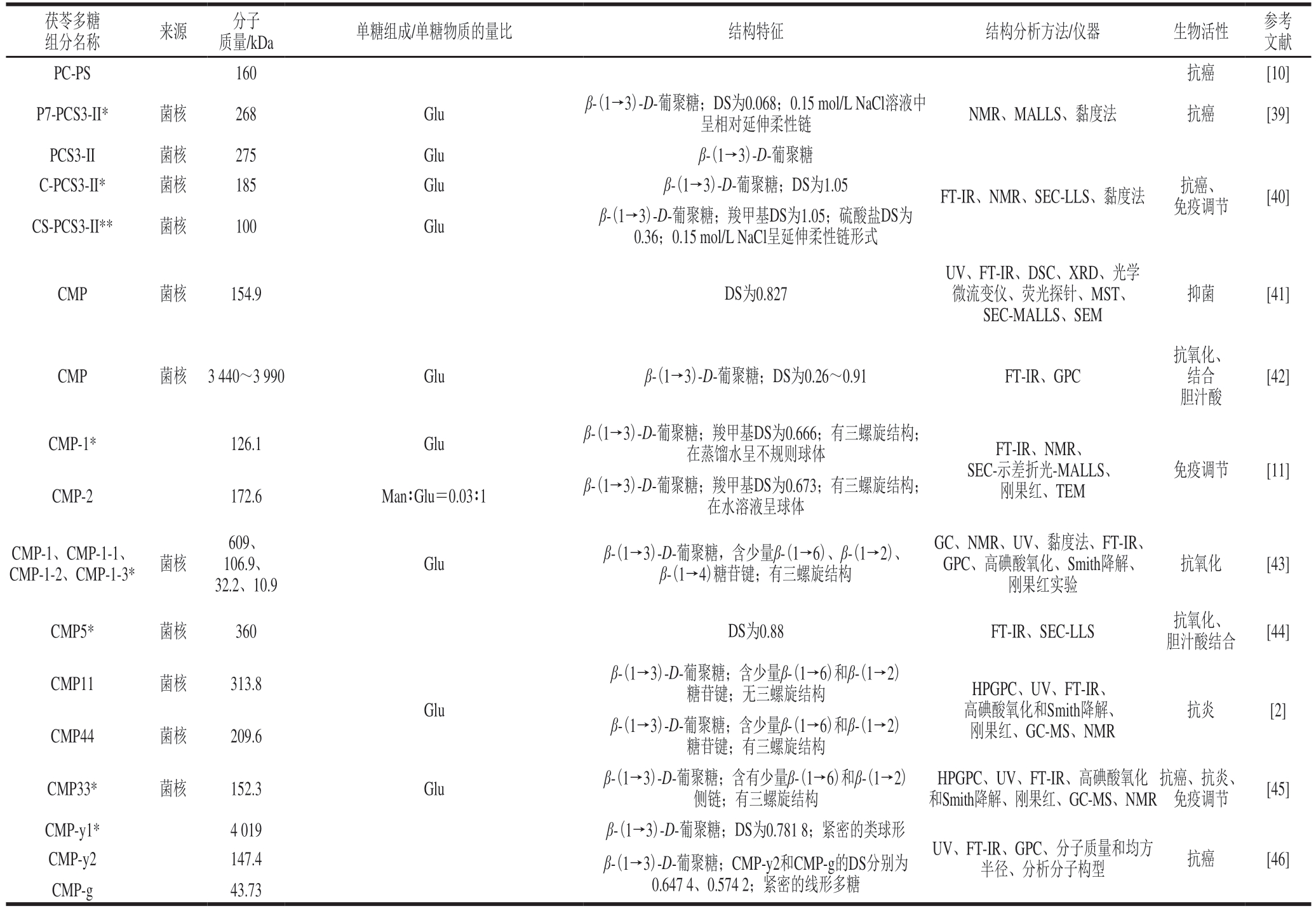
注:-.文献未报道;Fuc.岩藻糖(fucose);Glcp.吡喃葡萄糖(glucopyranose);Galp.吡喃半乳糖(galactopyranose);T.多糖支链与主链单糖的连接位置为2、3、4位;*.对应参考文献中生物活性相对较强的茯苓多糖组分;HPLC.高效液相色谱法(high performance liquid chromatography);NMR.核磁共振波谱(nuclear magnetic resonance);FT-IR.傅里叶变换红外光谱(Fourier transform infrared spectrometer);GPC.凝胶渗透色谱(gel permeation chromatography);SEM.扫描电子显微镜(scanning electron microscope);SEC.体积排阻色谱(size exclusion chromatography);HPSEC.高效体积排阻色谱(high performance size exclusion chromatography);LS.光散射(light scattering);LLS.激光光散射(laser light scattering);MALLS.多角度激光散射(multi-angle laser light scattering);HPAEC.高效阴离子交换色谱(high performance anion exchange chromatography);UV.紫外光谱(ultraviolet);GC.气相色谱(gas chromatography);GC-MS.气相色谱-质谱联用(gas chromatographic mass spectrometer);IC.离子色谱(ion chromatography);TLC.薄层层析(thin-layer chromatography);EA.元素分析(element analysis);DSC.差示扫描热量(differential scanning calorimetry);MST.微量热泳动法(microscale thermophoresis)。
2 茯苓多糖的生物活性
2.1 抗肿瘤活性
癌症治疗包括手术、化疗、放疗法等,会产生器官衰竭、免疫力低下等毒副作用,增加癌症的治疗难度[5]。茯苓多糖可对抗多种癌,毒性弱且成本低,能激活机体免疫应答,增强对肿瘤细胞的免疫监视,是极具潜力的免疫疗法[47]。茯苓多糖H11能够显著抑制皮下肉瘤S180而对腹水S180抑制不明显,通过增强宿主的防御机制发挥抗肿瘤活性[48]。羧甲基茯苓多糖可以激活H22荷瘤小鼠的巨噬细胞,提高淋巴细胞转化率及自然杀伤(natural killer,NK)细胞杀伤癌细胞的活性[49]。
茯苓多糖直接作用于肿瘤细胞,改变肿瘤细胞信号传导途径中关键蛋白和酶的表达,从而达到抑制肿瘤细胞增殖、分化、侵袭和诱导其凋亡的目的。茯苓多糖能够增强白血病细胞HL-60中磷酸酪氨酸蛋白磷酸酶(phosphotyrosyl protein phosphatase,PTPP)的活力,减弱TPK的活力,减缓癌细胞增殖分化[50]。同时,茯苓多糖对肿瘤细胞凋亡的两条主要途径均有调控作用,CMP对HepG2肝癌细胞的抑制作用呈浓度依赖效应,100 μg/mL的CMP肝癌细胞抑制率能达到76%,使线粒体通路的胱天蛋白酶(Caspase)-8表达增加,降低抗凋亡蛋白B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)和促凋亡蛋白Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)的比值,促进线粒体内膜释放细胞色素c,激活Caspase-3。死亡受体通路的Fas分子、Fas配体(Fas ligand,FasL)和Fas相关死亡结构域蛋白(Fas-associated protein with death domain,FADD)的转录水平均增加,级联激活Caspase-3,促使癌细胞凋亡[51]。值得关注的是,研究表明Janus激酶(Janus kinase,JAK)/信号转导和转录激活因子(signal transducer and activators,STAT)通路以及细胞外信号调节激酶1/2(extracellular signal-regulated protein kinase 1/2,ERK1/2)通路的异常激活也与癌细胞增殖分化、侵袭、凋亡密切相关。茯苓多糖以剂量依赖效应下调高糖诱导下乳腺癌MCF-7细胞的JAK/STAT通路,其中高剂量抗增殖和诱导凋亡的效果最好[52]。唐恩红[53]发现茯苓多糖下调ERK1/2的磷酸化,宫颈癌HeLa细胞阻滞于G2/M期,降低癌细胞克隆形成能力和迁移率。
减轻癌症毒性也是茯苓多糖抗肿瘤的机制之一,抑制肿瘤复发转移还有减轻癌症治疗过程中化疗、放疗、药物引起的器官损伤。茯苓发酵液多糖干预转化生长因子β受体(transforming growth factor β receptor,TGFβR)信号通路,降低胃癌肿瘤移植小鼠的TGFβRI和转移蛋白Slug的表达,减少局部黏着斑激酶(focal adhesion kinase,FAK)和蛋白激酶B(protein kinase B,AKT)的磷酸化,显著抑制肺癌CL1-5细胞的转移和侵袭[34]。茯苓多糖降低宫颈癌HeLa细胞迁移蛋白如基质金属蛋白酶-9(matrix metalloprotein-9,MMP-9)和血管内皮生长因子(vascular endotheliar growth factor,VEGF)A的表达,抑制新生血管的形成,不利于肿瘤细胞的迁移、浸润和转移[53],人乳腺癌MDA-MB-231细胞中与癌变密切相关的关键蛋白核基质结合区结合蛋白1(special AT-rich sequence-binding protein,SATB1)表达也显著降低,癌细胞侵袭转移明显减少[54]。在CT26结肠癌荷瘤小鼠模型中,CMP可能通过核因子(nuclear factor,NF)-κB、核因子红细胞系2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)-抗氧化反应原件(antioxident response element,ARE)和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)/p38途径来减轻5-氟尿嘧啶治疗引起的结肠细胞炎症和氧化损伤,恢复肠道菌群多样性[55]。茯苓多糖抗肿瘤活性的作用机制及效果如图1所示。
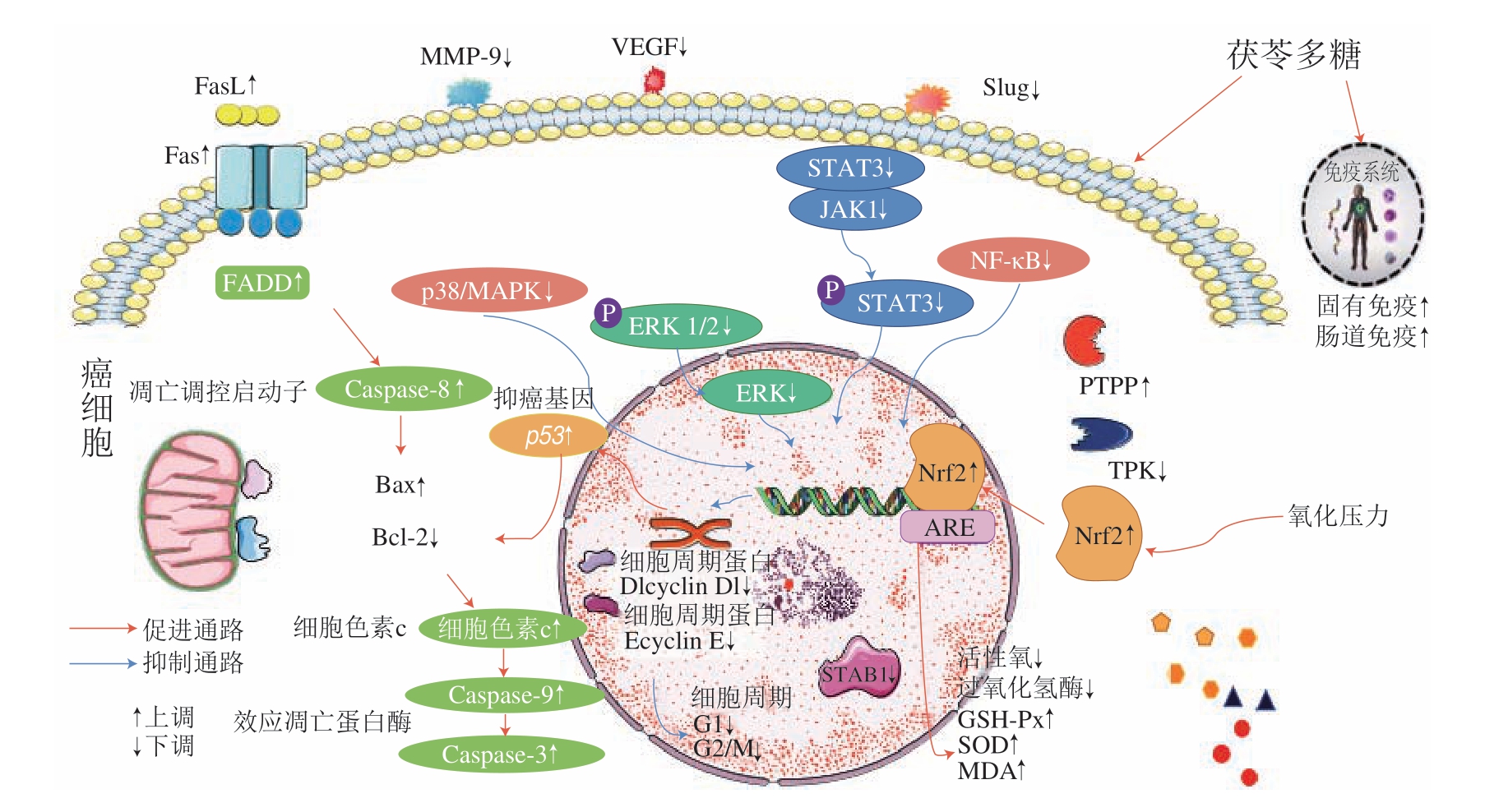
图1 茯苓多糖抗肿瘤活性机制
Fig.1 Anti-tumor mechanism of P.cocos polysaccharides
GSH-Px.谷胱甘肽过氧化物酶(glutathione peroxidase);SOD.超氧化物歧化酶(superoxide dismutase);MDA.丙二醛(malondialdehyde)。
2.2 免疫调节活性
CMP激活以巨噬细胞为中心的固有免疫,增加RAW264.7巨噬细胞活化标志分子白细胞分化抗原(cluster of differentiation,CD)86表达,刺激巨噬细胞向具有抑炎作用的M2型极化[56]。目前发现茯苓多糖调节巨噬细胞免疫调节相关通路主要有3 条。首先,茯苓菌核多糖提高巨噬细胞膜受体CD14、Toll样受体4(Toll like receptor 4,TLR 4)、补体受体3(complement receptor 3,CR3)和p38激酶活性,通过NF-κB/转录因子Rel蛋白和p38激酶促进诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)基因表达,从而增加NO释放[57],还能调节Ca2+/蛋白激酶C(protein kinase C,PKC)/p38/NF-κB通路,提高巨噬细胞钙水平、p38及NF-κB的转录和翻译水平,进而激活PKC,增加NO、肿瘤坏死因子(tumor necrosis factor,TNF)-α、白细胞介素(interleukin,IL)-1β、IL-6的释放[58]。同时,茯苓碱性多糖CMP33又能抑制脂多糖诱导巨噬细胞产生过量的炎症介质,降低NO、IL-6、TNF-α和IL-1β释放水平[45]。TLR 4信号通路是茯苓多糖调节免疫的重要通路,显著增加TLR4、髓样分化因子(myeloid differentiation factor 88,MyD88)、肿瘤坏死因子受体相关因子6(tumor necrosis factor associated factor 6,TRAF-6),通过级联反应提高NO、IL-2、IL-6、IL-17A、TNF-α和干扰素(interferon,IFN)-γ的水平来加强体内外的免疫调节[59]。
在特异性免疫方面,茯苓多糖能够促进T淋巴细胞增殖,调节T淋巴细胞分泌细胞因子,进而刺激NK细胞、辅助性T细胞(T helper cell,Th)和杀伤T细胞(cytotoxic T cell,Tc)发挥更强的细胞免疫作用[60],还会促进B淋巴细胞合成免疫球蛋白,增强机体体液免疫[9]。茯苓多糖已被用作炭疽、狂犬病、甲型流感病毒H1N1的新型疫苗佐剂[25],与传统的明矾和铝佐剂相比能产生更强和持久的体液免疫和细胞免疫反应[15],Liu Kun等[61]发现茯苓多糖可显著提高炭疽疫苗免疫小鼠的抗原特异性抗体的水平和亲和力,Th2免疫偏倚转变为Th 1/Th 2免疫平衡应答,抗原特异性记忆B细胞的频率增加,促进脾细胞增殖,活化树突状细胞。Zhang Weijiao等[62]发现经含有茯苓多糖佐剂炭疽疫苗免疫的兔子体内,淋巴结的B淋巴细胞和血液中B、T淋巴细胞增加,强烈诱导脾细胞分泌高水平的细胞因子。
肠道是人体最大的免疫器官,肠黏膜屏障是防止有害物质和细菌侵入机体的第一道防线[63]。近年来研究发现肠道黏膜免疫系统可能是茯苓多糖发挥免疫调节作用的重要靶点。茯苓多糖调整脾虚免疫低下模型小鼠的肠道菌群结构,增加脾和胸腺组织CD3+T、CD 19+B 细胞数量,小肠液分泌型免疫球蛋白A(secretory immunoglobulin A,SIgA)和小肠组织免疫球蛋白(immunoglobulin,Ig)A和闭锁小带蛋白1(zonula occluden 1,ZO-1)的表达增加,促进IgG、IgM的表达[64]。茯苓多糖免疫调节活性的作用机制如图2所示。
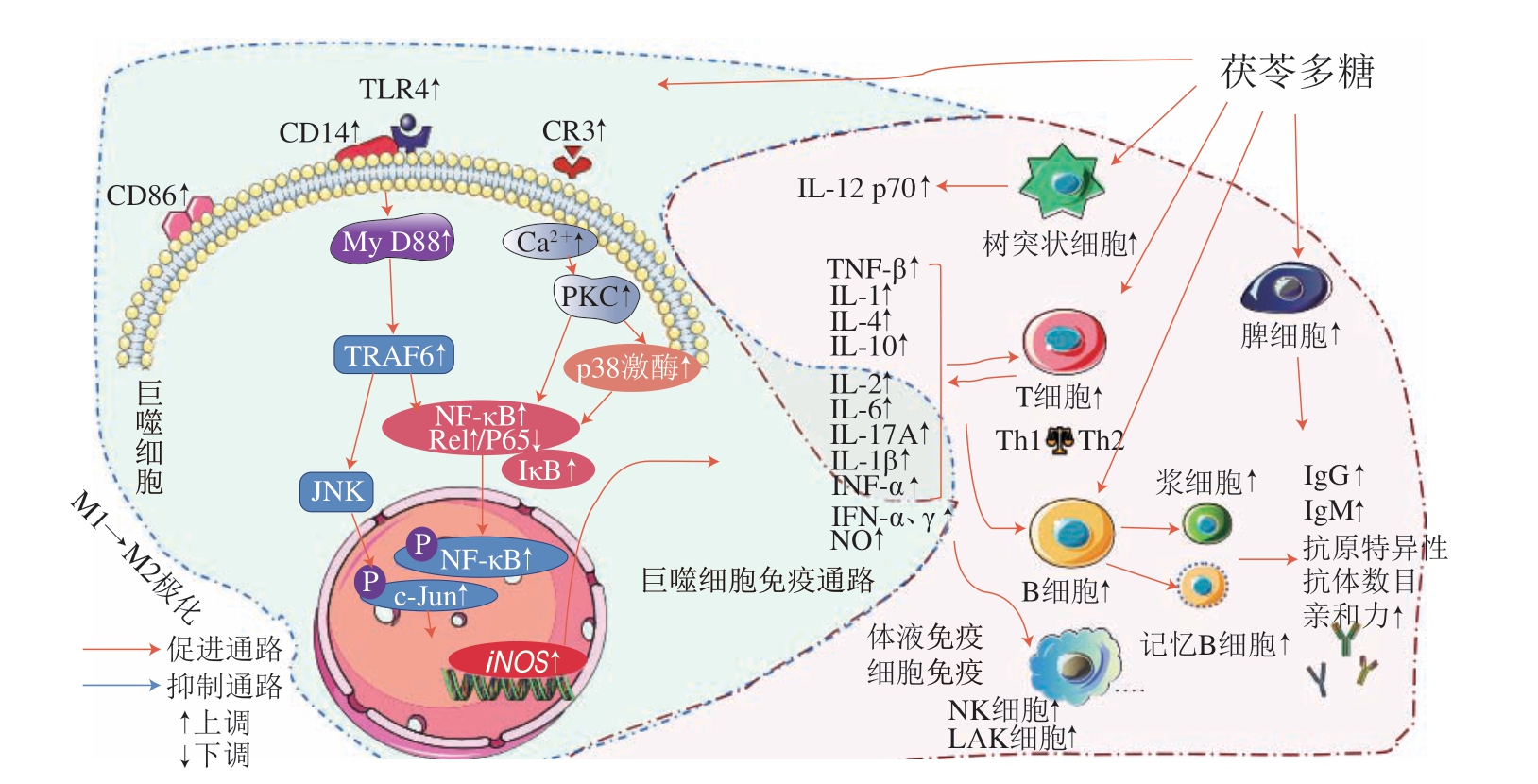
图2 茯苓多糖免疫调节活性机制
Fig.2 Immunomodulatory mechanism of P.cocos polysaccharides
LAK细胞.淋巴因子激活的杀伤细胞(lymphokine-activated killer cell);JNK.c-Jun氨基端蛋白激酶(c-Jun N-terminal kinase)。
2.3 抗炎活性
病原体入侵机体时,机体会分泌免疫因子从而提高机体免疫功能,但过度的免疫反应如炎症反应会对机体自身造成伤害[60],炎症是影响癌症、抑郁症等病理过程发展的关键因素。茯苓多糖对皮下肉芽肿及耳肿[65]、肾炎[66]、结肠炎[67-69]、胰腺炎[70]、非细菌性前列腺炎[33]等均有很好的治疗效果。
炎症性肠病(inflammatory bowel disease,IBD)因高发生率、难治愈、易复发和致死而渐渐成为中国乃至世界亟待解决的公共健康问题[71],茯苓多糖的抗炎活性为IBD治疗提供新思路。茯苓多糖抗结肠炎的机制可能是改善肠道菌群失衡,增加抗炎症的普雷沃氏菌属、乳杆菌科和短链脂肪酸产生菌的丰度,减少潜在致病菌定植,从而促进肠道屏障恢复[64]。三硝基苯磺酸诱导的大鼠结肠炎模型中,茯苓多糖抑制IL-33/血清可溶性ST2受体(serum soluble ST2 receptor,sST2)信号通路,黏膜损伤细胞和肥大细胞活化数目减少、胰蛋白酶含量减少[67],Liu Xiaofei等[68]还发现CMP作用于三硝基苯磺酸诱发的小鼠结肠炎后,结肠组织中MPO活性和MDA含量减少,通过调控潜在的靶向蛋白组和关键蛋白代谢保护小鼠结肠炎。CMP干预的TNF-α损伤的人结肠上皮Caco-2细胞中NF-κB、肌球蛋白轻链激酶(myosin light chain kinase,MLCK)、磷酸化肌球蛋白轻链(phosphorylated myosin,p-MLC)信号通路下调,肠道紧密连接蛋白表达加强,从而有效预防结肠炎[69]。上述机制均能抑制促炎因子的产生,同时增加抗炎因子水平,减轻氧化应激和肠道屏障损伤,发挥抗结肠炎作用。茯苓多糖抗结肠炎机制如图3所示。
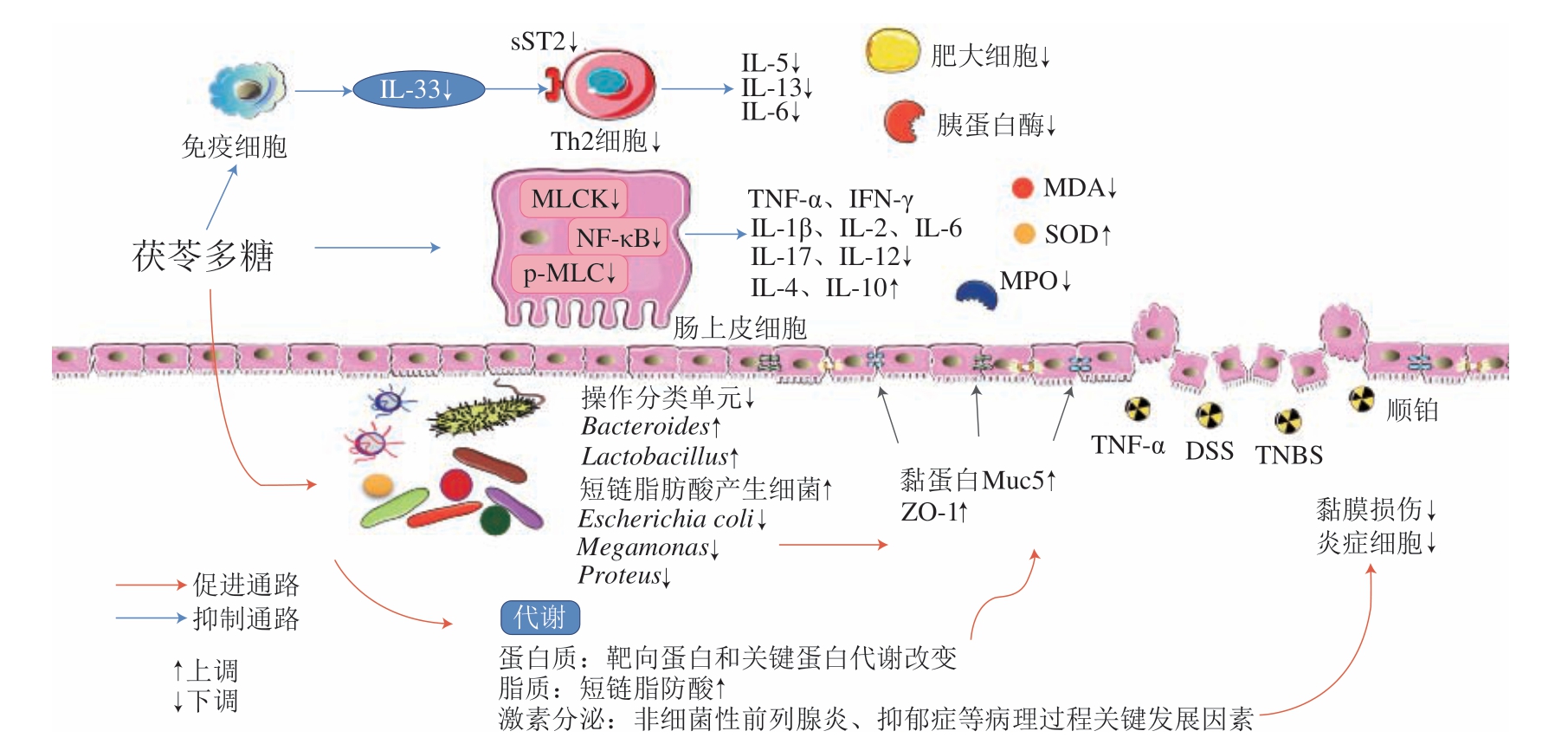
图3 茯苓多糖抗结肠炎活性机制
Fig.3 Anti-IBD mechanism of P.cocos polysaccharides
血管平滑肌细胞(vascular smooth muscle cell,VSMCs)中的炎症反应、氧化应激和泡沫细胞的形成在动脉粥样硬化的发病机制中发挥重要作用。氧化型低密度脂蛋白(oxidized low density lipoprotein,ox-LDL)诱导的VSMCs氧化应激和炎症模型中,茯苓多糖通过ERK/Nrf2/HO-1通路降低氧化应激和炎性细胞因子NO、IL-6、TNF-α、环氧化酶(cyclooxygenase,COX-2)和iNOS,抑制ox-LDL诱导的氧化低密度脂蛋白受体1(low-density lipoprotein receptor-1,LOX-1)上调,减少ox-LDL的摄取和细胞内脂质的积累,抑制VSMCs泡沫细胞的形成和增殖[72]。在同样的模型中,茯苓多糖还可以抑制TLR4/NF-κB p65炎症通路从而治疗动脉粥样硬化[73]。
2.4 护肝活性
不良饮食习惯、过度饮酒、药物和环境的毒性化学物等因素可能导致肝细胞不同程度的坏死,最终导致脂肪肝、肝炎、肝纤维化、肝硬化甚至肝癌等肝病的发生[74]。现代药理学研究证明,茯苓多糖、三萜与醇类等都有护肝功效[75]。异硫氰酸-α-萘酯诱导的大鼠黄疸模型中,高剂量茯苓多糖的退黄作用最佳,能够显著降低血清丙氨酸氨基转移酶、天冬氨酸氨基转移酶的水平和血清总胆红素含量,同时显著提高肝脏免疫功能,降低IL-1β、TNF-α mRNA表达水平,提升IL-4 mRNA表达水平[76]。茯苓杂多糖能减轻机体氧化应激来改善肝功能,研究人员利用茯苓杂多糖干预醋酸酚诱导的小鼠肝损伤,结果表明茯苓杂多糖能够提高SOD和GSH-Px的活力,减少肝组织MDA含量,降低肝细胞炎症因子TNF-β和TNFsR-I水平和热休克蛋白90的生物活性[26]。
茯苓多糖护肝活性由一些细胞凋亡和炎症应激通路介导,5-氟尿嘧啶诱导小鼠肝脏损伤模型中促凋亡蛋白磷酸化p38和Bax的表达降低,Bcl-2的水平提高,通过MAPK/p38/JNK通路减轻肝细胞的凋亡并增强其抗氧化能力,有效缓解5-氟尿嘧啶引起的肝损伤[77]。茯苓多糖干预醋酸酚诱导的小鼠肝损伤后,免疫荧光染色显示小鼠肝脏中代谢乳酸和解毒的醛酮还原酶、c-Jun、Bcl-2阳性细胞水平增加,而Bax标记细胞减少,NF-κB p65、NF-κB抑制蛋白α表达呈剂量依赖性下降,TNF-α、IL-6水平降低,说明茯苓多糖抑制NF-κB通路介导的肝细胞凋亡和炎症应激[78]。
在代谢水平上,茯苓多糖可降低毒性化学物的代谢水平和改善肝脏脂质代谢,减轻肝脂肪变性。50~100 mg/kg mb剂量范围茯苓多糖内能够逆转肝脏构成性雄甾烷受体的过表达来抑制细胞色素P4502E1酶活性,降低小鼠肝脏对毒性CCl4的代谢[26]。在水溶性茯苓多糖干预的乙醇诱导酒精性肝脂肪变性小鼠模型中,乳酸脱氢酶、甘油三酯、血清总胆固醇水平减少,单核细胞趋化蛋白1表达减少,激活过氧化物酶增殖物激活受体γ通路,同时调节肠道菌群,抑制乙醇诱导的真菌过度生长,有效地改善了肝脏炎症损伤和脂肪堆积[79]。
2.5 抗抑郁活性
茯苓是传统疏肝解郁中草方剂逍遥散[75]、半夏厚朴汤[32]的成分之一,近年的研究证明逍遥散可改善慢性不可预测轻度应激(chronic unpredictable mild stress,CUMS)引起的抑郁行为、脑代谢紊乱和盲肠菌群的异常及氨基酸代谢紊乱[80-81]。茯苓多糖作为其主要活性成分,有协同戊巴比妥钠抑制中枢神经系统、安神镇静的疗效[82]。茯苓多糖抗抑郁的主要机制是降低脑区炎症因子水平,调控神经递质代谢并增强免疫功能。茯苓多糖灌胃的CUMS小鼠中炎症因子p38、NF-κB和TNF-α的表达量降低,额叶皮质多巴胺(dopmine,DA)和5-羟色胺(5-hydroxytryptamine,5-HT)的转换率变慢[38],能协同厚朴多糖减轻全脑血清素和多巴胺系统功能异常[32]。陈可琢等[83]发现茯苓酸性多糖抑制CUMS小鼠的NOD样受体热蛋白结构域相关蛋白3炎症小体通路,降低脑区IL-1β、IL-18、TNF-α等炎症因子水平,升高神经递质DA、5-HT、5-羟吲哚乙酸水平而下调谷氨水平。硫酸化茯苓多糖干预卵巢摘除和CUMS复合诱导的抑郁大鼠后,海马α-氨基-3-羟基-5-甲基-4-异恶唑丙酸受体的亚基谷氨酸受体1的磷酸化水平和功能提高,刺激海马脑源性神经营养因子和磷酸化cAMP反应原件结合蛋白的表达,显著减轻海马神经元损伤,从而发挥抗抑郁活性[84]。
2.6 其他活性
茯苓多糖还有抗氧化、抗衰老、抗疲劳、降糖降脂、调节泌尿系统、抑菌等多种生理活性。茯苓多糖体外螯合亚铁离子、清除羟自由基和2,2’-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)阳离子自由基的能力较强,能保护DNA免受氧化损伤[22],还可上调抗氧化酶T-SOD和Cu-SOD的表达,降低多酰基辅酶A脱氢酶和单胺氧化酶的活性,减轻细胞氧化损伤,发挥抗衰老的活性[47]。CMP还可减轻人肾近端小管上皮细胞氧化损伤,抑制草酸钙晶体的形成来发挥抗结石的活性[27]。
茯苓碱性多糖降低糖化血红蛋白A1c,改善糖耐量和胰岛素抵抗,从而降低糖尿病小鼠空腹血糖和自由饮食血糖[35]。茯苓水溶性及水不溶性多糖有调控下焦水湿的功效,能改善肾阳虚下焦水肿大鼠模型的肾功能、促进水的重吸收和脂质的代谢[85]。同样地,茯苓多糖干预慢性高尿酸大鼠后,减少肾脏尿酸转运体1表达,促进尿酸排泄,肾脏病理恢复正常水平[86]。CMP对革兰阳性菌的抑菌能力高于革兰阴性菌[87]。
3 茯苓多糖结构和生物活性的关系
复杂的多糖糖链为其结构研究带来巨大困难的同时也使其能携带巨大的生物信息[5]。多糖分子质量、单糖组成、侧链基团、糖苷键类型、分支度及高级构象不同,直接导致多糖的溶解度、电荷性、黏阻力等物理性质发生改变[8],从而显著影响其活性作用。针对茯苓多糖结构与活性关系的研究,对其活性提高有很大的指导意义,对药物和保健食品的开发至关重要。
3.1 茯苓多糖抗肿瘤构效关系
多糖抗肿瘤的典型结构是三螺旋结构,研究表明香菇多糖活性最大的空间构型是三股螺旋构型,具有显著的抗肿瘤活性[88]。茯苓碱溶性多糖与香菇多糖的化学结构相似,由于支链过长和分子质量过高,无抗肿瘤活性,但通过适当地高碘酸氧化和Smith降解β-(1-6)支链后具有强烈的抗肿瘤活性,XRD分析表明改性后茯苓多糖己形成三螺旋结构[89]。
多糖能溶于水是其发挥生物活性的首要条件,低溶解度、高分子质量及其在溶剂中无序的聚集状态是碱溶性茯苓多糖抗肿瘤活性低的关键原因。茯苓多糖分别经5 种化学修饰后,结果表明经硫酸化和羧甲基化的茯苓多糖总DS较高,分子质量适中,多糖溶解性和链刚度提高,对S-180、MKN-45和SGC-7901肿瘤细胞均有明显的抑制作用[14]。茯苓菌丝多糖ab-PCM3-I和ac-PCM3-I硫酸酯化,分别得到两个中等分子质量范围(2.0h 104~40.0h 104 kDa)、水溶性良好和链刚度较高的磺化衍生物,抗肿瘤活性显著增强,体内外抗肿瘤活性远高于天然α-D-茯苓聚糖[38]。DS和分散系数最高、分子种类更丰富和结构呈紧密类球形的CMP-y1抑制AV3和HeLa肿瘤细胞活性高于线形的CMP-y2和CMP-g,综合利用价值更高[46]。碱处理能使β-(1→3)-D-葡聚糖的主链变短,支链数量变少,通过控制不同碱液浓度和处理时间产生7 个茯苓多糖组分,在溶剂中呈球形和类球形分布的CMP1~6抗肝癌活性均高于无规则线形的CMP7,其中适度碱处理的CMP3抑制增殖效果最好[51]。由此可见,茯苓多糖的化学修饰不仅能改变多糖分子间和分子内氢键作用和分子质量,大幅提高其水溶性,还能改变多糖高级构象,产生或增强茯苓多糖的抗肿瘤活性。
3.2 茯苓多糖免疫调节构效关系
多糖的单糖组成和其生物活性有密切的关系。研究人员通过高效液相色谱和正交偏最小二乘分析16 批不同产地茯苓多糖的指纹图谱,发现Glu、Gal和Man与小鼠巨噬细胞释放NO的免疫活性呈正相关且有显著贡献,Fuc、氨基葡萄糖、葡萄糖醛酸和Xyl与免疫活性呈负相关[90]。但是这些单糖在精细高级结构中如何形成活性中心,进而影响茯苓多糖活性机理并不明晰。
茯苓多糖的侧链基团和链的柔韧性对免疫活性的提升起关键作用。磷酸茯苓多糖P-PCS3-II的磷酸基使其在水溶液中能够以轻微伸展的柔性长链构象存在,与免疫细胞受体结合的机会增加,对体内肉瘤S-180抑制活性增强,而原PCS3-II无生物活性[91]。多糖的多重修饰可使其具有更优良的性质和用途,由PCS3-II羧基化和硫酸化衍生而来的CS-PCS3-II在0.15 mol/L NaCl溶液中以延伸的柔性链形式存在,使修饰基团与巨噬细胞受体氢结合和静电吸引力增加,促进多糖与受体的接触,刺激巨噬细胞增殖分化,产生比仅硫酸化修饰的PCS3-II更强的免疫反应来杀伤肿瘤[40]。
3.3 茯苓多糖其他活性构效关系
龚志华[20]研究发现茯苓多糖葡聚糖主链辐照后主链的共价键和非共价键被打断,产生了含有羧基、分子质量较小的酸性多糖,其降血糖功能和综合抗氧化能力增强。Tang Jin等[22]用不同浓度H2O2降解得到3 种的茯苓多糖均具有抗氧化活性和DNA损伤保护能力,其中分子质量适中的茯苓多糖PCP-1螯合铁离子和保护DNA的能力最强。Wang Nani等[29]比较了热水提取、超声辅助提取、酶辅助提取和微波辅助提取的4 种茯苓多糖,结果发现微波辅助提取的茯苓多糖PCP-M由于中性糖含量较低、糖醛酸含量较高、相对分子质量较低而具有最佳的抗氧化活性。
研究表明,茯苓多糖羧甲基化的过程中,抗氧化活性基团充分暴露,更易与1,1-二苯基-2-苦基肼(1,1-diphenyl-2-picryl-hydrazyl,DPPH)自由基、羟自由基和超氧阴离子自由基结合,与未修饰多糖相比,对上述自由基的最大清除率分别提高了33.91%、52.86%和72.62%[92]。Wang Yongjia等[44]发现5 种CMP离子基团随DS增加,离子基团数量增加,物质水溶性增加,亚铁离子的螯合效果增强,羟自由基清除活性增强,同时碳杂环上的电子密度增加,清除超氧化物的能力增强。CMP空间构象与制备方式有关,当制备条件为0.8 mol/L NaOH溶液、反应时间8 h、乙醇体积分数80%,重均分子质量降到最低(168.3 kDa),结构呈规则的类球形,与其他碱处理呈无规卷曲分布的CMP比,表现出更强的抗氧化能力,且存在剂量-效应关系[93]。
茯苓多糖的化学修饰可改变自身的疏水性和亲水性。羧甲基的引入和两者之间适当的浓度配比使CMP与莲房原花青素之间的相互作中产生更小的分子尺寸、更少的负电荷、更高的疏水性和黏度,抑菌活性增强[41]。别蒙等[87]的研究表明CMP羧甲基化程度越高,茯苓多糖重均分子质量从2.218h 105 Da降至1.510h 105 Da,中性糖含量降低,水溶性及电位绝对值均升高,破坏细菌的细胞膜的活性越大,在CMP质量浓度为10 mg/mL时,DS为0.728的CMP对金黄色葡萄球菌的抑制率可达到60.91%。
茯苓多糖构效关系如图4所示。
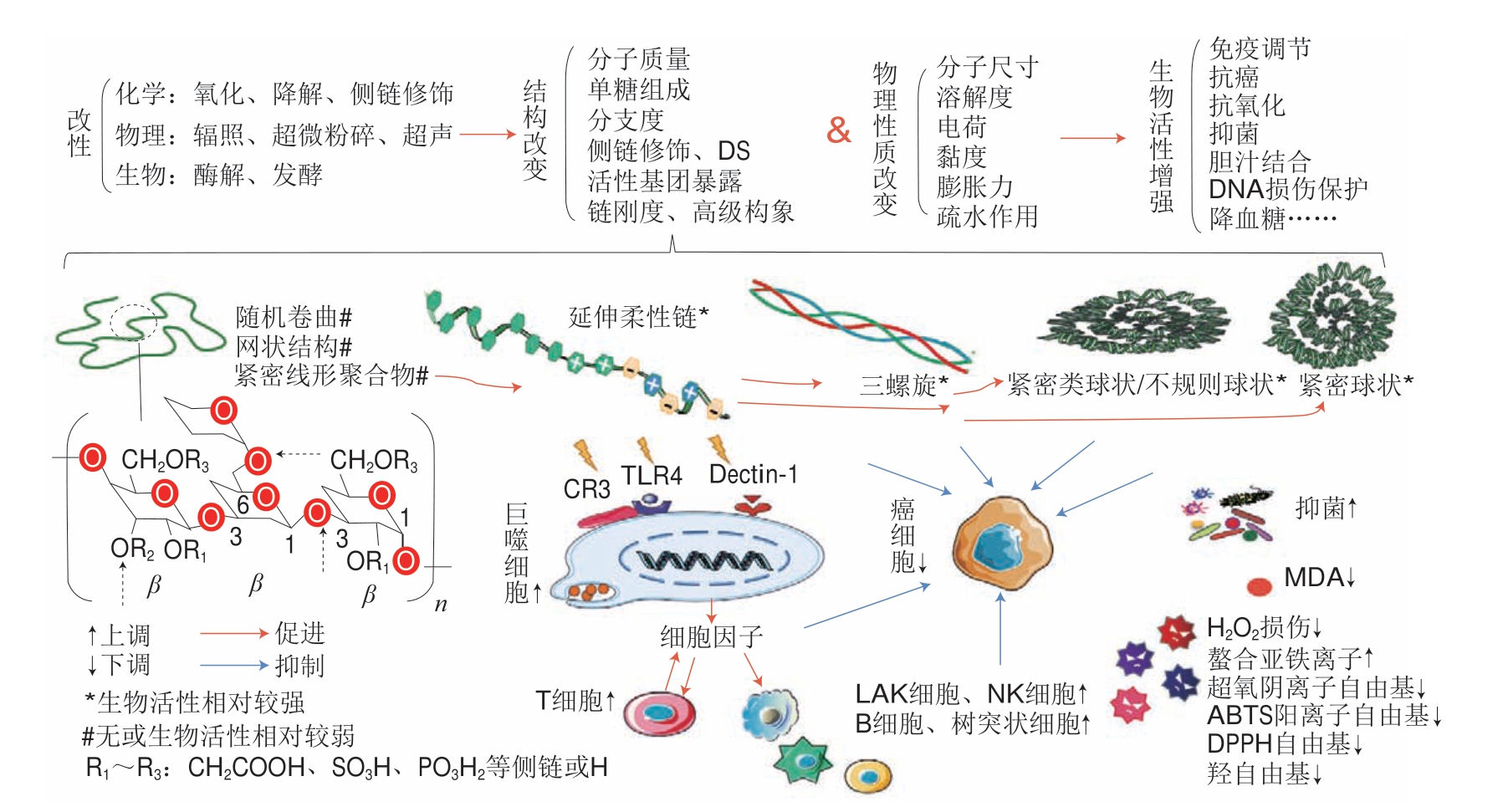
图4 茯苓多糖构效关系
Fig.4 Relationship between structure and biological activity of P.cocos polysaccharides
4 结语
不良饮食习惯、工作和环境等多因素诱发的恶性肿瘤、免疫力低下、肠胃炎、酒精肝、脂肪肝、抑郁、高血糖等疾病引起人们对药食同源食品的广泛关注。茯苓作为传统药食同源食品,在中药方剂中配伍应用广泛,近年来其多种活性功能被深入挖掘,在食品、药品、保健品方面开发潜力巨大。茯苓多糖联合中草药配方、抗癌药物和疫苗将是研究的热点,如逍遥散、五苓散和桂枝茯苓丸等配方中茯苓多糖和其他活性成分的协同作用和构效机制值得进一步挖掘。与此同时,茯苓食用部位和来源、贮存、加工方式不同,多糖含量、结构和活性不同,加强茯苓的质量控制是茯苓多糖在食品和制药应用方面保持化学结构和生物活性可靠和一致的关键。
茯苓碱性多糖水溶性差,产率低、分离纯化困难且生物活性低,通过改性得到溶于水的茯苓多糖,可改善原有生物活性或产生新的生物活性。因此,茯苓多糖的结构改性是目前国内外学者研究的主要方向。尽管茯苓多糖的市场开发已经取得了很大的突破,但受到空间结构分析技术的限制,茯苓多糖结构与生物活性机理的关系和提高其构效的研究都比较浅显,此外,临床试验研究尚不充分,限制了其开发应用。因此,进一步规范茯苓多糖品质标准、深入挖掘茯苓多糖多种生理活性、阐明多糖精细结构及其构效关系,从而改善多糖衍生物活性,特别是调控茯苓多糖衍生物的化学修饰程度,并对其进行可靠的药代动力学研究,可促进茯苓多糖药品或保健食品的开发。
[1] 国家药典委员会.中华人民共和国药典(2020年版): 一部[M].北京:中国医药科技出版社,2020: 251-252.
[2] 刘晓菲.羧甲基茯苓多糖的纯化及生物活性研究[D].广州: 华南理工大学,2018: 1-15.
[3] 王永江,吴学谦,毛建卫,等.茯苓多糖的提取及羧甲基化工艺研究进展[J].农产品加工,2008(10): 58-60.DOI:10.3969/j.issn.1671-9646-C.2008.10.031.
[4] 游昕,熊大国,郭志斌,等.茯苓多种化学成分及药理作用的研究进展[J].安徽农业科学,2015,43(2): 106-109.DOI:10.3969/j.issn.0517-6611.2015.02.042.
[5] 韩铨.茶树花多糖的提取、纯化、结构鉴定及生物活性的研究[D].杭州: 浙江大学,2011: 10-15.
[6] HUANG Q L,YONG J,ZHANG L N,et al.Structure,molecular size and antitumor activities of polysaccharides from Poria cocos mycelia produced in fermenter[J].Carbohydrate Polymers,2007,70(3): 324-333.DOI:10.1016/j.carbpol.2007.04.015.
[7] 牛爽,郝利民,赵树欣,等.茯苓多糖的研究进展[J].食品科学,2012,33(13): 348-353.
[8] 胡国元,李伟伟,袁军,等.茯苓多糖的修饰技术及其构效关系研究进展[J].林产化学与工业,2013,33(5): 121-126.DOI:10.3969/j.issn.0253-2417.2013.05.023.
[9] 蒋逸凡,金梦圆,周选围.茯苓多糖及其免疫调节功能研究进展[J].食用菌学报,2021,28(2): 130-139.DOI:10.16488/j.cnki.1005-9873.2021.02.017.
[10] CHEN Y Y,CHANG H M.Antiproliferative and differentiating effects of polysaccharide fraction from fuling (Poria cocos) on human leukemic U937 and HL-60 cells[J].Food and Chemical Toxicology,2004,42(5): 759-769.DOI:10.1016/j.fct.2004.01.018.
[11] LIU Feng,LIU Ying,FENG Xi,et al.Structure characterization and in vitro immunomodulatory activities of carboxymethyl pachymaran[J].International Journal of Biological Macromolecules,2021,178: 94-103.DOI:10.1016/j.ijbiomac.2021.02.046.
[12] ZHANG L N,DING Q,MENG D Y,et al.Investigation of molecular masses and aggregation of β-D-glucan from Poria cocos sclerotium by size-exclusion chromatography[J].Journal of Chromatography A,1999,839(1/2): 49-55.DOI:10.1016/S0021-9673(99)00086-2.
[13] WANG Y J,LIU S W,YANG Z X,et al.Oxidation of β-glucan extracted from Poria cocosand its physiological activities[J].Carbohydrate Polymers,2011,85(4): 798-802.DOI:10.1016/j.carbpol.2011.03.052.
[14] WANG Yifeng,ZHANG Lina,LI Yunqiao,et al.Correlation of structure to antitumor activities of five derivatives of a β-glucan from Poria cocos sclerotium[J].Carbohydrate Research,2004,339(15):2567-2574.DOI:10.1016/j.carres.2004.08.003.
[15] 程玥,丁泽贤,张越,等.茯苓多糖及其衍生物的化学结构与药理作用研究进展[J].中国中药杂志,2020,45(18): 4332-4340.DOI:10.19540/j.cnki.cjcmm.20200624.601.
[16] 廖彦.茯苓多糖的液态发酵及抗氧化研究[D].长沙: 湖南中医药大学,2017: 15-21.
[17] JIN Yong,ZHANG Linna,ZHANG Mei,et al.Antitumor activities of heteropolysaccharides of Poria cocos mycelia from different strains and culture media[J].Carbohydrate Research,2003,338(14): 1517-1521.DOI:10.1016/S0008-6215(03)00198-8.
[18] WU Peng,TAN Hongyuan,ZHAN Janfeng,et al.Optimization of bioprocess extraction of Poria cocos polysaccharide (PCP)with Aspergillus niger β-glucanase and the evaluation of PCP antioxidant property[J].Molecules,2020,25(24): 5930.DOI:10.3390/molecules25245930.
[19] 梅光明,李孚杰,沈思,等.茯苓中碱溶性多糖的提取及其超微粉碎改性研究[J].食品科学,2007,28(10): 278-283.DOI:10.3321/j.issn:1002-6630.2007.10.066.
[20] 龚志华.茯苓辐照降解及其产物生物活性研究[D].长沙: 湖南农业大学,2010: 25-32.
[21] CHEN X P,TANG Q C,CHEN Y,et al.Simultaneous extraction of polysaccharides from Poria cocos by ultrasonic technique and its inhibitory activities against oxidative injury in rats with cervical cancer[J].Carbohydrate Polymers,2010,79(2): 409-413.DOI:10.1016/j.carbpol.2009.08.025.
[22] TANG Jin,NIE Jing,LI Danping,et al.Characterization and antioxidant activities of degraded polysaccharides from Poria cocos sclerotium[J].Carbohydrate Polymers,2014,105: 121-126.DOI:10.1016/j.carbpol.2014.01.049.
[23] CHEN J,LEI C,LIN S,et al.Preparation and structural characterization of a partially depolymerized β-glucan obtained from Poria cocos sclerotium by ultrasonic treatment[J].Food Hydrocolloids,2015,46: 1-9.DOI:10.1016/j.foodhyd.2014.12.005.
[24] WANG Y,ZHANG M,DONG R,et al.Chemical components and molecular mass of six polysaccharides isolated from the sclerotium of Poria cocos[J].Carbohydrate Research,2004,339(2): 327-334.DOI:10.1016/j.carres.2003.10.006.
[25] WU Y,LI S,LI H,et al.Effect of a polysaccharide from Poria cocos on humoral response in mice immunized by H1N1 influenza and HBsAg vaccines[J].International Journal of Biological Macromolecules,2016,91: 248-257.DOI:10.1016/j.ijbiomac.2016.05.046.
[26] CHENG Y,XIE Y,GE J C,et al.Structural characterization and hepatoprotective activity of a galactoglucan from Poria cocos[J].Carbohydrate Polymers,2021,263(2): 117979.DOI:10.1016/j.carbpol.2021.117979.
[27] LI C Y,LIU L,ZHAO Y W,et al.Inhibition of calcium oxalate formation and antioxidant activity of carboxymethylated Poria cocos polysaccharides[J].Oxidative Medicine and Cellular Longevity,2021,2021: 6653593.DOI:10.1155/2021/6653593.
[28] GUO Y,LI Y,LI Z,et al.Extraction assisted by far infrared radiation and hot air circulation with deep eutectic solvent for bioactive polysaccharides from Poria cocos (Schw.) Wolf[J].Green Chemistry,2021,23(18): 7170-7192.DOI:10.1039/D1GC01773J.
[29] WANG Nani,ZHANG Yang,WANG Xuping,et al.Antioxidant property of water-soluble polysaccharides from Poria cocos Wolf using different extraction methods[J].International Journal of Biological Macromolecules,2016,83: 103-110.DOI:10.1016/j.ijbiomac.2015.11.032.
[30] ZHANG M,CHIU L,CHEUNG P,et al.Growth-inhibitory effects of a β-glucan from the mycelium of Poria cocos on human breast carcinoma MCF-7 cells: cell-cycle arrest and apoptosis induction[J].Oncology Reports,2006,15: 637-643.DOI:10.3892/or.15.3.637.
[31] ZHANG W X,CHEN L,LI P,et al.Antidepressant and immunosuppressive activities of two polysaccharides from Poria cocos(Schw.) Wolf.[J].International Journal of Biological Macromolecules,2018,120: 1345-2604.DOI:10.1016/j.ijbiomac.2018.09.171.
[32] YI L T,ZHANG L,DING A W,et al.Orthogonal array design for antidepressant compatibility of polysaccharides from Banxia-Houpu decoction,a traditional Chinese herb prescription in the mouse models of depression[J].Archives of Pharmacal Research,2009,32(10):1417-1423.DOI:10.1007/s12272-009-2011-6.
[33] LIU J,LIU L,ZHANG G,et al.Poria cocos polysaccharides attenuate chronic nonbacterial prostatitis by targeting the gut microbiota: comparative study of Poria cocos polysaccharides and finasteride in treating chronic prostatitis[J].International Journal of Biological Macromolecules,2021,189: 346-355.DOI:10.1016/j.ijbiomac.2021.08.139.
[34] LIN T Y,LU M K,CHANG C C.Structural identification of a fucosecontaining 1,3-β-mannoglucan from Poria cocos and its anti-lung cancer CL1-5 cells migration via inhibition of TGFβR-mediated signaling[J].International Journal of Biological Macromolecules,2020,157: 311-318.DOI:10.1016/j.ijbiomac.2020.04.014.
[35] SUN S S,WANG K,KE M A,et al.An insoluble polysaccharide from the sclerotium of Poria cocos improves hyperglycemia,hyperlipidemia and hepatic steatosis in ob/ob mice via modulation of gut microbiota[J].Chinese Journal of Natural Medicines,2019,1(3):3-14.DOI:10.3724/SP.J.1009.2019.00003.
[36] BIAN C,XIE N,CHEN F.Preparation of bioactive water-soluble pachyman hydrolyzed from sclerotial polysaccharides of Poria cocos by hydrolase[J].Polymer Journal,2010,42(3): 256-260.DOI:10.1038/pj.2009.329.
[37] ZOU Y T,ZHOU J,WU C Y,et al.Protective effects of Poria cocos and its components against cisplatin-induced intestinal injury[J].Journal of Ethnopharmacology,2021,269(4): 113722.DOI:10.1016/j.jep.2020.113722.
[38] HUANG J Y,HSU N Y,LU K H,et al.Poria cocos water extract ameliorates the behavioral deficits induced by unpredictable chronic mild stress in rats by down-regulating inflammation[J].Journal of Ethnopharmacology,2020,258: 112566.DOI:10.1016/j.jep.2020.112566.
[39] CHEN X,XU X,ZHANG L,et al.Chain conformation and antitumor activities of phosphorylated (1→3)-β-D-glucan from Poria cocos[J].Carbohydrate Polymers,2009,78(3): 581-587.DOI:10.1016/j.carbpol.2009.05.019.
[40] CHEN X,ZHANG L,CHEUNG P.Immunopotentiation and antitumor activity of carboxymethylated-sulfated β-(1→3)-D-glucan from Poria cocos[J].International Immunopharmacology,2010,10(4): 398-405.DOI:10.1016/j.intimp.2010.01.002.
[41] WANG J Y,BIE M,ZHOU W,et al.Interaction between carboxymethyl pachyman and lotus seedpod oligomeric procyanidins with superior synergistic antibacterial activity[J],Carbohydrate Polymers,2019,212: 11-20.DOI:10.1016/j.carbpol.2019.02.030.
[42] WANG Y,YU Y,MAO J.Carboxymethylated β-glucan derived from Poria cocos with biological activities[J].Journal of Agricultural and Food Chemistry,2009,57(22): 10913-10915.DOI:10.1021/jf902589m.
[43] 冯燕茹.不同分子质量羧甲基茯苓多糖的制备及其抗氧化活性的研究[D].广州: 华南理工大学,2019: 29-43.
[44] WANG Yongjia,MO Qing,LI Zengnan,et al.Effects of degree of carboxymethylation on physicochemical and biological properties of pachyman[J].International Journal of Biological Macromolecules,2012,51(5): 1052-1056.DOI:10.1016/j.ijbiomac.2012.08.022.
[45] LIU X F,WANG X Q,XU X F,et al.Purification,antitumor and anti-inflammation activities of an alkali-soluble and carboxymethyl polysaccharide CMP33 from Poria cocos[J].International Journal of Biological Macromol,2019,127: 39-47.DOI:10.1016/j.ijbiomac.2019.01.029.
[46] 杨岚.羧甲基茯苓多糖对AV3和HeLa细胞抑制活性研究[D].长沙:湖南农业大学,2019: 17-18.
[47] LI X,HE Y,ZENG P,et al.Molecular basis for Poria cocos mushroom polysaccharide used as an antitumour drug in China[J].Progress in Molecular Biology and Translational Science,2019,163:263-296.DOI:10.1111/jcmm.13564.
[48] 金山久範,足立典彦,深井芳和,等.ブクリョウ菌糸体の抗腫瘍性多糖に関する研究(第2報)抗腫瘍性多糖H11の構造解析[J].薬学雑誌,1986,106(3): 206-211.DOI:10.1248/YAKUSHI1947.106.3_206.
[49] 纪芳,李鹏飞,徐胜元,等.羧甲基茯苓多糖的制备及体内抗肿瘤作用的实验研究[J].中国微生态学杂志,2003,15(6): 22-23.DOI:10.3969/j.issn.1005-376X.2003.06.009.
[50] 杨江苏,秦旭平,张娜,等.两种真菌多糖对HL-60细胞酪氨酸蛋白磷酸化作用的影响[J].中国药学杂志,2000,35(5): 17-19.
[51] 熊芳琪.羧甲基茯苓多糖对HepG2细胞的抑制及凋亡作用的研究[D].长沙: 湖南农业大学,2017: 8-31.
[52] 刘林夕,杜雨蒙,褚雨.茯苓多糖对高糖诱导乳腺癌MCF-7细胞增殖、凋亡及JAK1/STAT3通路影响[J].中国药师,2021,24(6):1085-1090.
[53] 唐恩红.茯苓多糖对人宫颈癌HeLa细胞增殖、迁移、促凋亡的影响及其机制[D].锦州: 锦州医科大学,2019: 10-21.
[54] 胡康,罗清,朱晓峰,等.茯苓多糖对人乳腺癌MDA-MB-231细胞迁移的影响及机制[J].中国老年学杂志,2019,39(21): 5316-5319.DOI:10.3969/j.issn.1005-9202.2019.21.054.
[55] WANG C,YANG S,GAO L,et al.Carboxymethyl pachyman (CMP)reduces intestinal mucositis and regulates the intestinal microflora in 5-fluorouracil-treated CT26 tumour-bearing mice[J].Food &Function,2018,9: 2695-2704.DOI:10.1039/C7FO01886J.
[56] 廖海锋,邓向亮,罗霞,等.羧甲基茯苓多糖对巨噬细胞极化的影响[J].中国实验方剂学杂志,2016,22(13): 122-126.DOI:10.13422/j.cnki.syfjx.2016130122.
[57] LEE K Y,YOU H J,JEONG H G,et al.Polysaccharide isolated from Poria cocos sclerotium induces NF-κB/Rel activation and iNOS expression through the activation of p38 kinase in murine macrophages[J].International Immunopharmacology,2004,4(8):1029-1038.DOI:10.1016/j.intimp.2004.03.014.
[58] PU Y,LIU Z,TIAN H,et al.The immunomodulatory effect of Poria cocos polysaccharides is mediated by the Ca2+/PKC/p38/NF-κB signaling pathway in macrophages[J].International Immunopharmacol,2019,72: 252-257.DOI:10.1016/j.intimp.2019.04.017.
[59] TIAN H,LIU Z,PU Y,et al.Immunomodulatory effects exerted by Poria cocos polysaccharides via TLR4/TRAF6/NF-κB signaling in vitro and in vivo[J].Biomed Pharmacother,2019,112: 108709.DOI:10.1016/j.biopha.2019.108709.
[60] 刘星汶,徐晓飞,刘玮,等.茯苓多糖的提取、结构、活性和作用机理研究进展[J].食品研究与开发,2021,42(8): 172-178.DOI:10.12161/j.issn.1005-6521.2021.08.028
[61] LIU Kun,YIN Ying,ZHANG Jun,et al.Polysaccharide PCP-I isolated from Poria cocos enhances the immunogenicity and protection of an anthrax protective antigen-based vaccine[J].Human Vaccine Immunother,2020,16(7): 1699-1707.DOI:10.1080/21645515.2019.1675457.
[62] ZHANG Weijiao,CHENG Nan,WANG Yuxia,et al.Adjuvant activity of PCP-II,a polysaccharide from Poria cocos,on a whole killed rabies vaccine[J].Virus Research,2019,270: 197638.DOI:10.1016/j.virusres.2019.06.001.
[63] 王静静.不同铁源对哺乳仔猪铁代谢、肠粘膜免疫及回肠菌群结构的影响[D].武汉: 华中农业大学,2020: 20-35.
[64] 张越.茯苓多糖提取纯化及对脾虚大鼠免疫功能和肠道菌群调节作用研究[D].合肥: 安徽中医药大学,2020: 33-64.
[65] 侯安继,彭施萍,项荣.茯苓多糖抗炎作用研究[J].中药药理与临床,2003,19(3): 15-16.DOI:10.3969/j.issn.1001-859X.2003.03.009.
[66] HATTORI T,HAYASHI K,NAGAO T,et al.Studies on antinephritic effects of plant components: effect of pachyman,a main component of Poria cocos Wolf on original-type anti-GBM nephritis in rats and its mechanisms[J].Japanese Journal of Pharmacology,1992,59(1): 89-96.DOI:10.1254/jjp.59.89.
[67] 梁桐尔,刘杨洋,王烜.基于IL-33/ST2信号通路的茯苓多糖调控溃疡性结肠炎大鼠肥大细胞活化的机制研究[J].中国免疫学杂志,2020,36(11): 1324-1329;1337.DOI:10.3969/j.issn.1000-484X.2020.11.009.
[68] LIU Xiaofei,YU Xiuting,XU Xiaofeng,et al.The protective effects of Poria cocos-derived polysaccharide CMP33 against IBD in mice and its molecular mechanism[J].Food &Function,2018,9(11): 5936-5949.DOI:10.1039/c8fo01604f.
[69] 张金卫.羧甲基茯苓多糖预防TNF-α损伤人结肠上皮Caco-2细胞作用机制研究[D].广州: 广州中医药大学,2016: 59-66.
[70] 石振国,苏锦,任永乐,等.茯苓多糖对急性胰腺炎大鼠肠道屏障功能损伤和炎性反应的作用[J].海南医学,2017,28(3): 356-359.DOI:10.3969/j.issn.1003-6350.2017.03.004.
[71] NG S C,TANG W,CHING J Y,et al.Incidence and phenotype of inflammatory bowel disease based on results from the Asia-Pacific Crohn’s and colitis epidemiology study[J].Gastroenterology,2013,145(1): 158-165.DOI:10.1053/j.gastro.2013.04.007.
[72] ZHAO J,NIU X,YU J,et al.Poria cocos polysaccharides attenuated ox-LDL-induced inflammation and oxidative stress via ERK activated Nrf2/HO-1 signaling pathway and inhibited foam cell formation in VSMCs[J].International Immunopharmacol,2020,80: 106173.DOI:10.1016/j.intimp.2019.106173.
[73] LI W,ZHAO J,YAO Q,et al.Polysaccharides from Poria cocos (PCP)inhibits ox-LDL-induced vascular smooth muscle cells proliferation and migration by suppressing TLR4/NF-κB p65 signaling pathway[J].Journal of Functional Foods,2019,60(1): 103391.DOI:10.1016/j.jff.2019.05.047.
[74] 张晓颖,俞晓玲,叶寒辉.金线莲保肝作用及机制研究进展[J].中国现代中药,2022,24(5): 920-925.DOI:10.13313/j.issn.1673-4890.20210223004.
[75] 刘淼,吴玉冰.药食同源植物茯苓的研究现状与展望[J].湖南中医药大学学报,2018,38(12): 1476-1480.DOI:10.3969/j.issn.1674-070X.2018.12.028.
[76] 刘成,杨宗国,陆云飞,等.茯苓多糖退黄疸作用的实验研究[J].中国实验方剂学杂志,2012,18(10): 195-198.DOI:10.3969/j.issn.1005-9903.2012.10.054.
[77] 王灿红,何晓山,张丽静,等.羧甲基茯苓多糖对氟尿嘧啶肝损伤小鼠减毒及肝脏保护作用[J].现代食品科技,2016,32(9): 28-34.DOI:10.13982/j.mfst.1673-9078.2016.9.005.
[78] WU K,FAN J,HUANG X,et al.Hepatoprotective effects exerted by Poria cocos polysaccharides against acetaminophen-induced liver injury in mice[J].International Journal of Biological Macromolecules,2018,114: 137-142.DOI:10.1016/j.ijbiomac.2018.03.107.
[79] SUN S,WANG K,SUN L,et al.Therapeutic manipulation of gut microbiota by polysaccharides of Wolfiporia cocos reveals the contribution of the gut fungi-induced PGE2 to alcoholic hepatic steatosis[J].Gut Microbes,2020,12(1): 1830693.DOI:10.1080/19490976.2020.1830693.
[80] LIU X J,ZHENG X Y,DU G H,et al.Brain metabonomics study of the antidepressant-like effect of Xiaoyaosan on the CUMS-depression rats by 1H NMR analysis[J],Journal of Ethnopharmacology,2019,235: 141-154.DOI:10.1016/j.jep.2019.01.018.
[81] LÜ M,WANG Y,QU P,et al.A combination of cecum microbiome and metabolome in CUMS depressed rats reveals the antidepressant mechanism of traditional Chinese medicines: a case study of Xiaoyaosan[J].Journal of Ethnopharmacology,2021,276: 114167.DOI:10.1016/j.jep.2019.01.018.
[82] 赵天国.茯苓多糖对小鼠镇静、催眠作用的研究[J].畜牧与饲料科学,2017,38(4): 73-74.DOI:10.3969/j.issn.1672-5190.2017.04.025.
[83] 陈可琢,陈实,任洁贻,等.茯苓酸性多糖抗抑郁作用及其调节神经递质和NLRP3通路机制研究[J].中国中药杂志,2021,46(19): 5088-5095.DOI:10.19540/j.cnki.cjcmm.20210610.705.
[84] 汤娟,张倩,丁伯平,等.硫酸茯苓多糖对抑郁症大鼠海马AMPA受体表达的影响[J].中国药理学与毒理学杂志,2019,33(6): 449.DOI:10.16128/j.cnki.1005-3611.2019.06.003.
[85] 李慧君,王天合,尤朋涛,等.茯苓利下焦水湿有效物质部位的筛选及其作用机制研究[J].中国医院药学杂志,2022,42(5): 519-524.DOI:10.13286/j.1001-5213.2022.05.10.
[86] 邓耒娇,闫洁熙,王沛,等.茯苓多糖对高尿酸血症大鼠肾小管转运体rURAT1、rOAT1和rOCT2表达的影响[J].西部中医药,2019,32(6): 10-14.DOI:10.3969/j.issn.1004-6852.2019.06.004.
[87] 别蒙,谢笔钧,孙智达.不同取代度水溶性羧甲基茯苓多糖的制备、结构表征及体外抑菌活性[J].食品科学,2020,41(12): 67-76.DOI:10.7506/spkx1002-6630-20190603-015.
[88] 颜邦干.香菇多糖的分离纯化及其分子结构改性的研究[D].杭州:浙江大学,2006: 1-5.
[89] HAMURO J,CHIHARA G.Mechanisms of action of antitumor polysaccharide effects of antilymphocyte serum on the antitumor activity of lentinan[J].International Journal of Cancer,1971,8(1): 41-46.DOI:10.1002/ijc.2910080106.
[90] 肖颖,吴梦琪,张文清,等.茯苓多糖HPLC指纹图谱与免疫活性的相关分析[J].华东理工大学学报(自然科学版),2020,46(5): 672-679.DOI:10.14135/j.cnki.1006-3080.20190629003.
[91] CHAKKA V P,ZHOU T.Carboxymethylation of polysaccharides:synthesis and bioactivities[J].International Journal of Biological Macromolecules,2020,165: 2425-2431.DOI:10.1016/j.ijbiomac.2020.10.178.
[92] 周际松,汪芷玥,汤凯,等.羧甲基化茯苓多糖的抗氧化性分析[J].中国食品添加剂,2020,31(7): 120-125.DOI:10.19804/j.issn1006-2513.2020.07.018.
[93] 杨焕治,刘欣,杨岚,等.不同构型羧甲基茯苓多糖(CMP)抗氧化活性研究[J].湖南师范大学自然科学学报,2018,41(5): 29-33.DOI:10.7612/j.issn.2096-5281.2018.05.005.