提高益生菌耐加工贮藏稳定性和体内存活率的递送系统研究进展
朱 荻1,陈莎男1,梅晓宏1,岳 庆1,常茹欣1,李 星1,刘 斌1,张华磊2,韩小龙2,李 媛1,*
(1.中国农业大学食品科学与营养工程学院,食品胶体与营养递送研究中心,北京 100083;2.山东中科嘉亿生物工程有限公司,山东 潍坊 262500)
摘 要:益生菌对人体健康发挥诸多积极作用,但由于益生菌在加工贮藏和消化过程中会发生活性损失,直接口服益生菌很难达到预期的益生效果。递送载体是一种能够提高益生菌加工贮藏稳定性、胃酸胆盐耐受性以及肠道黏附定植能力的有效方法。本综述关注益生菌口服递送的最新研究进展,总结了益生菌制剂中常用的益生菌种类及其功能特性;分析了湿度、温度、pH值、氧气等体外环境及口腔、胃、小肠等体内环境对益生菌存活率的影响;比较了微胶囊、水凝胶、油凝胶、纳米涂层、乳液、纳米纤维等不同递送载体的特点和应用情况;并对未来益生菌递送系统在降低成本、智能封装、共封装和人群实验中的应用做出展望,以期为开发贮藏稳定性高、肠道靶向递送和高活性的益生菌制剂提供技术支持。
关键词:益生菌;封装;递送系统;微胶囊;活菌数;肠道定植
收稿日期:2023-06-09
基金项目:国家自然科学基金面上项目(32172345)
第一作者简介:朱荻(2000—)(ORCID: 0009-0007-4722-7092),女,硕士研究生,研究方向为食品胶体功能化与活性因子递送。E-mail: zhudi618@163.com
*通信作者简介:李媛(1982—)(ORCID: 0000-0002-3245-3210),女,教授,博士,研究方向为食品胶体功能化与活性因子递送。E-mail: yuanli@cau.edu.cn
Advances in the Delivery Systems for Improving the Processing Stability, Storage Stability and in Vivo Survival Rate of Probiotics
ZHU Di1, CHEN Shanan1, MEI Xiaohong1, YUE Qing1, CHANG Ruxin1, LI Xing1, LIU Bin1, ZHANG Hualei2, HAN Xiaolong2, LI Yuan1,*
(1. Food Colloids and Nutrients Delivery Research Center, College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China; 2. Shandong Zhongke-Jiayi Bioengineering Co., Ltd., Weifang 262500, China)
Abstract: Probiotics offer numerous health benefits for human beings. However, it is difficult to achieve the expected beneficial effects of oral probiotics due to the viability loss during processing, storage and digestion. Oral delivery systems are effective ways to improve the processing and storage stability, gastric acid and bile salt tolerance, and intestinal adhesion and colonization ability of probiotics. This review focuses on the state of the art of oral delivery of probiotics, and summarizes the types of probiotics commonly used in probiotic products and their functional characteristics. Specifically, this review analyzes the effects of external environmental factors such as humidity, temperature, pH and oxygen, and internal environments such as the mouth, stomach,and small intestine on the survival rate of probiotics. Furthermore, the characteristics and applications of different oral delivery systems including microcapsule, hydrogel, oleogel, nanocoating, emulsion, and nanofiber are compared. Finally,this review proposes future prospects for cost reduction, intelligent packaging, co-packaging and population experiments of probiotic delivery systems, with the aim of providing technical support for the development of probiotic formulations with high storage stability and high viability suitable for intestinal targeted delivery.
Keywords: probiotics; encapsulation; delivery system; microcapsule; viable count; intestinal colonization
DOI:10.7506/spkx1002-6630-20230609-079
中图分类号:TS201.3
文献标志码:A
文章编号:1002-6630(2023)21-0001-13
引文格式:
朱荻, 陈莎男, 梅晓宏, 等. 提高益生菌耐加工贮藏稳定性和体内存活率的递送系统研究进展[J]. 食品科学, 2023,44(21): 1-13. DOI:10.7506/spkx1002-6630-20230609-079. http://www.spkx.net.cn
ZHU Di, CHEN Shanan, MEI Xiaohong, et al. Advances in the delivery systems for improving the processing stability,storage stability and in vivo survival rate of probiotics[J]. Food Science, 2023, 44(21): 1-13. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20230609-079. http://www.spkx.net.cn
世界卫生组织(World Health Organization,WHO)对益生菌的定义是“通过定植在宿主肠道内,调节宿主肠道菌群平衡或黏膜免疫并赋予宿主健康益处的一类活的微生物”[1]。研究报道益生菌具有缓解便秘、改善腹泻、缓解结肠炎、调控糖脂代谢等生理功能[2-5]。然而,体外加工和贮藏过程中的温度、湿度和氧气都会影响益生菌活性,降低其存活率。并且益生菌在口服后会受到消化道胃酸和胆盐的胁迫导致存活率降低,研究表明胃酸中H+会引起益生菌的表面膜电位变化,使益生菌表面通透性改变,从而导致其死亡[6]。并且,益生菌在肠道的黏附定植对其存活率和发挥健康功效也至关重要。益生菌作为外来菌与肠黏液的相互作用通常比较弱,并且宿主肠道内的土著微生物也会与新摄入益生菌发生竞争,从而抵抗外来益生菌的定植,加上消化道蠕动和消化液冲刷,益生菌黏附和定植效果不佳则容易被排出体外,难以发挥益生作用[7-9]。因此,如何最大限度地保持益生菌在贮藏加工过程的体外稳定性和口服后的体内肠道存活率是目前益生菌制剂生产中面临的巨大挑战。
近年来,递送载体在保护益生菌耐加工贮藏稳定性和体内存活率方面具有较大优势,是解决益生菌存活率低的有效策略。载体对益生菌进行包埋,可屏蔽高温、高湿和氧气等不良环境影响,并能够在胃液低pH值环境中形成保护屏障,保护益生菌免受胃酸侵蚀,有效减少益生菌在胃部的损失,增强益生菌活性[10-11];到达肠道后载体通过响应性释放出益生菌;且壁材大分子与黏蛋白之间存在较强相互作用,可以提高益生菌在肠道的黏附和定植能力[12]。常用的益生菌口服递送系统包括微胶囊[13]、微凝胶[14]、纳米载体[15]、乳液[16]、水凝胶[17]和油凝胶[18]等,已被证实能够有效保护益生菌免受外界环境的侵害、促进益生菌肠道靶向递送和黏附定植、进一步提高益生菌的生理活性。益生菌递送技术已经应用于酸奶、奶酪、冰激凌、肉制品和固体饮料等产品中,有效保护了益生菌活性。未来随着益生菌递送系统的发展和完善,将会运用于越来越多的产品中。本文概述了益生菌制剂中常用的益生菌种类及其特点,分析了体内外环境对益生菌活性的影响,重点比较了提高益生菌耐加工贮藏稳定性和体内存活率的递送系统,并总结了其在食品中的应用。
1 益生菌的种类和功能
传统的益生菌是从肠道、母乳和发酵食品中分离出来的。多数益生菌为革兰氏阳性菌,其中乳杆菌属(Lactobacillus spp.)、双歧杆菌属(Bifidobacterium spp.)和芽孢杆菌属(Bacillus spp.)应用最为广泛[19]。
益生菌可以通过竞争抑制减少肠道内致病菌的生长繁殖,从而调节人体免疫功能、改善肠道健康[3]。益生菌作用于人体的机制有以下3 种:1)直接作用于宿主:益生菌的代谢产物和细胞壁成分可以通过免疫反应机制与宿主胃肠道上皮和树突状细胞等相互作用,增强胃肠道黏液屏障功能,从而调节免疫系统,预防或治疗疾病[20];2)对其他微生物产生影响:益生菌能够促进其共生菌的生长,通过空间位阻阻止致病菌的附着,从而调节宿主肠道微生物的稳态;3)与肠道代谢产物作用:益生菌能够与其他微生物分泌的毒素等产物结合,从而消除宿主体内毒素[20-21]。
表1中列出了益生菌制剂中常用的益生菌种类、特征、稳定性及其功能。
表1 益生菌制剂中常用的益生菌种类、特征、稳定性及其功能
Table 1 Types, features, stability and functions of probiotics commonly used in probiotic products

益生菌种类特征稳定性功能参考文献发酵乳杆菌(Lactobacillus fermentum)兼性厌氧或专性厌氧;主要存在于口腔中;能够在肠道定植高耐酸性;较强活性氧(reactive oxygen species,ROS)抵抗能力抗炎、抗氧化、降低胆固醇[3]嗜酸乳杆菌(Lactobacillus acidophilus)兼性厌氧菌;存在于胃肠道和口腔中能够在酸性环境中生存;pH值高于4.0不生长预防结肠癌、改善肠道健康[22]植物乳杆菌(Lactobacillus plantarum)干酪乳杆菌(Lactobacillus casei)厌氧或兼性厌氧菌;可以在胃肠道中生存兼性厌氧菌;存在于口腔、肠道、阴道最适生长温度30~35 ℃;最适pH 6.5左右;对氧敏感预防溃疡性结肠炎、降低胆固醇、免疫调节、调节肠道菌群[2-4]最适生长温度37 ℃;对胃酸和胆盐有一定耐受性;对氧敏感降低胆固醇、缓解乳糖不耐、抗肿瘤[2](Lactobacillus rhamnosus)厌氧菌;可以定植于肠道内对胃酸和胆盐有较强耐受性;温度高于55 ℃几乎不生长;对氧敏感改善肠道健康、治疗腹泻[5]长双歧杆菌(Bifidobacterium longum)鼠李糖乳杆菌厌氧菌;具有较强肠道定植能力;pH值低于4.5和高于8.5、温度低于25 ℃和高于45 ℃几乎不生长;对氧敏感抑制病原体生长、治疗婴儿肠道疾病、调节免疫[23-24]具有较强肠道定植能力具有一定的耐酸性;对氧敏感治疗哮喘、改善肠道健康、缓解结肠炎[25-26]布拉氏酵母菌(Saccharomyces boulardii)婴儿双歧杆菌(Bifidobacterium infantis)厌氧菌;兼性厌氧菌;较强竞争抑制能力对胃酸和胆盐有一定耐受性;最适生长温度37 ℃;对消化酶有耐受性改善肠道健康、治疗腹泻、具有抗致病菌活性[27-28](Bacillus coagulans)兼性厌氧菌对胃酸和胆盐有一定耐受性;无耐药性减轻肌肉损伤、改善肠道健康[29-30]凝结芽孢杆菌
总体而言,益生菌的功能主要是调节免疫、改善肠道健康、改善腹泻、降低胆固醇等,然而这些功能必须在一定的益生菌活性基础上才能实现。我国卫计委明确规定:“活性益生菌保健食品在其保质期内活菌数不得低于106 CFU/mL(CFU/g)”。2022年中国营养保健食品协会发布《益生菌食品活菌率分级规范》,对益生菌产品的益生菌活菌率进行分级,其中只有活菌率大于等于50%才能满足1级标准,说明益生菌活菌率对于益生菌产品至关重要。然而,益生菌的稳定性较差,在经过菌种冷冻保藏、加工、贮藏和体内消化等环节之后,活菌数量会急剧下降,可能难以达到106 CFU/mL(CFU/g),从而难以在人体内发挥预期的有益作用。
2 影响益生菌活性的因素
益生菌在菌种保藏、加工贮藏和口服的过程中,会受到湿度、温度、pH值、氧气、胃酸、胆盐、土著微生物等各种不利条件的影响,导致活菌数量下降,限制益生菌的有益作用[31]。表2列出了影响益生菌活性的体外和体内因素。
表2 影响益生菌活性的因素
Table 2 Factors affecting the viability of probiotics

影响因素影响机制水分活度改变细胞渗透压,益生菌细胞失水或吸水膨胀,影响生长繁殖;相对湿度过高,益生菌粉末吸水性状改变,益生菌新陈代谢增加,消耗有限营养物质,不利于产品贮存温度高温:蛋白质变性、抑制蛋白质的合成、破坏细胞结构;低温:冷冻形成冰晶造成机械损伤,渗透压过高导致细胞损伤pH值H+和OH-含量过多会影响微生物膜表面电位性质,从而影响膜通透性;影响酶活性和酶促反应,从而影响益生菌活性氧气绝大多数肠道定植的微生物都是厌氧或兼性厌氧菌,过高的氧气含量会使益生菌代谢ROS增加,造成细胞损伤湿度体外因素食物组分盐、糖:改变环境渗透压,细胞在高渗环境中失水质壁分离,在低渗环境中吸水膨胀,适当添加糖类可通过羟基与水的反应稳定细胞膜脂质和蛋白质;益生元:例如菊粉,为益生菌提供营养物质,促进益生菌生长,部分益生元可以抵抗、分解病原体和毒素,保护益生菌不受侵害;其他:其他食品组分可伴随益生菌一同进入胃部,稀释胃液,保护益生菌免受极端pH值侵害胃酸中的H+会导致益生菌膜Zeta电位改变,进而改变细胞膜通透性,导致细胞死亡;高酸性环境导致益生菌三磷酸腺苷(adenosine triphosphate,ATP)合成酶活性降低,使益生菌合成ATP的能力下降消化酶蛋白酶将蛋白质分解为小肽和氨基酸;脂肪酶将细胞膜磷脂分解为脂肪酸;淀粉酶将碳水化合物分解为单糖,破坏益生菌细胞结构胆盐胆盐由于其表面活性剂的特性,会破坏细胞膜的磷脂双分子层,导致细胞膜完整性下降土著微生物与益生菌竞争定植位点和营养物质;分泌毒性物质降低益生菌活性胃酸体内因素
2.1 菌种冷冻保藏过程对益生菌存活率的影响
菌种保藏是制备益生菌产品的基础,冷冻保藏和冷冻干燥保藏是最常用的菌种保藏方法[32]。冷冻保藏是将微生物存放在-80 ℃或-196 ℃的冷库中长期贮藏的方法[33],常加入甘油作为细菌冷冻保藏的保护剂,延缓益生菌冷冻过程中的渗透性收缩[34]。冷冻干燥保藏的益生菌具有良好的贮藏稳定性,但如果操作工艺不当,活菌数会大幅度下降。这是因为过低的温度会导致细胞内形成冰晶,破坏微生物的细胞结构,同时形成冰晶后益生菌内部溶质浓度升高,渗透压升高,使益生菌受损[35]。例如,副干酪乳杆菌和长双歧杆菌发酵剂菌株在冷冻保藏过程中活菌数下降了4(lg(CFU/g)),一定程度上影响了后续干酪制品的制备[36]。为最大限度保持菌种活性,常在冷冻过程中添加麦芽糊精、菊粉、脱脂牛乳等冷冻保护剂[37]。在嗜酸乳杆菌和干酪乳杆菌冻干过程中添加低聚果糖保护剂可有效缓解菌种活力的降低(活菌数仅下降约1.00(lg(CFU/g)),而未添加保护剂的益生菌冻干后活菌数分别下降2.03(lg(CFU/g))和1.63(lg(CFU/g))[38]。
2.2 加工和贮藏过程中环境因素对益生菌存活率的影响
益生菌在加工贮藏过程中会受到湿度、温度、pH值、氧气、食物组分等因素的影响,导致活性降低。
2.2.1 湿度
相对湿度(relative humidity,RH)和水分活度会影响益生菌的存活率。较高水分活度有利于益生菌存活与生长繁殖,而对于加工而成的益生菌粉末产品,相对湿度越低越有利于其长期保存。相对湿度越大,益生菌粉末越易吸潮,粉末黏度降低,流动性增加,更易导致乳糖结晶、美拉德反应和结块等现象的发生[39],使产品性状发生改变。同时,相对湿度越高,益生菌水分吸收量相应增加,导致新陈代谢重新被激活,分解消耗营养物质[40];脂肪被分解,微胶囊壁材结构被破坏,氧气扩散进入微胶囊,加速益生菌死亡,从而降低贮藏稳定性[41]。在海藻酸钠和低聚半乳糖中包封罗伊氏乳杆菌,并采用喷雾干燥生产益生菌粉末,在不同水分活度下贮藏,60 d内罗伊氏乳杆菌活性均下降,在较低水分活度(0.11)下,活性损失较低(活菌数下降1.78(lg(CFU/g))),而随着水分活度增加,益生菌活性逐步下降,在较高水分活度(0.52)下活菌数下降6.24(lg(CFU/g))[42]。因此,益生菌粉长期贮藏期间水分活度应低于0.25[43]。
2.2.2 温度
高温对益生菌活性的影响极为显著。低于45 ℃的加工温度通常对益生菌无害,而超过65 ℃的高温会使蛋白质发生不可逆变性,从而降低益生菌的活性[44-45]。喷雾干燥过程中的高温会对益生菌活性造成破坏,冷冻干燥后鱼明胶和麦芽糊精微胶囊化的鼠李糖乳杆菌的存活率高达81%,而喷雾干燥后的存活率仅为10%[5]。但过低的温度也会对益生菌的活性造成影响,当环境温度骤降时,益生菌细胞膜的流动性会降低、DNA超螺旋水平发生变化,会影响DNA的复制、转录以及蛋白质的形成,形成的冰晶也会对细胞造成机械损伤[45],使益生菌生长缓慢。例如,含有植物乳杆菌的酸奶在-49 ℃下冷冻干燥24 h,冻干后植物乳杆菌存活率下降了33%[46];粪肠球菌去离子水菌液在-40~-30 ℃下冷冻干燥24 h,冻干后粪肠球菌存活率下降了85%~90%[47]。不同类型的益生菌产品在不同贮藏温度下存活率也存在差异。例如,采用嗜酸乳杆菌和发酵乳杆菌生产的葡萄汁在4 ℃下冷藏21 d后仍具有较好的益生菌活性(均超过7(lg(CFU/mL))[48],而益生菌冻干粉在室温下可以贮藏更长的时间(60 d仍保持7(lg(CFU/g)))[49]。
2.2.3 pH值
加工过程中pH值对益生菌的活性也会产生影响。不同种类益生菌的最适pH值范围不同。例如,嗜酸乳杆菌在pH 3和pH 4下至少可以存活2 h,而在pH 2下细胞数量迅速减少,45 min后几乎完全死亡[50];保加利亚乳杆菌、嗜酸乳杆菌和嗜热链球菌在pH 1.5下孵育2 h后,活菌数均下降了6(lg(CFU/mL))[51]。现有的多数益生菌产品为发酵乳制品,绝大多数呈酸性[44],发酵过程中产品酸碱度的变化会对益生菌的活性产生影响。酸奶发酵是一个典型的例子,采用混合益生菌发酵生产益生菌酸奶的过程中,在43 ℃下,4.5 h内酸奶的pH值从6.2下降至4.6,相应的活菌数略微上升(增加量少于1(lg(CFU/mL))),而随着益生菌持续发酵产酸,酸奶pH值持续下降,3 周内下降至pH 3.7左右,此时嗜热链球菌因酸性过高停止生长,而乳酸杆菌和双歧杆菌仍然生长并产生氨基酸,又会引起pH值升高[52]。
2.2.4 氧气
氧含量也会对益生菌活性产生较大影响。多数益生菌为厌氧微生物或兼性厌氧微生物,因此,过高的氧气含量会导致其活性降低[7]。氧气以两种形式影响益生菌的活性,第一种是细胞毒性,部分益生菌对氧气非常敏感,在接触氧气后会在细胞体内产生ROS,ROS对细胞表面的脂质和蛋白质有很强的氧化作用[53],会导致益生菌直接死亡;第二种是在培养过程中,部分益生菌会吸收氧气,排出ROS,从而抑制自身活性[44]。例如,大于5 mmol/L的过氧化氢和大于10 mmol/L的甲萘醌环境可以强烈抑制植物乳杆菌的生长[54]。
2.2.5 食物组分
食物组分是影响益生菌以活体形式到达肠道的重要因素之一。食品中的糖和盐改变了益生菌生长环境的渗透压,在高渗环境中细胞失水,益生菌收缩导致质壁分离,细胞生长受到抑制甚至死亡;在等渗环境中益生菌可以正常生长繁殖;在低渗环境中,益生菌吸水膨胀,甚至破裂死亡。但在食品组分中适当添加糖类对于保护各种益生菌十分有效,糖类中的羟基可以稳定益生菌的细胞膜脂质和蛋白质[55]。益生元例如菊粉、低聚果糖、低聚半乳糖、乳铁蛋白等也是益生菌口服递送过程中十分重要的食物组分。益生元可以为益生菌提供生长所需的营养物质,刺激益生菌生长,部分益生元还可以抵抗、分解病原体和毒素[56],保护益生菌不受侵害。研究发现低聚半乳糖可以促进鼠李糖乳杆菌的生长[57],阿拉伯木聚糖可以促进短双歧杆菌和罗伊氏乳杆菌的生长[58]。此外,食品中的其他组分可以伴随益生菌一同进入胃部稀释胃液[59],从而保护益生菌免受极端pH值的侵害。
2.3 消化道环境对益生菌存活率的影响
食品从口腔进入人体,经过口腔咀嚼、胃部消化、小肠进一步消化吸收,进入大肠最终变成粪便从肛门排出[12]。上消化道包括口腔、咽、食道、胃和十二指肠[60],益生菌制剂在上消化道中所要克服的障碍主要来自口腔和胃部。下消化道包括空肠、回肠和大肠,益生菌在这里需要与土著微生物竞争有限的资源,并在肠道定植,从而持续稳定地在人体内发挥有益作用。
2.3.1 口腔
口腔条件一般为中性,pH 7.4左右。口腔唾液中含有淀粉酶,负责分解口腔中的物质,同时也可能对益生菌制剂的成分和结构造成一定影响。食物在口腔中混合着淀粉酶和矿物质离子被吞下[61]。相较于胃部,由于口腔条件较为温和,并且食物在口腔中停留时间较短,因此对益生菌活性影响较小。
2.3.2 胃
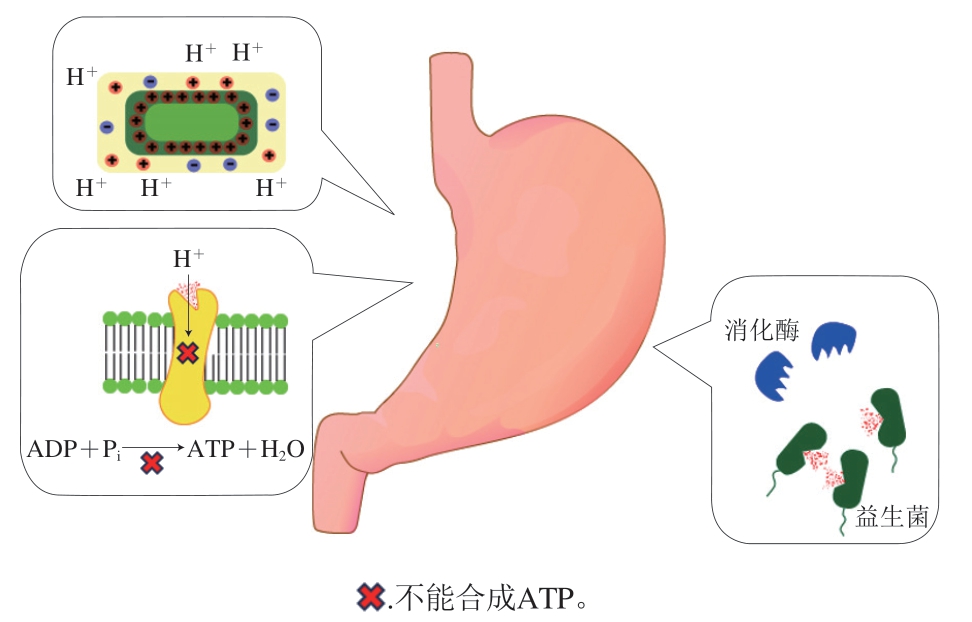
胃部环境非常不利于益生菌生存,这主要是因为胃液中的胃酸和消化酶(图1)。胃酸中的H+会导致益生菌膜Zeta电位改变,进而改变细胞膜的通透性,导致细胞死亡;此外,高酸性环境导致益生菌ATP合成酶活性降低,使益生菌合成ATP的能力下降。胃中的胃蛋白酶和胃脂肪酶将益生菌细胞膜中的蛋白质分解为小肽片段和氨基酸,磷脂分解成脂肪酸,从而破坏细胞膜结构,抑制细胞的物质交换,降低益生菌活性。
空腹时胃酸的pH值为1.5左右,进食期间pH值增加到3.0~5.0,这样的环境非常不利于益生菌生存[62]。胃酸中的H+可能会导致益生菌细胞膜的Zeta电位发生改变,进而改变细胞膜的通透性[6],导致细胞进入胃部之后死亡。此外,高酸性环境还会导致益生菌ATP合成酶的活性降低,使益生菌合成ATP的能力下降[62],从而降低益生菌在胃部的生存能力。鼠李糖乳杆菌在益生菌中具有相对较强的耐酸性,其中ATP合成酶和应激蛋白是其耐酸性的主要影响因素,在酸性条件下鼠李糖乳杆菌的clpC、clpE、atpA和dnaK基因表达上调,一方面导致ATP合成酶mRNA水平增加,质子从细胞质泵入外膜,维持细胞质pH值中性;另一方面应激蛋白表达上调,协助受损蛋白重新折叠[63],使得鼠李糖乳杆菌能够在胃部环境中长期生存。
胃中的消化酶也会对益生菌活性产生影响。胃中的消化酶主要是胃蛋白酶和胃脂肪酶[64],胃蛋白酶可以将益生菌细胞膜中的蛋白质分解为小肽片段和氨基酸,胃脂肪酶可以将益生菌细胞膜中的磷脂分解成脂肪酸,从而破坏细胞膜结构,抑制细胞的物质交换,降低益生菌活性。
2.3.3 小肠
小肠中含有脂肪酶、蛋白酶、淀粉酶等消化酶,以及胆盐、碳酸氢盐等物质,是营养物质消化和吸收的主要部位[65]。与结肠相比,小肠的酸性更强,氧气、抗菌物质含量和离子浓度也更高,因此小肠中的微生物以快速生长的兼性厌氧菌为主,同时食物在小肠中的消化时间更短,所以益生菌在小肠中需要克服的生存障碍主要是消化酶、胆盐和肠黏液[7]。
小肠中的脂肪酶、蛋白酶和淀粉酶会分解益生菌细胞的磷脂、氨基酸肽链和糖原等,破坏益生菌的细胞结构,影响益生菌与外界环境的物质交换,从而影响其生理活动。胆盐由于其表面活性剂的特性,会破坏细胞膜的磷脂双分子层,导致细胞膜完整性下降[53]。除了胆盐对益生菌口服递送的阻碍以外,肠黏液也会影响益生菌的定植。肠黏液会阻挡有害物质,但允许低分子质量的营养物质和药物等有益成分渗透到达小肠上皮,最终被人体吸收[9],所以益生菌需要与肠道上皮细胞和树突状细胞接触,与模式识别受体(pattern recognition receptor,PRR)特异性识别[21],从而完成定植,持续地对人体产生有益的作用。
2.3.4 结肠
结肠是益生菌定植的主要部位。相较于小肠,结肠中氧气含量较低,抗菌物质浓度较低,食物消化速度较慢,有利于厌氧菌的生长[7]。在益生菌到达结肠后,必须与已经定植在结肠中的微生物竞争。土著微生物会通过竞争抑制阻碍外来微生物在肠道内定植,它们会与益生菌竞争定植位点和结肠中的营养物质,或者分泌毒性物质降低益生菌活性。部分摄入的益生菌难以定植,必须长期服用才会有显著的生理效果。但部分益生菌具有显著的抗菌特性,这主要是因为它们可以和土著微生物竞争结肠内有限的营养物质,或者可以分泌出抑制性化合物(如过氧化氢、有机酸等)[66],通过改变结肠内部分区域的pH值和产生ROS,抑制土著微生物的生理活动,从而促进自身肠道定植和生长繁殖。例如,植物乳杆菌可以通过分泌乳酸、过氧化氢、竞争性黏附受体等抑制金黄色葡萄球菌和大肠杆菌定植[67]。
3 提高益生菌存活率的方法
3.1 益生菌菌种筛选
从人体肠道或粪便中分离益生菌菌株是一种简单直接的筛选方法,得到的益生菌也有较高的肠道存活可能性。此外,可以通过体外筛选测定益生菌的稳定性和功能特性[68]。体内实验模型可以有效评估益生菌在肠道中的存活能力和功能特性,但相比之下,体外筛选成本低、耗时短,可以同时测定多种菌株的特性,是获取能在人类胃肠道中生存的益生菌的最常用途径。
益生菌体外筛选的项目主要包括胃酸耐受性、胆盐耐受性和肠道黏附定植能力。常将微生物加入模拟胃液和模拟肠液中,孵育一定时间,模拟胃肠道消化[69],从而评估益生菌的胃肠道生存能力。益生菌胆盐耐受性也可选用胆盐水解酶(bile salt hydrolase,BSH)作为筛选的标准,能否分泌BSH是益生菌自身抵抗胆盐的关键,因为BSH可以水解胆盐,从而提高益生菌的胆盐稳定性[70]。而益生菌的黏附能力可通过使用烃类甲苯[71]等碳氢化合物进行细胞表面疏水性测试,从而探究细菌对胃肠道黏液的黏附性。
3.2 基因工程
可以采用基因组学、转录组学、蛋白质组学、代谢组学、功能基因组学等分析鉴定微生物的基因组结构[72],采用DNA-DNA杂交和编码16S rRNA的DNA测序进行菌株鉴定[73],从而确定菌株的基因序列,有助于后续采用基因工程构建出适合于口服的益生菌。例如,双歧杆菌PRL2010的基因组学、蛋白质组学和转录组学分析结果显示其基因组中含有能够代谢黏蛋白和降解宿主黏蛋白中多糖的转录位点[74],从而提升双歧杆菌PRL2010自身的肠道定植和生存能力。基因工程已经被应用在口服的益生菌生产过程。Danino等[75]开发了一种用于口服递送的基因工程大肠杆菌,改性后的大肠杆菌可以特异性定植肿瘤组织并表达β-半乳糖苷酶产生荧光,从而检测肿瘤。Song Wenfang等[76]采用二苯并环辛炔,通过原位正交偶联改性丁酸梭菌,体内和体外实验证明改性益生菌口服后可以在肠道中高效定植,并治疗肠道炎症。
3.3 益生菌递送系统
将益生菌封装到具有保护和靶向递送作用的载体中[77],能够提高益生菌对外界和消化道内极端环境的耐受性[10]。益生菌封装的两个关键因素是封装壁材和封装方法。
用于封装益生菌的壁材对益生菌产品的稳定性和功能性有很大影响[11],许多食品大分子已被用于封装益生菌,包括多糖(海藻酸盐、果胶、壳聚糖等)、蛋白质(乳清蛋白、酪蛋白等)和脂质体等[78]。这些天然的食品大分子具有生物相容性好、生物可降解、成本低和安全等优点[79]。在选择封装壁材的时候,还需要考虑壁材大分子对益生菌的互作性、能否在肠道中降解为具有促进益生菌生长作用的益生元、能否促进益生菌在肠道的黏附定植、是否会对人体健康产生促进作用。
益生菌的封装方法应足够温和,尽量减少对益生菌活性的破坏。常用的益生菌封装方法包括喷雾干燥、冷冻干燥、乳化和挤出等[78]。其中,喷雾干燥是食品工业中最常用的益生菌封装技术[80]。喷雾干燥可以同时进行雾化、加热和真空干燥,快速形成干燥的粉末颗粒[81],是一种高效经济的生产封装益生菌产品的技术。冷冻干燥也是封装益生菌的常用方法,相较于喷雾干燥,冷冻干燥过程中的加工温度更低,对益生菌的破坏更小。Obradovic等[80]发现乳清溶液、乳清蛋白浓缩物和海藻酸钠经喷雾干燥制成的益生菌粉末颗粒形状更加规则,而通过冷冻干燥制得的益生菌粉末具有更好的封装效率、生物活性和贮藏稳定性。此外,3D打印技术已经被用于生产多种益生菌口服递送载体[82],打印出的载体具有良好的稳定性。
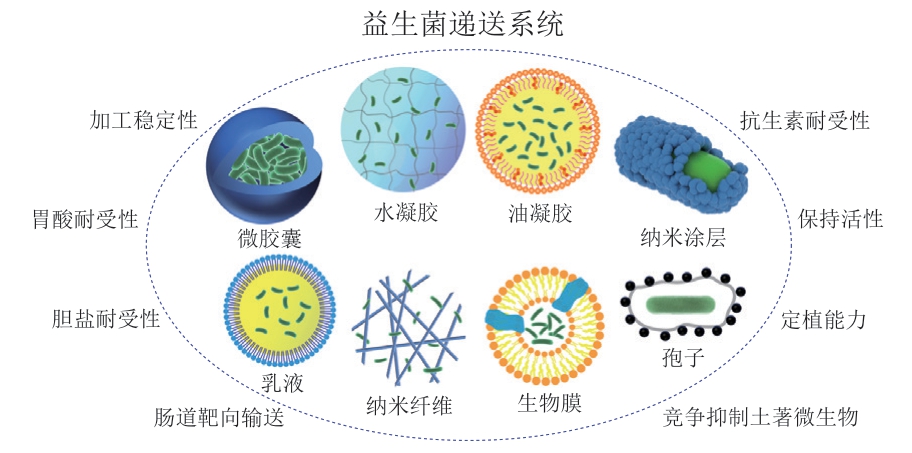
目前用于实现益生菌肠道靶向输送的口服递送系统包括微胶囊、水凝胶、油凝胶、纳米涂层、乳液、纳米纤维、孢子、生物膜等[61](图2)。以下就每种类型进行具体叙述。
3.3.1 微胶囊
微胶囊是由食品大分子通过喷雾干燥法制备的具有核壳结构的保护载体,可以将益生菌和外界环境隔绝,实现益生菌的控制释放[83]等。制备微胶囊的常用壁材包括海藻酸盐、壳聚糖、明胶和果胶等[84]。几乎所有的益生菌微胶囊化技术都包含干燥的过程,常采用喷雾干燥、冷冻干燥、电喷雾、乳化等方法制备益生菌微胶囊[85]。喷雾干燥是一种快速且相对便宜的制备微胶囊的方法,转谷氨酰胺酶可以通过形成二硫键增强蛋白质机械强度,从而在喷雾干燥过程中保护益生菌免受高温损伤[86]。乳清分离蛋白也可以在喷雾干燥过程中起到保护益生菌的作用,研究发现乳清分离蛋白可以与鼠李糖乳杆菌菌毛上的蛋白质特异性结合,在菌体表面形成蛋白质层,提高益生菌耐热性和抗氧化性[87]。
3.3.2 水凝胶
水凝胶是由亲水食品大分子通过物理或化学交联而形成的具有吸水膨胀性的三维网络结构,广泛应用于益生菌/功能因子递送、药物递送、3D细胞培养支架和组织工程等领域。益生菌可以封装在水凝胶微球的内部或接种在微球表面[17]。海藻酸盐是最常用的水凝胶封装材料之一,它可以与Ca2+结合,形成水凝胶交联网络结构[88]。通过海藻酸盐、果胶和明胶的生物复合水凝胶封装植物乳杆菌,可以显著提高植物乳杆菌的胃酸耐受性,孵育6 h后,模拟胃液中的植物乳杆菌存活率比游离植物乳杆菌高26%,并且贮藏4 周后,包埋的益生菌具有更高的氧化稳定性[89]。然而,传统的合成水凝胶在被稀释后机械强度会降低,表现出溶胀弱化的现象,不利于益生菌封装系统的稳定。Wu Feng等[90]开发了一种溶胀强化水凝胶,将脂质体膜纳米屏障共嵌入水凝胶网络结构中,溶胀过程中水凝胶网络结构拉伸,导致脂质体膜纳米屏障变形,封装物质跨膜扩散,形成新的网络,这种双网络结构增强了机械强度。
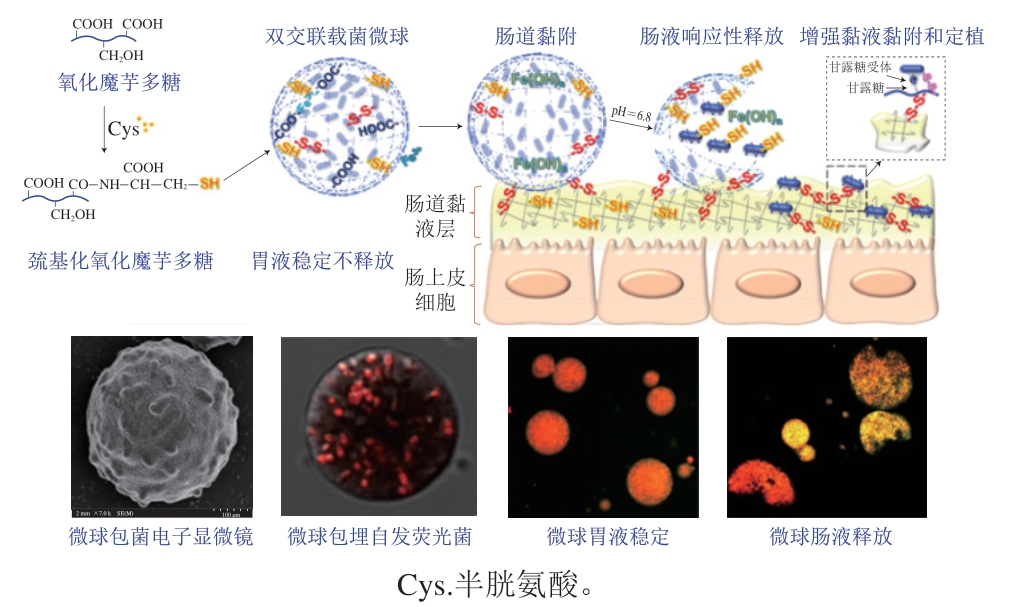
微米尺度的水凝胶称为微凝胶。用于制造微凝胶的材料通常是生物聚合物,例如淀粉、海藻酸盐、角叉菜胶等[61],它们是具有多孔聚合物分子网络的生物聚合物颗粒,多数是全天然无毒材料,可以保护封装的益生菌不受损伤[11]。益生菌(例如双歧杆菌)需要在胃中稳定,在肠道释放,并且需要在肠黏液层定植才能发挥生理作用。肠黏液层是由富含半胱氨酸巯基的糖蛋白构成的疏水凝胶网络。为了同时解决益生菌时空释放和黏附定植的问题,有研究人员使用半胱氨酸修饰氧化魔芋多糖,获得了同时具有巯基和羧基的巯基化氧化魔芋多糖,和铁离子可以形成二硫键—S—S—和—COO—Fe3+—COO—共存的双交联水凝胶(图3),该水凝胶在胃环境中稳定,能够保护益生菌不受胃酸胁迫,在肠pH值下响应性释放益生菌,释放后益生菌表面缠结的巯基化魔芋多糖作为桥梁和富含巯基的黏蛋白发生巯基化交换反应并生成新的二硫键,将益生菌牢固地黏附在黏液层上,有效提高了双歧杆菌的肠道活菌数和菌群丰度,使益生元魔芋多糖和益生菌协同调控肠道菌群平衡,发挥益生作用[91]。
3.3.3 油凝胶
油凝胶是液态油通过添加凝胶剂,自组装为网络结构或液态油结晶,进而形成包含非极性液相的黏弹性三维网络结构材料[92-93]。常用的凝胶剂有甘油单酯、卵磷脂、蜡等[94]。油凝胶具有疏水性和乳化性[95],相较于水凝胶,其物理屏障可以更好地隔离水分[92],提高益生菌存活率。例如,基于大豆卵磷脂的油凝胶可以提高嗜酸乳杆菌和乳酸双歧杆菌的存活率[18]。此外,油凝胶只能被肠道中的脂肪酶消化,实现益生菌的肠道靶向递送[95]。常采用油凝胶与水凝胶结合形成的双凝胶,其同时具有亲脂性和亲水性双重特性,可以进一步提高益生菌的存活率[96]。采用大豆卵磷脂-硬脂酸油凝胶乳液和乳清蛋白水凝胶混合包封嗜酸乳杆菌和乳双歧杆菌,3 周和5 周后在酸奶中的活菌数明显高于游离菌,并且与纯油凝胶相比,混合凝胶中的乳清蛋白可以使乳双歧杆菌的活菌数提高5.2(lg(CFU/mL))[97]。
3.3.4 纳米涂层
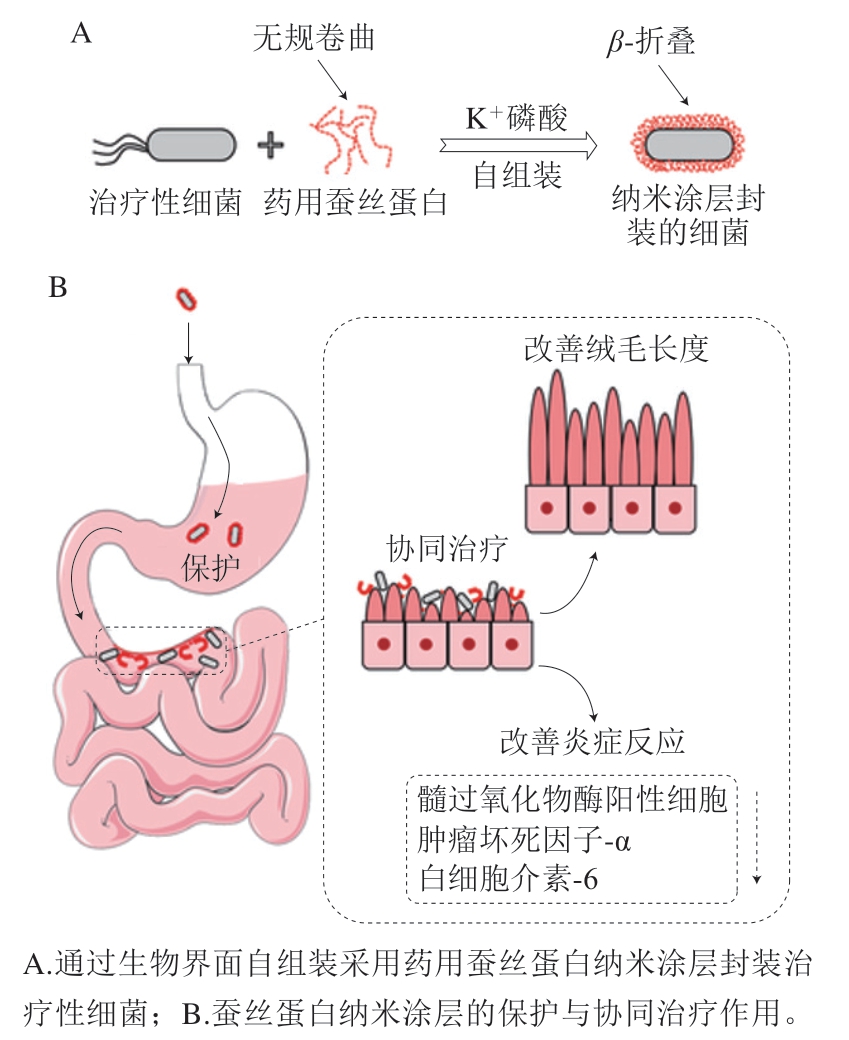
纳米涂层是一种包封单个益生菌的方法,由于其制备简单的特点,已成为益生菌纳米包封领域的焦点[31]。可以通过氢键、π-π堆积、迈克尔加成反应和席夫碱反应形成聚多巴胺纳米涂层,封装单个活细胞,显著提高益生菌的生物利用率(未封装微生物的30 倍以上)[98]。例如有研究人员采用药用蚕丝蛋白自组装在大肠杆菌Nissle 1917(EcN)表面形成纳米涂层[99],通过体外实验证明封装后的EcN在模拟胃液中的存活率提高52 倍,肠道定植能力提高5.8 倍,同时药用蚕丝蛋白天然的抗炎功能进一步提升了EcN的肠炎治疗能力,起到协同治疗的效果(图4)。此外,层层组装技术(layer-by-layer,LbL)是制备多层涂层材料的常用方法,已经被应用于益生菌递送载体[100]。相关学者采用壳聚糖/藻酸盐纳米涂层包封凝结芽孢杆菌,显著提高了益生菌对胃酸和胆盐的耐受性以及对肠黏液黏附能力,黏附性比未封装的益生菌高出1.5 倍[101]。
3.3.5 乳液
目前用于封装益生菌的乳液包括水包油(O/W)乳液[12]、油包水(W/O)乳液、水包水(W/W)乳液[69]和混合型(O/W/O或W/O/W)乳液[102-103]。采用乳液作为口服递送系统操作简单,适于大规模生产;对热稳定,可使益生菌产品保存较长时间[11]。纳米乳液通常是透明的,因为乳液液滴非常小,不会强烈散射光波[12],所以非常适用于生产透明的食品。其中,皮克林乳液的凝胶结构稳定,可以减少益生菌与胃肠道产物(胃酸、胆盐等)的接触,大大提高了益生菌在口服递送中的稳定性[82]。研究表明,在采用乳液封装益生菌的过程中,益生菌可以在高负载力下封装进含果胶的O/W高内相皮克林乳液中,65 ℃、30 min后未封装的乳双歧杆菌几乎全部死亡,而封装的益生菌活菌数为5.31(lg(CFU/mL))[104]。
3.3.6 纳米纤维
纳米纤维具有高比表面积,易通过高压均质、酶水解、超声处理等技术改性[105],非常适于益生菌的口服递送。高压电场静电纺丝技术生产效率高、生产条件温和,可以快速获得直径小、比表面积大、透气率高的纤维材料,适于封装对温度敏感的益生菌,是纳米纤维封装益生菌的常用方法[106]。研究表明,采用静电纺丝技术制备的阿拉伯胶和普鲁兰多糖杂化纳米纤维包封乳酸菌,具有较高封装稳定性,封装后的乳酸杆菌存活率达到85.4%~97.8%,而冷冻干燥后的存活率为80.9%~89.8%,此外采用静电纺丝技术制备的封装乳酸菌具有更好的贮藏稳定性,4 ℃贮藏28 d后,存活率仍在70%以上[107]。
3.3.7 孢子
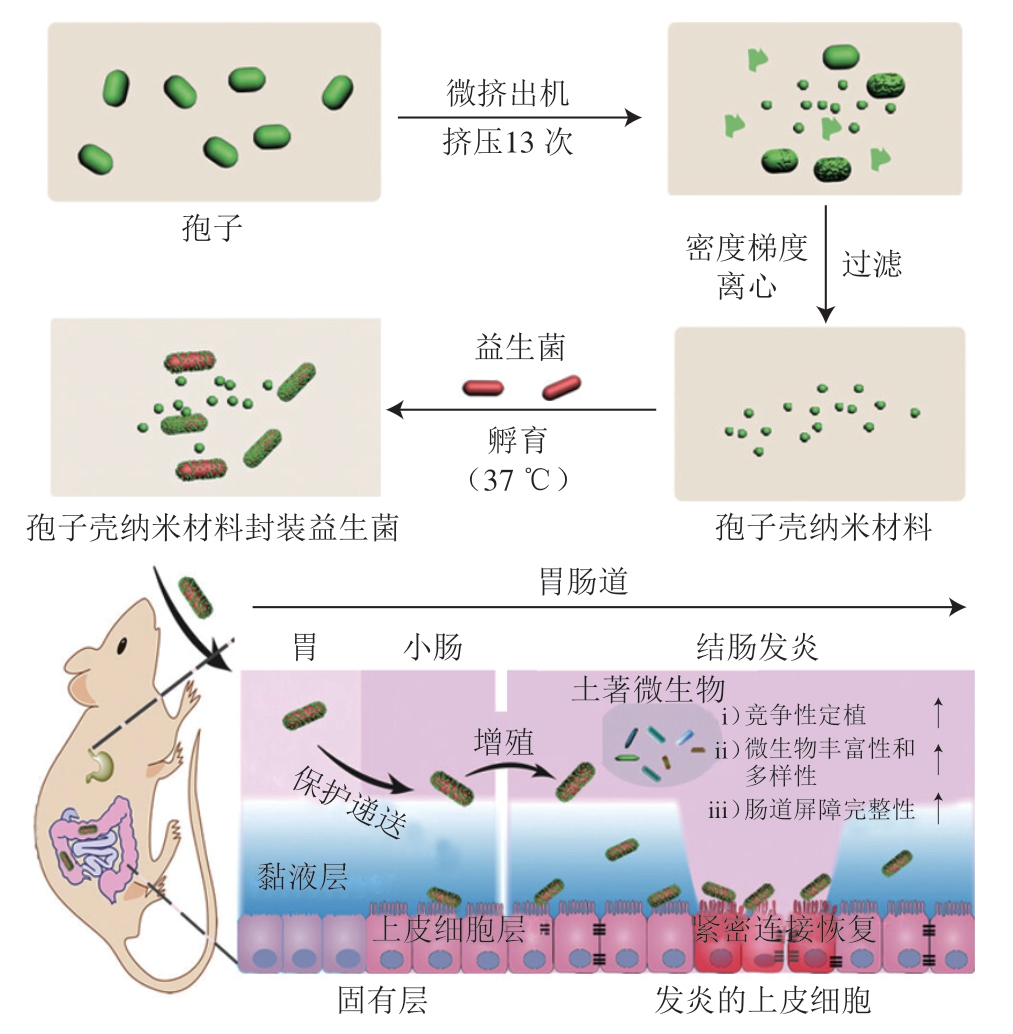
孢子是细菌的休眠形式,具有多层疏水蛋白质外壳[108],可以保护细菌免受胃酸侵害,并且在肠道中发芽释放[109],非常适合于益生菌的口服递送。孢子在益生菌递送中的应用分为两种,一种是将益生菌转化为孢子形式封装,但天然孢子具有难以控制体内发芽效率的缺点[65],目前已经开发出人工孢子:通过β-环糊精和金刚烷介导的主客体相互作用,将葡聚糖包裹在丁酸梭菌孢子外形成人工孢子,该人工孢子在厌氧的肠道环境中会复活,分解葡聚糖并特异性地富集在肿瘤组织周围,产生抗癌短链脂肪酸,抑制肿瘤生长[110]。另一种是提取孢子壳中的有效成分并用其封装益生菌,孢子壳纳米材料具有极强的极端环境(强酸、强碱、模拟胃肠液)耐受性,并且可以降低肠道ROS水平,极大程度抵抗恶劣环境,保护益生菌(图5)[111]。
3.3.8 生物膜
生物膜可以提高益生菌的附着能力,隔绝抗生素等外界环境的侵扰[112]。通过枯草芽孢杆菌分泌的胞外多糖和蛋白质形成固体生物膜封装枯草芽孢杆菌,可显著提高枯草芽孢杆菌的胃肠道耐受性(模拟胃液中孵育0.5 h,存活率仍在70%以上,而未封装的益生菌完全死亡;在胆汁酸中孵育1 h后存活率约为未封装的20 倍)、生物利用度(是未封装益生菌的125 倍)和肠道定植能力(是未封装益生菌的17 倍)[112]。研究报道在磷酸钙缓冲溶液中通过二油酰磷脂酸和胆固醇制备脂质膜封装EcN[113],封装后的EcN显示出极高的强酸、强碱、模拟胃肠液、抗生素和乙醇抗性,胃部存活率比未包封的EcN高出近3 倍。
4 益生菌递送系统在食品中的应用
商业化益生菌递送系统通常采用乳清蛋白、海藻酸钠和低聚果糖等益生元壁材,通过喷雾干燥和冷冻干燥等工艺提高益生菌活菌数,目前已在乳制品、益生菌补充剂、益生菌坚果或水果[103]中实现了应用。常见的益生菌产品如表3所示。
表3 常见的益生菌产品
Table 3 Common probiotic products

注:—.无封装材料。
益生菌产品常用益生菌封装材料参考文献酸奶鼠李糖乳杆菌(Lactobacillus rhamnosus)、保加利亚乳杆菌(Lactobacillus bulgaricus)、嗜热链球菌(Streptococcus thermophilus)乳清、乳蛋白等[114]乳制品奶酪副干酪乳杆菌(Lactobacillus paracasei)、嗜酸乳杆菌(Lactobacillus acidophilus)、双歧杆菌属(Bifidobacterium)海藻酸钠、低聚果糖、菊粉等[36]冰淇淋鼠李糖乳杆菌(Lactobacillus rhamnosus)、植物乳杆菌(Lactobacillus plantarum)、布拉氏酵母菌(Saccharomyces boulardii)酪蛋白、乳清蛋白、麦芽糊精、玉米淀粉等[115]酒酿酒酵母(Saccharomyces cerevisiae)、毕赤酵母属(Pichia)、植物乳杆菌(Lactobacillus plantarum)—[116]发酵饮品发酵茶布拉式酵母菌(Saccharomyces boulardii)、醋酸菌(Acetobacter aceti)、乳酸菌属(Lactobacillus)—[117-118]益生菌补充剂益生菌固体饮料鼠李糖乳杆菌(Lactobacillus rhamnosus)、嗜酸乳杆菌(Lactobacillus acidophilus)、植物乳杆菌(Lactobacillus plantarum)、副干酪乳杆菌(Lacticaseibacillus paracasei)、双歧杆菌属(Bifidobacterium)脱脂乳粉、低聚果糖、麦芽糊精等[49]益生菌滴剂鼠李糖乳杆菌(Lactobacillus rhamnosus)、罗伊氏乳杆菌(Lactobacillus reuteri)、双歧杆菌属(Bifidobacterium)葵花籽油、甘油三酯等[119-120]发酵肉制品发酵香肠乳酸菌属(Lactobacillus)、鼠李糖乳杆菌(Lactobacillus rhamnosus)、副干酪乳杆菌(Lacticaseibacillus paracasei)—[121-122]益生菌坚果[123]其他鼠李糖乳杆菌(Lactobacillus rhamnosus)、嗜酸乳杆菌(Lactobacillus acidophilus)、双歧杆菌属(Bifidobacterium)麦芽糊精、低聚异麦芽糖、酪蛋白酸钠、乳粉、低聚果糖等益生菌水果鼠李糖乳杆菌(Lactobacillus rhamnosus)、植物乳杆菌(Lactobacillus plantarum)、双歧杆菌属(Bifidobacterium)海藻糖、低聚异麦芽糖、低聚果糖等[124-125]
4.1 乳制品
传统的益生菌产品是乳制品,包括酸奶、干酪、乳清基饮料等,目前出现了越来越多采用微胶囊化益生菌生产乳制品的例子。沙棘浆果具有较高的营养价值和抗氧化活性,可以作为益生菌产品的增强底物,Terpou等[114]开发了一种用于强化功能性冷冻酸奶的干酪乳杆菌微胶囊,以乳清为封装材料,将沙棘浆果与干酪乳杆菌共封装,采用干酪乳杆菌微胶囊生产的冷冻酸奶在-18 ℃下贮藏90 d仍能保持较高活性(益生菌存活率超过97%),并通过体外实验证明微胶囊化的干酪乳杆菌在人体胃肠道内具有更好的生存能力。
4.2 益生菌补充剂
目前,市场上最常见的益生菌产品是益生菌补充剂[126],大多采用干燥技术制成粉末状益生菌口服递送产品。Sornsenee等[49]采用脱脂牛奶中的乳清蛋白和香蕉粉封装副干酪乳杆菌,开发了一款具有较高的益生菌存活率和胆盐耐受性的香蕉粉固体饮料。另外,采用多层包埋技术可以进一步提高益生菌的稳定性,贝斯迪、希尔安等品牌采用全脂乳粉、低聚果糖等多种益生元多层包埋复合益生菌,增强了复合益生菌的胃酸和胆盐耐受性,提高了益生菌的活性和定植能力。此外,益生菌滴剂也是较为常见的益生菌补充剂。常采用葵花籽油、甘油三酯等液态油脂制成油膜用于封装益生菌,制成的益生菌滴剂可以隔绝水和空气,使益生菌具有更好的氧化稳定性。例如,拜奥(BioGaia公司旗下品牌)将罗伊氏乳杆菌冻干粉添加进葵花籽油中,制成益生菌滴剂,可以有效隔绝空气和水分,确保益生菌活性。
4.3 其他
益生菌坚果和益生菌水果是添加了封装益生菌的产品,它们是由益生菌补充剂进一步加工而成的食品。通常先采用麦芽糊精、酪蛋白酸钠、乳粉、低聚果糖等封装益生菌,再用活性益生菌粉包裹坚果、水果等制成益生菌坚果和水果,提高坚果和水果的营养附加值。采用益生菌微胶囊粉末涂裹的鲜果通常具有更好的保鲜特性,短时间内可以减少水分损失、色度变化和腐败菌数量[124]。益生菌微胶囊涂层还可以在制备果干的过程中保护水果的品质(色泽、感官)和营养成分(花青素、VC)[125],进一步提高水果制品的营养和品质。
5 结 语
本综述总结了益生菌口服递送过程中的困难与挑战,分析比较了不同益生菌口服递送系统的特点和研究进展,有助于推动未来益生菌口服递送系统的进一步开发和应用。益生菌具有免疫调节、改善胃肠道健康、降低胆固醇等功效,但胃酸、胆盐、消化酶等的胁迫作用使其难以大量活着到达肠道并定植。益生菌递送系统在提高益生菌耐加工贮藏稳定性和体内存活率方面展现出优异的应用潜力。目前报道的常见益生菌递送系统包括微胶囊、水凝胶、油凝胶、纳米涂层、乳液、纳米纤维、孢子、生物膜等,均已证明能够有效提高益生菌的体外和体内存活率。其中一些递送系统已经在乳制品、益生菌补充剂、益生菌坚果等食品中应用。虽然已经开发了多种益生菌封装材料、封装菌种、封装方法和产品,但是益生菌口服递送系统仍然面临着许多挑战:1)成本和产业化路径:多数益生菌口服递送系统的成本高和产业化路径不明确等限制了其应用;2)颗粒大小:需要控制递送系统的颗粒大小,使其在提高存活率的同时不影响产品稳定性和感官品质;3)智能化:未来需要采用智能化封装技术,使益生菌能够靶向肠道递送,提高肠道定植能力,精准作用于人体;4)共封装:需要探究更多种类益生元、益生菌与合生元的共封装,进一步提高益生菌的存活率和功能特性;5)人群实验:现阶段多数益生菌口服递送系统的研究仍然停留在体外实验和动物实验阶段,人体内的微环境是动态变化的,体外实验无法准确预测益生菌菌株在体内的潜在用途和功能,需要进行更多的人群实验来验证递送载体的实际效果。总体而言,益生菌递送系统是一项提高益生菌存活率和健康效应的极具潜力的关键技术,值得学术界和产业界的进一步研究、完善,并共同提高高活性益生菌制剂和产品的国际市场竞争力。
参考文献:
[1]Food and Agriculture Organization. Guidelines for the evaluation of probiotics in food[R]. Canada: WHO, FAO, 2006.
[2]WANG G Q, HUANG W L, XIA Y J, et al. Cholesterol-lowering potentials of Lactobacillus strain overexpression of bile salt hydrolase on high cholesterol diet-induced hypercholesterolemic mice[J]. Food &Function, 2019, 10(3): 1684-1695. DOI:10.1039/c8fo02181c.
[3]KUMAR M K P, HALAMI P M, PEDDHA M S. Effect of Lactobacillus fermentum MCC2760-based probiotic curd on hypercholesterolemic C57BL6 mice[J]. ACS Omega, 2021, 6(11):7701-7710. DOI:10.1021/acsomega.1c00045.
[4]LIU Y, SHENG Y, PAN Q, et al. Identification of the key physiological characteristics of Lactobacillus plantarum strains for ulcerative colitis alleviation[J]. Food & Function, 2020, 11(2): 1279-1291. DOI:10.1039/c9fo02935d.
[5]JIANG N, KUMAR G D, CHEN J, et al. Comparison of concurrent and mixed-flow spray drying on viability, growth kinetics and biofilm formation of Lactobacillus rhamnosus GG microencapsulated with fish gelatin and maltodextrin[J]. LWT-Food Science and Technology,2020, 124: 109200. DOI:10.1016/j.lwt.2020.109200.
[6]HALDER S, YADAV K K, SARKAR R, et al. Alteration of Zeta potential and membrane permeability in bacteria: a study with cationic agents[J].Springerplus, 2015, 4(1): 1-14. DOI:10.1186/s40064-015-1476-7.
[7]DONALDSON G P, LEE S M, MAZMANIAN S K. Gut biogeography of the bacterial microbiota[J]. Nature Reviews Microbiology, 2016,14(1): 20-32. DOI:10.1038/nrmicro3552.
[8]CHAI J J, JIANG P, WANG P J, et al. The intelligent delivery systems for bioactive compounds in foods: physicochemical and physiological conditions, absorption mechanisms, obstacles and responsive strategies[J]. Trends in Food Science and Technology, 2018, 78: 144-154. DOI:10.1016/j.tifs.2018.06.003.
[9]KRUPA L, BAJKA B, STARON R, et al. Comparing the permeability of human and porcine small intestinal mucus for particle transport studies[J]. Scientific Reports, 2020, 10(1): 20290. DOI:10.1038/s41598-020-77129-4.
[10]HUANG Y, LIN X J, YU S Y, et al. Intestinal engineered probiotics as living therapeutics: chassis selection, colonization enhancement, gene circuit design, and biocontainment[J]. ACS Synthetic Biology, 2022,11(10): 3134-3153. DOI:10.1021/acssynbio.2c003143134.
[11]MCCLEMENTS D J. Advances in nanoparticle and microparticle delivery systems for increasing the dispersibility, stability, and bioactivity of phytochemicals[J]. Biotechnology Advances, 2020, 38:107287. DOI:10.1016/j.biotechadv.2018.08.004.
[12]MCCLEMENTS D J. Edible lipid nanoparticles: digestion, absorption,and potential toxicity[J]. Progress in Lipid Research, 2013, 52(4): 409-423. DOI:10.1016/j.plipres.2013.04.008.
[13]CHEN Y N, MEENU M, XU B J. A narrative review on microencapsulation of obligate anaerobe probiotics Bifidobacterium,Akkermansia muciniphila, and Faecalibacterium prausnitzii[J]. Food Reviews International, 2022, 38: 373-402. DOI:10.1080/87559129.2020.1871008.
[14]JIANG H, ZHANG S W, SUN G Q, et al. Engineering hybrid microgels as particulate emulsifiers for reversible Pickering emulsions[J]. Chemical Science, 2021, 13(1): 39-43. DOI:10.1039/d1sc05398a.
[15]JOYE I J, MCCLEMENTS D J. Biopolymer-based nanoparticles and microparticles: fabrication, characterization, and application[J].Current Opinion in Colloid and Interface Science, 2014, 19(5): 417-427. DOI:10.1016/j.cocis.2014.07.002.
[16]POUR H M, MARHAMATIZADEH M H, FATTAHI H.Encapsulation of different types of probiotic bacteria within conventional/multilayer emulsion and its effect on the properties of probiotic yogurt[J]. Journal of Food Quality, 2022, 2022: 7923899.DOI:10.1155/2022/7923899.
[17]SEETO W J, TIAN Y, PRADHAN S, et al. Rapid production of cell-laden microspheres using a flexible microfluidic encapsulation platform[J]. Small, 2019, 15(47): 1902058. DOI:10.1002/smll.201902058.
[18]ZHUANG X, GAUDINO N, CLARK S, et al. Novel lecithin-based oleogels and oleogel emulsions delay lipid oxidation and extend probiotic bacteria survival[J]. LWT-Food Science and Technology,2021, 136(2): 110353. DOI:10.1016/j.lwt.2020.110353.
[19]HOLZAPFEL W H, HABERER P, GEISEN R, et al. Taxonomy and important features of probiotic microorganisms in food and nutrition[J]. The American Journal of Clinical Nutrition, 2001, 73(2):365-373. DOI:10.1093/ajcn/73.2.365s.
[20]OELSCHLAEGER T A. Mechanisms of probiotic actions: a review[J].International Journal of Medical Microbiology, 2010, 300(1): 57-62.DOI:10.1016/j.ijmm.2009.08.005.
[21]LEBEER S, VANDERLEYDEN J, DE KEERSMAECKER S C J.Host interactions of probiotic bacterial surface molecules: comparison with commensals and pathogens[J]. Nature Reviews Microbiology,2010, 8(3): 171-184. DOI:10.1038/nrmicro2297.
[22]SANDERS M E, KLAENHAMMER T R. The scientific basis of Lactobacillus acidophilus NCFM functionality as a probiotic[J].Journal of Dairy Science, 2001, 84(2): 319-331. DOI:10.3168/jds.S0022-0302(01)74481-5.
[23]HERNANDEZ-RODRIGUEZ D, VASQUEZ-AGUILAR A A,SERIO-SILVA J C, et al. Molecular detection of Bifidobacterium spp.in faeces of black howler monkeys (Alouatta pigra)[J]. Journal of Medical Primatology, 2019, 48(2): 99-105. DOI:10.1111/jmp.12395.
[24]WU S, CAI M. Advances in Bifidobacterium longum and intestinal health during infancy[J]. Journal of Chinical Pediatrics, 2022, 40(9):715-720. DOI:10.12372/jcp.2022.21e0107.
[25]SANGKANJANAVANICH S, PRADUBPONGSA P, MITTHAMSIRI W,et al. Bifidobacterium infantis 35624 efficacy in patients with uncontrolled asthma: a randomized placebo-controlled trial[J].Annals of Allergy Asthma and Immunology, 2022, 129(6): 790-792.DOI:10.1016/j.anai.2022.08.1000.
[26]LI M J, DING J H, STANTON C, et al. Bifidobacterium longum subsp. infantis FJSYZ1M3 ameliorates DSS-induced colitis by maintaining the intestinal barrier, regulating inflammatory cytokines,and modifying gut microbiota[J]. Food & Function, 2023, 14(1): 354-368. DOI:10.1039/d2fo03263e.
[27]CZERUCKA D, PICHE T, RAMPAL P. Review article: yeast as probiotics: Saccharomyces boulardii[J]. Alimentary Pharmacology and Therapeutics, 2007, 26(6): 767-778. DOI:10.1111/j.1365-2036.2007.03442.x.
[28]STANISZEWSKI A, KORDOWSKA-WIATER M. Probiotic and potentially probiotic yeasts-characteristics and food application[J].Foods, 2021, 10(6): 110353. DOI:10.3390/foods10061306.
[29]JAEGER R, SHIELDS K A, LOWERY R P, et al. Probiotic Bacillus coagulans GBI-30, 6086 reduces exercise-induced muscle damage and increases recovery[J]. PeerJ, 2016, 4: e2276. DOI:10.7717/peerj.2276.
[30]KIMMEL M, KELLER D, FARMER S, et al. A controlled clinical trial to evaluate the effect of ganedenbc(30) on immunological markers[J].Methods and Findings in Experimental and Clinical Pharmacology,2010, 32(2): 129-132. DOI:10.1358/mf.2010.32.2.1423881.
[31]XU C, BAN Q, WANG W, et al. Novel nano-encapsulated probiotic agents: encapsulate materials, delivery, and encapsulation systems[J].Journal of Controlled Release, 2022, 349: 184-205. DOI:10.1016/j.jconrel.2022.06.061.
[32]ALONSO S. Chapter 2: novel preservation techniques for microbial cultures[M]// OJHA K S, TIWARI B K. Novel food fermentation technologies. Switzerland: Springer International Publishing, 2016:7-33. DOI:10.1007/978-3-319-42457-6_2.
[33]CHANG T, ZHAO G. Ice inhibition for cryopreservation: materials,strategies, and challenges[J]. Advanced Science, 2021, 8(6): 2002425.DOI:10.1002/advs.202002425.
[34]BIRCHER L, GEIRNAERT A, HAMMES F, et al. Effect of cryopreservation and lyophilization on viability and growth of strict anaerobic human gut microbes[J]. Microbial Biotechnology, 2018,11(4): 721-733. DOI:10.1111/1751-7915.13265.
[35]COULIBALY I, DUBOIS-DAUPHIN R, DESTAIN J, et al. The resistance to freeze-drying and to storage was determined as the cellular ability to recover its survival rate and acidification activity[J].International Journal of Microbiology, 2010, 2010: 625239.DOI:10.1155/2010/625239.
[36]KAVAS N, KAVAS G, ATES M, et al. Determination of probiotic characteristics and resistance to biological barriers under in vitro gastrointestinal conditions in goat cheese produced using microencapsulated probiotic bacteria[J]. Food Science and Technology, 2022, 42(3): e34620. DOI:10.1590/fst.34620.
[37]OLUWATOSIN S O, TAI S L, FAGAN-ENDRES M A. Sucrose,maltodextrin and inulin efficacy as cryoprotectant, preservative and prebiotic: towards a freeze dried Lactobacillus plantarum topical probiotic[J]. Biotechnology Reports, 2022, 33(1): e00696.DOI:10.1016/j.btre.2021.e00696.
[38]MAFALDO I M, DE MEDEIROS V P B, DA COSTA W K A,et al. Survival during long-term storage, membrane integrity,and ultrastructural aspects of Lactobacillus acidophilus 05 and Lacticaseibacillus casei 01 freeze-dried with freshwater microalgae biomasses[J]. Food Research International, 2022, 159(4): 111620.DOI:10.1016/j.foodres.2022.111620.
[39]PHOSANAM A, CHANDRAPALA J, HUPPERTZ T, et al. Effect of storage conditions on physicochemical and microstructural properties of skim and whole milk powders[J]. Powder Technology, 2020, 372:394-403. DOI:10.1016/j.powtec.2020.06.020.
[40]ZAVALETA B, COAVICHI L I L, RODRIGUEZ L C V, et al.Co-microencapsulation of Lactobacillus rhamnosus and krill oil by spray-drying[J]. Food Bioscience, 2022, 50(3): 102133. DOI:10.1016/j.fbio.2022.102133.
[41]LI Z F, DU X Y, CUI X J, et al. Ultrasonic-assisted fabrication and release kinetics of two model redox-responsive magnetic microcapsules for hydrophobic drug delivery[J]. Ultrasonics Sonochemistry, 2019,57: 223-232. DOI:10.1016/j.ultsonch.2019.04.037.
[42]ALGAITHI M, MUDGIL P, HAMDI M, et al. Lactobacillus reuterifortified camel milk infant formula: effects of encapsulation, in vitro digestion, and storage conditions on probiotic cell viability and physicochemical characteristics of infant formula[J]. Journal of Dairy Science, 2022, 105(11): 8621-8637. DOI:10.3168/jds.2022-22008.
[43]YIN M, YUAN Y, CHEN M, et al. The dual effect of shellac on survival of spray-dried Lactobacillus rhamnosus GG microcapsules[J].Food Chemistry, 2022, 389(2): 132999. DOI:10.1016/j.foodchem.2022.132999.
[44]CHAMPAGNE C P, GARDNER N J, ROY D. Challenges in the addition of probiotic cultures to foods[J]. Critical Reviews in Food Science and Nutrition, 2005, 45(1): 61-84.DOI:10.1080/10408690590900144.
[45]DE ANGELIS M, GOBBETTI M. Environmental stress responses in Lactobacillus: a review[J]. Proteomics, 2004, 4(1): 106-122.DOI:10.1002/pmic.200300497.
[46]JOUKI M, KHAZAEI N, REZAEI F, et al. Production of synbiotic freeze-dried yoghurt powder using microencapsulation and cryopreservation of L. plantarum in alginate-skim milk microcapsules[J]. International Dairy Journal, 2021, 122: 105133.DOI:10.1016/j.idairyj.2021.105133.
[47]ROMYASAMIT C, SAENGSUWAN P, BOONSERM P, et al.Optimization of cryoprotectants for freeze-dried potential probiotic Enterococcus faecalis and evaluation of its storage stability[J]. Drying Technology, 2022, 40(11): 2283-2292. DOI:10.1080/07373937.2021.1931294.
[48]GUMUS S, DEMIRCI A S. Survivability of probiotic strains,Lactobacillus fermentum CECT 5716 and Lactobacillus acidophilus DSM 20079 in grape juice and physico-chemical properties of the juice during refrigerated storage[J]. Food Science and Technology,2022, 42(1): e08122. DOI:10.1590/fst.08122.
[49]SORNSENEE P, CHIMPLEE S, SAENGSUWAN P, et al.Characterization of probiotic properties and development of banana powder enriched with freeze-dried Lacticaseibacillus paracasei probiotics[J]. Heliyon, 2022, 8(10): e11063. DOI:10.1016/j.heliyon.2022.e11063.
[50]HOOD S K, ZOTTOLA E A. Effect of low pH on the ability of Lactobacillus acidophilus to survive and adhere to human intestinal cells[J]. Journal of Food Science, 1988, 53(5): 1514-1516.DOI:10.1111/j.1365-2621.1988.tb09312.x.
[51]SHAH N, JELEN P. Survival of lactic-acid bacteria and their lactases under acidic conditions[J]. Journal of Food Science, 1990, 55(2): 506-509. DOI:10.1111/j.1365-2621.1990.tb06797.x.
[52]VITHEEJONGJAROEN P, KANTHAWANG P, LOISON F, et al.Antioxidant activity of Bifidobacterium animalis MSMC83 and its application in set-style probiotic yoghurt[J]. Food Bioscience, 2021,43(1): 101259. DOI:10.1016/j.fbio.2021.101259.
[53]YANG X, YANG J, YE Z, et al. Physiologically inspired mucin coated Escherichia coli Nissle 1917 enhances biotherapy by regulating the pathological microenvironment to improve intestinal colonization[J].ACS Nano, 2022, 16(3): 4041-4058. DOI:10.1021/acsnano.1c09681.
[54]KOSTELAC D, GERIC M, GAJSKI G, et al. Probiotic and paraprobiotic derivates exhibit anti-inflammatory and genoprotective effects during induced stress[J]. Journal of Applied Microbiology,2022, 133(2): 819-829. DOI:10.1111/jam.15595.
[55]STRASSER S, NEUREITER M, GEPPL M, et al. Influence of lyophilization, fluidized bed drying, addition of protectants, and storage on the viability of lactic acid bacteria[J]. Journal of Applied Microbiology, 2009, 107(1): 167-177. DOI:/10.1111/j.1365-2672.2009.04192.x.
[56]CUNNINGHAM M, AZCARATE-PERIL M A, BARNARD A,et al. Shaping the future of probiotics and prebiotics[J]. Trends in Microbiology, 2021, 29(8): 667-685. DOI:10.1016/j.tim.2021.01.003.
[57]FIGUEROA-GONZALEZ I, RODRIGUEZ-SERRANO G, GOMEZRUIZ L, et al. Prebiotic effect of commercial saccharides on probiotic bacteria isolated from commercial products[J]. Food Science and Technology, 2019, 39(3): 747-753. DOI:10.1590/fst.07318.
[58]PAESANI C, SALVUCCI E, MOIRAGHI M, et al. Arabinoxylan from Argentinian whole wheat flour promote the growth of Lactobacillus reuteri and Bifidobacterium breve[J]. Letters in Applied Microbiology,2019, 68(2): 142-148. DOI:10.1111/lam.13097.
[59]RANADHEERA R, BAINES S K, ADAMS M C. Importance of food in probiotic efficacy[J]. Food Research International, 2010, 43(1): 1-7.DOI:10.1016/j.foodres.2009.09.009.
[60]BILELLO J, OKEREKE I. Impact of environmental and pharmacologic changes on the upper gastrointestinal microbiome[J].Biomedicines, 2021, 9(6): 617. DOI:10.3390/biomedicines9060617.
[61]YAO M, XIE J, DU H, et al. Progress in microencapsulation of probiotics: a review[J]. Comprehensive Reviews in Food Science and Food Safety, 2020, 19(2): 857-874. DOI:10.1111/1541-4337.12532.
[62]COTTER P D, HILL C. Surviving the acid test: responses of Grampositive bacteria to low pH[J]. Microbiology and Molecular Biology Reviews, 2003, 67(3): 429-453. DOI:10.1128/mmbr.67.3.429-453.2003.
[63]BANG M, OH S, LIM K S, et al. The involvement of ATPase activity in the acid tolerance of Lactobacillus rhamnosus strain GG[J].International Journal of Dairy Technology, 2014, 67(2): 229-236.DOI:10.1111/1471-0307.12123.
[64]VERTZONI M, AUGUSTIJNS P, GRIMM M, et al. Impact of regional differences along the gastrointestinal tract of healthy adults on oral drug absorption: an UNGAP review[J]. European Journal of Pharmaceutical Sciences, 2019, 134: 153-175. DOI:10.1016/j.ejps.2019.04.013.
[65]JUDKINS T C, ARCHER D L, KRAMER D C, et al. Probiotics,nutrition, and the small intestine[J]. Current Gastroenterology Reports,2020, 22(1): 2. DOI:10.1007/s11894-019-0740-3.
[66]RIVERA-ESPINOZA Y, GALLARDO-NAVARRO Y. Nondairy probiotic products[J]. Food Microbiology, 2010, 27(1): 1-11.DOI:10.1016/j.fm.2008.06.008.
[67]WU W, WANG L, ZHAO J, et al. Research progress on physiological characteristics and health benefits of Lactobacillus plantarum[J].Food and Fermentation Industries, 2019, 45(1): 1-13. DOI:10.13995/j.cnki.11-1802/ts.019602.
[68]MARCO M L, PAVAN S, KLEEREBEZEM M. Towards understanding molecular modes of probiotic action[J]. Current Opinion in Biotechnology, 2006, 17(2): 204-210. DOI:10.1016/j.copbio.2006.02.005.
[69]ZHANG Z P, GU M, YOU X M, et al. Encapsulation of bifidobacterium in alginate microgels improves viability and targeted gut release[J]. Food Hydrocolloids, 2021, 116(9): 106634.DOI:10.1016/j.foodhyd.2021.106634.
[70]WANG G Q, YU H I, FENG X, et al. Specific bile salt hydrolase genes in Lactobacillus plantarum AR113 and relationship with bile salt resistance[J]. LWT-Food Science and Technology, 2021, 145(4):111208. DOI:10.1016/j.lwt.2021.111208.
[71]JENA P K, TRIVEDI D, THAKORE K, et al. Isolation and characterization of probiotic properties of Lactobacilli isolated from rat fecal microbiota[J]. Microbiology and Immunology, 2013, 57(6):407-416. DOI:10.1111/1348-0421.12054.
[72]HEAVEY M K, DURMUSOGLU D, CROOK N, et al. Discovery and delivery strategies for engineered live biotherapeutic products[J].Trends in Biotechnology, 2022, 40(3): 354-369. DOI:10.1016/j.tibtech.2021.08.002.
[73]REID G, JASS J, SEBULSKY M T, et al. Potential uses of probiotics in clinical practice[J]. Clinical Microbiology Reviews, 2003, 16(4):658-672. DOI:10.1128/cmr.16.4.658-672.2003.
[74]TURRONI F, BOTTACINI F, FORONI E, et al. Genome analysis of Bifidobacterium bifidum PRL2010 reveals metabolic pathways for host-derived glycan foraging[J]. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(45): 19514-19519. DOI:10.1073/pnas.1011100107.
[75]DANINO T, PRINDLE A, KWONG G A, et al. Programmable probiotics for detection of cancer in urine[J]. Science Translational Medicine, 2015, 7: 289ra84. DOI:10.1126/scitranslmed.aaa3519.
[76]SONG Wenfang, YAO Weiqin, CHEN Qiwen, et al. In situ bioorthogonal conjugation of delivered bacteria with gut inhabitants for enhancing probiotics colonization[J]. ACS Central Science, 2022,8(9): 1306-1317. DOI:10.1021/acscentsci.2c00533.
[77]BAKRY A M, ABBAS S, ALI B, et al. Microencapsulation of oils:a comprehensive review of benefits, techniques, and applications[J].Comprehensive Reviews in Food Science and Food Safety, 2016,15(1): 143-182. DOI:10.1111/1541-4337.12179.
[78]LI S Q, JIANG W Q, ZHENG C X, et al. Oral delivery of bacteria:basic principles and biomedical applications[J]. Journal of Controlled Release, 2020, 327: 801-833. DOI:10.1016/j.jconrel.2020.09.011.
[79]ZHAO C, CAI L, CHEN H, et al. Oral biomaterials for intestinal regulation[J]. Engineered Regeneration, 2021, 2: 116-132.DOI:10.1016/j.engreg.2021.09.002.
[80]OBRADOVIC N, VOLIC M, NEDOVIC V, et al. Microencapsulation of probiotic starter culture in protein-carbohydrate carriers using spray and freeze-drying processes: implementation in whey-based beverages[J]. Journal of Food Engineering, 2022, 321(1): 110948.DOI:10.1016/j.jfoodeng.2022.110948.
[81]BROECKX G, VANDENHEUVEL D, CLAES I J J, et al.Drying techniques of probiotic bacteria as an important step towards the development of novel pharmabiotics[J]. International Journal of Pharmaceutics, 2016, 505(1): 303-318. DOI:10.1016/j.ijpharm.2016.04.002.
[82]XU D, LIU Z, AN Z, et al. Incorporation of probiotics into 3D printed Pickering emulsion gel stabilized by tea protein/xanthan gum[J]. Food Chemistry, 2022, 409(1): 135289. DOI:10.1016/j.foodchem.2022.135289.
[83]COOK M T, TZORTZIS G, CHARALAMPOPOULOS D, et al.Microencapsulation of probiotics for gastrointestinal delivery[J].Journal of Controlled Release, 2012, 162(1): 56-67. DOI:10.1016/j.jconrel.2012.06.003.
[84]DE MENEZES C R, BARIN J S, CHICOSKI A J, et al.Microencapsulation of probiotics: progress and prospects[J]. Ciencia Rural, 2013, 43(7): 1309-1316. DOI:10.1590/s0103-84782013005000084.
[85]LIU H, CUI S W, CHEN M S, et al. Protective approaches and mechanisms of microencapsulation to the survival of probiotic bacteria during processing, storage and gastrointestinal digestion: a review[J].Critical Reviews in Food Science and Nutrition, 2019, 59(17): 2863-2878. DOI:10.1080/10408398.2017.1377684.
[86]LIU J, XIE H P, GAO Y, et al. Soybean protein isolate treated with transglutaminase (TGase) enhances the heat tolerance of selected lactic acid bacteria strains to spray drying[J]. Food Chemistry, 2023, 404:134676. DOI:10.1016/j.foodchem.2022.134676.
[87]LU W J, FU N, WOO M W, et al. Exploring the interactions between Lactobacillus rhamnosus GG and whey protein isolate for preservation of the viability of bacteria through spray drying[J]. Food & Function,2021, 12(7): 2995-3008. DOI:10.1039/d0fo02906h.
[88]YUAN Y K, YIN M, CHEN L, et al. Effect of calcium ions on the freeze-drying survival of probiotic encapsulated in sodium alginate[J]. Food Hydrocolloids, 2022, 130(1): 107668. DOI:10.1016/j.foodhyd.2022.107668.
[89]VAZIRI A S, ALEMZADEH I, VOSSOUGHI M. Survivability and oxidative stability of co-microencapsulated L. plantarum PTCC 1058 and DHA as a juice carrier[J]. Food Bioscience, 2019, 32(1): 100460.DOI:10.1016/j.fbio.2019.100460.
[90]WU Feng, PANG Yan, LIU Jinyao. Swelling-strengthening hydrogels by embedding with deformable nanobarriers[J]. Nature Communications,2020, 11(1): 4502. DOI:10.1038/s41467-020-18308-9.
[91]LIU Y, LIU B, LI D, et al. Improved gastric acid resistance and adhesive colonization of probiotics by mucoadhesive and intestinal targeted konjac glucomannan microspheres[J]. Advanced Functional Materials, 2020, 30(35): 2001157. DOI:10.1002/adfm.202001157.
[92]HUANG Z H, GUO B Z, GONG D M, et al. Oleogel-structured emulsions: a review of formation, physicochemical properties and applications[J]. Food Chemistry, 2023, 404: 134553. DOI:10.1016/j.foodchem.2022.134553.
[93]SILVA T J, BARRERA-ARELLANO D, RIBEIRO A P B. Oleogelbased emulsions: concepts, structuring agents, and applications in food[J]. Journal of Food Science, 2021, 86(7): 2785-2801.DOI:10.1111/1750-3841.15788.
[94]MARTIN-ILLANA A, NOTARIO-PEREZ F, CAZORLA-LUNA R,et al. Bigels as drug delivery systems: from their components to their applications[J]. Drug Discovery Today, 2022, 27(4): 1008-1026.DOI:10.1016/j.drudis.2021.12.011.
[95]JIANG J Y, MA C, SONG X N, et al. Spray drying co-encapsulation of lactic acid bacteria and lipids: a review[J]. Trends in Food Science and Technology, 2022, 129: 134-143. DOI:10.1016/j.tifs.2022.09.010.
[96]BOLLOM M A, CLARK S, ACEVEDO N C. Edible lecithin,stearic acid, and whey protein bigels enhance survival of probiotics during in vitro digestion[J]. Food Bioscience, 2021, 39(7): 100813.DOI:10.1016/j.fbio.2020.100813.
[97]ZHUANG X Q, CLARK S, ACEVEDO N. Bigels-oleocolloid matrices-as probiotic protective systems in yogurt[J]. Journal of Food Science, 2021, 86(11): 4892-4900. DOI:10.1111/1750-3841.15928.
[98]PAN C, LI J, HOU W, et al. Polymerization-mediated multifunctionalization of living cells for enhanced cell-based therapy[J]. Advanced Materials, 2021, 33(13): 2007379. DOI:10.1002/adma.202007379.
[99]HOU W, LI J, CAO Z, et al. Decorating bacteria with a therapeutic nanocoating for synergistically enhanced biotherapy[J]. Small, 2021,17(37): 2101810. DOI:10.1002/smll.202101810.
[100]CHEHREARA A, TABANDEH F, OTADI M, et al. Enhanced survival of Lacticaseibacillus rhamnosus in simulated gastrointestinal conditions using layer-by-layer encapsulation[J]. Biotechnology Letters, 2022, 44(11): 1277-1286. DOI:10.1007/s10529-022-03289-0.
[101]ANSELMO A C, MCHUGH K J, WEBSTER J, et al. Layer-bylayer encapsulation of probiotics for delivery to the microbiome[J].Advanced Materials, 2016, 28(43): 9486-9490. DOI:10.1002/adma.201603270.
[102]SINGH H, YE A Q, HORNE D. Structuring food emulsions in the gastrointestinal tract to modify lipid digestion[J]. Progress in Lipid Research, 2009, 48(2): 92-100. DOI:10.1016/j.plipres.2008.12.001.
[103]GAO Y, WANG X, XUE C, et al. Latest developments in foodgrade delivery systems for probiotics: a systematic review[J]. Critical Reviews in Food Science and Nutrition, 2021, 8: 1-18. DOI:10.1080/10408398.2021.2001640.
[104]GAO H, MA L, SUN W, et al. Impact of encapsulation of probiotics in oil-in-water high internal phase emulsions on their thermostability and gastrointestinal survival[J]. Food Hydrocolloids, 2022, 126: 107478.DOI:10.1016/j.foodhyd.2021.107478.
[105]LI Q, WU Y L, FANG R X, et al. Application of nanocellulose as particle stabilizer in food Pickering emulsion: scope, merits and challenges[J]. Trends in Food Science and Technology, 2021, 110(1):573-583. DOI:10.1016/j.tifs.2021.02.027.
[106]SILVA J A, DE GREGORIO P R, RIVERO G, et al. Immobilization of vaginal Lactobacillus in polymeric nanofibers for its incorporation in vaginal probiotic products[J]. European Journal of Pharmaceutical Sciences, 2021, 156: 105563. DOI:10.1016/j.ejps.2020.105563.
[107]MA J G, XU C, YU H L, et al. Electro-encapsulation of probiotics in gum Arabic-pullulan blend nanofibres using electrospinning technology[J]. Food Hydrocolloids, 2021, 111(1): 106381.DOI:10.1016/j.foodhyd.2020.106381.
[108]LUO Y, DE SOUZA C, RAMACHANDRAN M, et al. Precise oral delivery systems for probiotics: a review[J]. Journal of Controlled Release, 2022, 352: 371-384. DOI:10.1016/j.jconrel.2022.10.030.
[109]SUN Z Y, HUBNER R, LI J, et al. Artificially sporulated Escherichia coli cells as a robust cell factory for interfacial biocatalysis[J]. Nature Communications, 2022, 13(1): 3142. DOI:10.1038/s41467-022-30915-2.
[110]ZHENG D W, LI R Q, AN J X, et al. Prebiotics-encapsulated probiotic spores regulate gut microbiota and suppress colon cancer[J]. Advanced Materials, 2020, 32(45): 2004529. DOI:10.1002/adma.202004529.
[111]SONG Q L, ZHAO H J, ZHENG C X, et al. A bioinspired versatile spore coat nanomaterial for oral probiotics delivery[J]. Advanced Functional Materials, 2021, 31(41): 2104994. DOI:10.1002/adfm.202104994.
[112]WANG X, CAO Z, ZHANG M, et al. Bioinspired oral delivery of gut microbiota by self-coating with biofilms[J]. Science Advances, 2020,6(26): eabb1952. DOI:10.1126/sciadv.abb1952.
[113]CAO Z P, WANG X Y, PANG Y, et al. Biointerfacial self-assembly generates lipid membrane coated bacteria for enhanced oral delivery and treatment[J]. Nature Communications, 2019, 10(1): 5783.DOI:10.1038/s41467-019-13727-9.
[114]TERPOU A, PAPADAKI A, BOSNEA L, et al. Novel frozen yogurt production fortified with sea buckthorn berries and probiotics[J]. LWTFood Science and Technology, 2019, 105: 242-249. DOI:10.1016/j.lwt.2019.02.024.
[115]PIMENTEL T C, GOMES DE OLIVEIRA L I, DE SOUZA R C, et al.Probiotic non-dairy frozen dessert: technological and sensory aspects and industrial challenges[J]. Trends in Food Science and Technology,2021, 107(2): 381-388. DOI:10.1016/j.tifs.2020.11.008.
[116]GARCIA-RUIZ A, DE LLANO D G, ESTEBAN-FERNANDEZ A,et al. Assessment of probiotic properties in lactic acid bacteria isolated from wine[J]. Food Microbiology, 2014, 44: 220-225. DOI:10.1016/j.fm.2014.06.015.
[117]VARGAS B K, FABRICIO M F, AYUB M A Z. Health effects and probiotic and prebiotic potential of Kombucha: a bibliometric and systematic review[J]. Food Bioscience, 2021, 44(9): 101332.DOI:10.1016/j.fbio.2021.101332.
[118]DIEZ-OZAETA I, ASTIAZARAN O J. Recent advances in Kombucha tea: microbial consortium, chemical parameters,health implications and biocellulose production[J]. International Journal of Food Microbiology, 2022, 377: 109783. DOI:10.1016/j.ijfoodmicro.2022.109783.
[119]HASSLÖF P, GRANQVIST L, STECKSÉN-BLICKS C, et al.Prevention of recurrent childhood caries with probiotic supplements: a randomized controlled trial with a 12-month follow-up[J]. Probiotics and Antimicrobial Proteins, 2022, 14(2): 384-390. DOI:10.1007/s12602-022-09913-9.
[120]TEHRANI M H, AKHLAGHI N, TALEBIAN L, et al. Effects of probiotic drop containing Lactobacillus rhamnosus, Bifidobacterium infantis, and Lactobacillus reuteri on salivary Streptococcus mutans and Lactobacillus levels[J]. Contemporary Clinical Dentistry, 2016,7(4): 469-474. DOI:10.4103/0976-237X.194102.
[121]PEREZ-BURILLO S, PASTORIZA S, GIRONES A, et al. Potential probiotic salami with dietary fiber modulates metabolism and gut microbiota in a human intervention study[J]. Journal of Functional Foods, 2020, 66: 103790. DOI:10.1016/j.jff.2020.103790.
[122]BIS-SOUZA C V, PENNA A L B, BARRETTO A C D. Applicability of potentially probiotic Lactobacillus casei in low-fat Italian type salami with added fructooligosaccharides: in vitro screening and technological evaluation[J]. Meat Science, 2020, 168(41): 108186.DOI:10.1016/j.meatsci.2020.108186.
[123]ENDRES J R, CLEWELL A, JADE K A, et al. Safety assessment of a proprietary preparation of a novel probiotic, Bacillus coagulans, as a food ingredient[J]. Food and Chemical Toxicology, 2009, 47(6): 1231-1238. DOI:10.1016/j.fct.2009.02.018.
[124]WONG C H, MAK I E K, LI D. Bilayer edible coating with stabilized Lactobacillus plantarum 299v improved the shelf life and safety quality of fresh-cut apple slices[J]. Food Packaging and Shelf Life,2021, 30(16): 100746. DOI:10.1016/j.fpsl.2021.100746.
[125]OLIVEIRA A S, NIRO C M, BRESOLIN J D, et al. Dehydrated strawberries for probiotic delivery: influence of dehydration and probiotic incorporation methods[J]. LWT-Food Science and Technology, 2021, 144(1): 111105. DOI:10.1016/j.lwt.2021.111105.
[126]GU Q, YIN Y, YAN X, et al. Encapsulation of multiple probiotics,synbiotics, or nutrabiotics for improved health effects: a review[J].Advances in Colloid and Interface Science, 2022, 309: 102781.DOI:10.1016/j.cis.2022.102781.
专家简介:
李 媛 教授,博士生导师
中国农业大学食品科学与营养工程学院
多年来从事食品功能因子精准靶向递送的研究。入选国家高层次特殊人才支持计划、中国科协“强国青年科学家”、北京市“青年拔尖人才”和北京市“科技新星”。获教育部高等学校科学研究优秀成果奖“自然科学二等奖”(1/8)、霍英东教育基金会高等学校“青年科学奖”、英国乳业协会“Ernest Mann”青年科学家奖和中国农学会“青年科技奖”。主持国家自然科学基金5 项,企业教授工作站和横向课题5 项等。近5 年以通讯作者在Nature Sustainability、Science Advances、Advanced Functional Materials、ACS Nano、Nano Letters、Small、Biomaterials、Journal of Controlled Release等顶级期刊发表高水平论文,授权中国发明专利12 项。担任教育部食品精准营养与质量控制重点实验室副主任、中国农大食品胶体与营养递送研究中心主任、国际乳业联合会IDF中国国家委员会专业技术委员会委员和《食品科学》青年编委、《未来食品科学》编委。