世界人口持续增长、人们消费模式变化和气候变暖给高蛋白食品的生产供应带来了巨大的挑战[1]。目前蛋白质类食品的主要来源是动物、植物,其中动物蛋白的生产周期长、耗费大量劳动力资源,生产效率较低,且在动物饲养过程中还会产生CH4等温室气体;而植物种植占地面积大、耗水量多,受气候变化影响较大,且植物蛋白缺乏甲硫氨酸、赖氨酸等人类必需氨基酸,营养价值低[2-3]。预计到2050年,传统农业将无法满足人类对高蛋白膳食的需求[4]。事实上,由于食物分配不均,许多人目前无法获得高质量的蛋白质,导致营养不良,尤其是在发展中国家该问题更为常见[5]。因此,需要开发新型高质量蛋白质来保障食品蛋白供给安全。
微生物具有高水平的蛋白质含量,可以合成人体所需的必需氨基酸,在生物反应器中部分微生物蛋白质的产量可以达到每立方米每小时数千克,这比传统农业高出几个数量级,且对环境的影响以及依赖极小[6-7]。微生物单细胞蛋白不仅蛋白质含量高,还含有糖类、脂质、维生素、无机盐和一些重要的氨基酸,营养价值高,可作为食品工业的新型替代蛋白[8]。与植物和动物蛋白生产相比,微生物单细胞蛋白生产周期短,能源利用效率高,只需小部分土地,且不受天气和气候变化的影响。第一次世界大战期间,德国曾用酵母蛋白取代了一半的进口蛋白质来源[7]。目前全球已有几家公司在以商业规模生产来自藻类、真菌或细菌的单细胞蛋白,并出售给人们食用。微生物生产单细胞蛋白的底物来源广泛且价格低廉,包括一碳化合物、工业和农业废弃物等[4]。因此,食用微生物蛋白具有替代传统的食物和饲料供应方式的潜力。
微生物可以利用多种底物生产蛋白[4],其中利用一碳化合物高效生产单细胞蛋白受到广泛关注。一碳化合物是指具有单个碳原子的化合物,包括CO、CO2、CH4、甲醇、甲醛和甲酸。这些一碳底物来源广泛、制备简单、价格低廉且储量丰富,被认为是生物炼制的新型和长期可持续的原料[9-11]。微生物利用一碳化合物生产单细胞蛋白,不仅可以拓展食品蛋白的供给体系,还可以促进一碳资源的清洁利用,助力我国“双碳”目标的实现[11]。目前利用一碳化合物生产单细胞蛋白的天然微生物种类主要包括甲基营养菌、化能自养菌和光能自养菌。随着合成生物学的最新进展和一碳利用途径的揭示,天然一碳利用微生物的碳利用途径被优化[12],且一些原本不能利用一碳化合物的异养菌也被开发利用一碳底物[13-14]。
综上,利用一碳化合物合成微生物蛋白的生产过程绿色低碳,具有广阔的应用前景。本文首先介绍微生物单细胞蛋白在食品中的应用及安全性;然后论述近年来天然微生物利用一碳化合物绿色生产单细胞蛋白的研究进展;同时,阐述天然一碳利用微生物的代谢机制以及相关途径的优化改造;最后对利用合成生物学方法改造微生物生产单细胞蛋白的前景进行展望。
1 微生物单细胞蛋白在食品领域的商业化发展及安全性评价
微生物单细胞蛋白是利用不同的原料培养真菌、细菌或微藻获得的微生物菌体蛋白。单细胞蛋白中蛋白质含量高,富含人类所需的必需氨基酸,可补充人体所需营养,去除核酸后可作为食品蛋白直接食用。与动物蛋白和植物蛋白相比,单细胞蛋白生产周期短、原料来源广、能源利用率高,且对环境的影响和依赖性很小,可作为动植物蛋白食品的替代来源[2,4]。单细胞蛋白还含有多种维生素、不饱和脂肪酸和无机盐,营养价值高,可用于生产功能性食品。此外,鉴于单细胞蛋白良好的水合性、胶凝性、乳化性和组织成型性等功能特性,其亦可作为食品添加剂应用于食品加工[15-16]。
1.1 单细胞蛋白在食品工业中的应用
微生物单细胞蛋白的蛋白质含量高,含有多种维生素和无机盐,是一种理想的食品蛋白质来源。单细胞蛋白具有良好的组织成型性可用于生产“人造肉”等新食品[17],Marlow Foods公司利用丝状镰刀菌(Fusarium venenatum)制成单细胞蛋白产品Quorn,该产品主要用于生产香肠肉饼、即食汉堡等,目前在全球15 个国家进行商业化生产[16]。单细胞蛋白含有丰富的必需氨基酸、维生素和无机盐,可作为营养强化剂添加至饼干、饮料和奶制品中,提高食品的营养价值[17-18]。此外,微藻单细胞蛋白含有丰富的不饱和脂肪酸,其中二十二碳五烯酸(eicosapentaenoic acid,EPA)和二十二碳六烯酸(docosahexaenoic acid,DHA)是人体必需的脂肪酸,目前利用微藻生产的不饱和脂肪酸已作为营养保健食品销售[19]。
微生物单细胞蛋白还可作为多种食品添加剂,用于食品加工。酵母浓缩蛋白具有显著的鲜味,已被广泛用于酱汁、肉汁等食品的增味;新鲜酵母和活性干酵母可作为发酵剂,用于馒头、面包的加工;此外,酵母细胞壁多糖β-葡聚糖可作为乳化稳定剂用于乳制品加工[15,20]。利用单细胞蛋白良好的水合性,将其用于肉制品和焙烤食品的制作,可减少加工过程中水分的流失,保持食品良好的口感和风味[17,20]。微藻单细胞蛋白中含有丰富的色素,可生产食用天然色素。微藻单细胞蛋白还富含天然抗氧化剂,包括类胡萝卜素、酚类化合物、维生素和植物甾醇等,可用于食物保存[21]。有研究表明,添加微藻单细胞蛋白可显著提高鱼肉对1,1-二苯基-2-三硝基苯肼自由基的清除能力,延缓脂肪氧化,延长肉制品保质期[22]。
目前用于商业生产的微生物单细胞蛋白包括好氧甲烷氧化菌(Methylococcus capsulatus)单细胞蛋白[4]、丝状镰刀菌单细胞蛋白[16]、用于功能性食品生产的小球藻(Chlorella vulgaris)单细胞蛋白[23]、用于含β-胡萝卜素的食品添加剂或保健品生产的杜氏盐藻(Dunaliella salina)单细胞蛋白[24]和用于含虾青素的保健食品生产的雨生红球藻(Haematococcus pluvialis)单细胞蛋白等[25]。
1.2 单细胞蛋白应用于食品的安全性
安全性是单细胞蛋白能否作为食品生产原料首先要考虑的问题。影响单细胞蛋白安全性的因素包括微生物生产原料的安全性、单细胞蛋白的RNA含量、微生物本身是否产生毒素以及潜在的过敏原等[4]。相关研究人员讨论了单细胞蛋白安全性并指出:生产单细胞蛋白菌株不能是病原菌,菌株不产生毒素;生产原料中重金属残留含量不能超过要求;在微生物培养和产品处理中要求无污染、无溶剂残留和热损害;最终产品应无病菌、无活细胞、无溶剂残留;单细胞蛋白产品必须进行动物毒性实和致癌实验,还要进行人体临床试验,测定人体对单细胞蛋白的耐受性和可接受性,才能用于食品生产[26-27]。
微生物具有自身代谢的特点,为了使单细胞蛋白符合作为食物的要求,通常采用特定的后处理来提高这种产品的消化性和可接受性[16]。微藻细胞具有细胞壁,生产微藻单细胞蛋白时需要将细胞壁破碎,使单细胞蛋白更容易被人体消化。细菌和真菌等微生物生长快速,其细胞含有高含量核酸,这致使相应微生物单细胞蛋白或多或少都含有部分核酸,尤其是RNA[8]。当单细胞蛋白用于食品生产时,高核酸含量是一个问题。人体摄入RNA分解产生的嘌呤化合物会增加血浆中的尿酸浓度,而人体缺乏尿酸酶,尿酸会在体内积累,积累过多甚至会导致肾结石和痛风。因此,利用单细胞蛋白生产食品蛋白时,需要增加核酸脱除环节,添加核糖核酸酶使RNA降解,将核酸含量减小到规定的限值以下[4,28]。
细菌在生长过程中会产生有害毒素,细菌产生的毒素分为外毒素和内毒素,在将非致病菌用于单细胞蛋白生产前,需要进行毒素去除。外毒素由细菌分泌到细胞外的培养基中,外毒素的主要成分为蛋白质,化学性质不稳定,60 ℃处理30 min即可破坏,还可通过乙醇、甲醛或稀酸处理使其变性或者脱毒成为类毒素;内毒素是革兰氏阴性菌细胞壁的组成成分,也称脂多糖,其去除较为困难,需160 ℃处理2~4 h才可被破坏,因此可通过基因工程手段抑制脂多糖形成基因的活性避免生成脂多糖[4,28]。微生物单细胞蛋白会存在一些潜在的过敏原,可以通过物理、化学或生物方法对其进行处理,从而降低或消除致敏性[29]。为了提高消费者对微生物单细胞蛋白的心理可接受度,单细胞蛋白产品还需加工成一定的结构和形状再供消费者食用。
2 天然微生物利用一碳化合物生产单细胞蛋白
目前利用一碳化合物生产单细胞蛋白的天然微生物主要包括甲醇酵母、化能自养菌和光合自养微生物三大类。其中甲醇酵母以甲醇为底物,生产的单细胞蛋白中蛋白质含量较高,富含必需氨基酸和维生素,且酵母菌体较大易于分离回收[20]。化能自养菌生长速度快,包括乙醇梭菌(Clostridium autoethanogenum)和好氧甲烷氧化菌等,其中乙醇梭菌以CO为底物,而好氧甲烷氧化菌以CH4为底物,利用它们生产的单细胞蛋白不仅蛋白质和必需氨基酸含量高,还具有较高的消化吸收率,但单细胞蛋白核酸含量较高[8]。光合自养微生物包括微藻和光合细菌两类,二者均以CO2为底物。微藻光合固碳效率较高,生产的单细胞蛋白富含叶绿素、维生素和不饱和脂肪酸,且核酸含量较低,但微藻细胞壁不易消化[21];光合细菌单细胞蛋白含有丰富的必需氨基酸、类胡萝卜素、维生素和聚羟基脂肪酸酯,可用于生产功能性食品[30]。
2.1 甲醇酵母单细胞蛋白
甲醇酵母是一种重要的甲基营养酵母,包括巴斯德毕赤酵母(Komagataella pastoris)、多形汉逊酵母(Ogataea polymorpha)和博伊丁假丝酵母(Candida boidinii)等,这类酵母通过木酮糖单磷酸(xylulose monophosphate,XuMP)途径以甲醇为碳源进行生长[31]。在甲醇酵母中,甲醇首先在醇氧化酶的作用下氧化生成甲醛,然后甲醛和5-磷酸木酮糖(xylulose 5-phophate,Xu5P)反应,生成的3-磷酸甘油醛和磷酸二羟丙酮进入糖酵解途径参与细胞代谢[32]。甲醇酵母细胞利用甲醇生成甲醛的过程在过氧化物酶体中进行,这有利于降低甲醛对细胞的毒性,从而提高细胞生长速度[10]。甲醇是一种清洁能源,价格低廉且来源充足,利用甲醇为碳源是甲醇酵母用于单细胞蛋白生产的优势,甲醇利用效率决定了其蛋白生产过程的经济性。甲醇酵母培养结束后,培养液经离心、脱水干燥即可得到甲醇酵母单细胞蛋白(图1A)。甲醇酵母中蛋白质含量较高,且富含必需氨基酸、维生素和金属离子,最初被用于生产单细胞蛋白,但甲醇酵母对甲醇的利用效率较低,且甲醇对细胞有一定的毒性[20,31],与动物和植物蛋白相比,甲醇酵母单细胞蛋白生产成本较高、经济性较差,因此研究人员转而开发甲醇酵母生产重组蛋白[33]。目前甲醇酵母是生产重组蛋白的一种重要平台微生物,已有超过5 000 种重组蛋白使用甲醇酵母生产[34-35]。
2.2 化能自养微生物单细胞蛋白
2.2.1 乙醇梭菌单细胞蛋白
乙醇梭菌是一种厌氧的化能自养菌,它通过Wood-Ljungdahl途径利用CO或CO2作为碳源,以H2作为还原剂,生产燃料乙醇、微生物蛋白等高附加值化学品[36-38]。乙醇梭菌等化能自养菌的发酵过程与现有工业发酵技术的相容性较好,是构建一碳气体生物转化细胞工厂的理想微生物之一。乙醇梭菌已通过中国工业微生物菌种保藏管理中心鉴定,经微生物药敏试验、菌种毒力试验、抗生素基因及致病基因检测分析证实乙醇梭菌安全无毒,可作为食品工业菌体蛋白的生产菌种[39-40]。
北京首朗生物科技有限公司和中国农业科学院饲料研究所以钢铁工业尾气中的CO为碳源、氨水为氮源,利用梭菌液态厌氧发酵工艺,实现22 s快速高效产出乙醇和乙醇梭菌蛋白。目前该成果已实现工业化,达到了生物合成乙醇梭菌蛋白年产万吨级的工业生产能力[41]。CO发酵乙醇醪液经蒸馏除乙醇后还含有较多的菌体蛋白,该研究人员根据乙醇梭菌发酵醪液的特性,开发了完整的乙醇梭菌蛋白生产工艺(图1B):首先控制乙醇梭菌发酵醪液的pH值和温度,使菌体蛋白变性沉降;随后经离心浓缩,并添加絮凝剂后混合均匀,再进行压滤脱水;产生的滤饼经干燥、粉碎后得到乙醇梭菌蛋白粉。该蛋白干粉的粗蛋白质量分数达到80%以上、粗灰分质量分数不超过7%[37]。乙醇梭菌单细胞蛋白产品的消化率较高,且富含必需氨基酸,目前主要应用于生产动物饲料[41-42],该产品中核酸含量较高,需要在生产工艺中添加去除核酸的环节,具有开发成新型替代食品蛋白的潜力。
2.2.2 好氧甲烷氧化菌单细胞蛋白
全球产生的CH4气体在进入大气前,有很大一部分会被甲烷氧化菌氧化代谢。好氧甲烷氧化菌对于减少大气中CH4含量、减缓温室效应具有重要作用[43]。好氧甲烷氧化菌在自然界中分布广泛,根据细菌结构和进化发育关系可分为3 种类型,分别属于变形菌门(Proteobacteria)γ亚型、α亚型和疣微菌门(Verrucomicrobia)。变形菌门的好氧甲烷氧化菌首先利用自身的甲烷单加氧酶将甲烷氧化为甲醇,甲醇再经甲醇脱氢酶催化氧化生成甲醛。随后,变形菌门γ亚型的好氧甲烷氧化菌通过核酮糖单磷酸(ribulose monophosphate,RuMP)途径将甲醛进一步转化利用,变形菌门α亚型的好氧甲烷氧化菌则将甲醛转化为甲酸后进入丝氨酸循环[44]。疣微菌门的好氧甲烷氧化菌是先将甲烷转化成CO2,再通过Calvin-Benson-Bassham(CBB)循环将CO2转化利用[45]。
好氧甲烷氧化菌生长速率较高,利用该菌生产的单细胞蛋白纯度高,单细胞蛋白作为胞内产物,其生产能力与好氧甲烷氧化菌生长水平密切相关。微生物的比生长速率在很大程度上由培养环境决定[46],而底物CH4气体在水中溶解度较低,因此好氧甲烷氧化菌发酵培养时的气液传质速率严重影响了其对CH4的转化利用。使用强制环流发酵罐(forced circulation loop reactor,FCLR)以连续培养方式进行好氧甲烷氧化菌发酵,不仅强化了气液传质,还保持了较高的单细胞蛋白生产效率。好氧甲烷氧化菌的菌体较小,离心过程能耗较大,且该菌单细胞蛋白的核酸含量较高,需经过核酸去除,再进行干燥、成型,最终得到可供人类食用的好氧甲烷氧化菌单细胞蛋白[43]。
丹麦UniBio和美国Calysta公司分别开发了利用变形菌门γ亚型好氧甲烷氧化菌通过RuMP途径将CH4转化为单细胞蛋白的发酵技术。UniBio公司使用带有静态混合器的U形环流发酵罐,其单细胞蛋白生产效率达到4 kg/(m3·h),且产品UniProtein®蛋白质量分数达72%[4]。该产品为自由流动的红棕色颗粒,不含毒素和重金属,具有较长的保质期,可进一步用于新型替代食品蛋白的开发研究。美国Calysta公司的最新产品Positive Protein单细胞蛋白使用其专利发酵平台制成。如图1C所示,该平台建立了一种循环的蛋白质生产系统,甲烷氧化菌发酵过程中产生的CO2会被系统捕获,经过甲烷化再进入发酵罐中。Positive Protein蛋白质的可消化率较高,还含有丰富的支链氨基酸,可与优质的动物蛋白质相媲美,能够作为一种营养又健康的食品替代蛋白,用于多种人类食品的生产[47]。
2.3 光能自养微生物单细胞蛋白
2.3.1 微藻单细胞蛋白
微藻是重要的光合固碳微生物,它通过CBB循环将CO2转化为3-磷酸甘油醛进入中心碳代谢。微藻在光合作用的光反应阶段利用叶绿素将H2O分解成氧气,并产生ATP和还原力NADPH,在暗反应阶段利用光反应产生的ATP和NADPH将CO2同化为有机物用于自身生长[9]。微藻生长速率较快,其蛋白质量分数高达70%,是单细胞蛋白的重要来源。微藻单细胞蛋白含有较多叶绿素、维生素和不饱和脂肪酸(EPA和DHA),且核酸含量较低,具有生产功能性高蛋白食品的潜力[21]。
微藻生产单细胞蛋白的效率受CBB循环中CO2捕获酶的影响较大,利用合成生物学方法提高CO2捕获酶的效率可有效提高微藻光合固碳能力,从而提升微藻单细胞蛋白的生产能力[9]。1,5-二磷酸核酮糖羧化酶/加氧酶(ribulose 1,5-bisphosphate carboxylase/oxygenase,RuBisCO)是CBB循环中的关键碳捕获酶,Wei Li等[48]在Nannochloropsis oceanica中过表达了内源的RuBisCO活化酶,通过提高RuBisCO的表达量,使得微藻生长速率提高了32%,生物质积累量提高了46%,从而增强了微藻单细胞蛋白生产能力。光生物反应器(photobioreactor,PBR)对于微藻培养十分重要,它决定着微藻细胞的生长速率和CO2利用效率,进而决定单细胞蛋白的生产效率。PBR分为开放式和封闭式两大类。开放式PBR包括自然池塘、人工跑道池塘等,它们结构简单、成本低、操作方便,但易受环境和气候的影响,光照、温度的可控性差,还容易遭受杂菌污染。开放式PBR以太阳光为光源,由于太阳光的穿透能力有限,微藻开放培养多为单层跑道池塘的浅水养殖[49-50]。封闭式PBR的光源包括外置光源和内置光源,微藻培养时的温度、pH值、CO2供应量和光照都可控制,光能利用效率高、微藻培养密度大,但生产成本较高。封闭式PBR包括柱式、管式和平板式反应器等,多用于实验室规模的微藻培养,放大培养较为困难[50-51]。
微藻种类较多,可以根据生产需求选择不同的藻株,小球藻蛋白含量较高可用于生产单细胞蛋白。Pan Minmin等开发了一种新型的三室小球藻生物电化学反应器,可以实现清洁培养小球藻和处理工业有机废水同时进行。该研究为利用工业废水清洁生产微藻蛋白提供了一种方法[52]。杜氏盐藻(Dunaliella salina)、雨生红球藻(Haematococcus pluvialis)等蛋白质含量较低,可用于生产类胡萝卜素、虾青素、维生素、极性脂质和甘油等高附加值产品[24-25,53]。微藻大多具有坚硬的细胞壁,人体很难消化,微藻培养后需对其进行细胞破碎来提高微藻单细胞蛋白的消化率,得到的微藻细胞裂解物经过干燥,即可获得微藻单细胞蛋白(图1D)[51]。
2.3.2 紫色光合细菌单细胞蛋白
紫色光合细菌是一种厌氧的光合细菌,它通过细菌叶绿素(bacteriochlorophylls,BChls)吸收近红外光,再利用自身丰富的类胡萝卜素吸收可见光。紫色光合细菌包括紫色硫细菌和紫色非硫细菌两类,它们通过CBB循环实现CO2的利用。紫色光合细菌不仅可以CO2为碳源进行光合自养生长,还可分解利用食品工业废水的有机碳、氮、磷进行异养生长,收集的紫色光合细菌生物质可用于生产单细胞蛋白[30,54]。
紫色光合细菌生长需要充足的光照,由于透光率与细胞密度成反比关系,单位体积的紫色光合细菌细胞产量往往维持在较低水平,因此利用紫色光合细菌生产单细胞蛋白的重要挑战是降低生产成本,提高生产效率[55]。紫色光合细菌经过厌氧培养后,将培养液离心收集细胞,再去除核酸得到菌体蛋白,经过脱水干燥后即可获得紫色光合细菌单细胞蛋白(图1E),目前紫色光合细菌的培养包括开放体系和封闭体系两类。开放式培养体系(如跑道池塘)具有低成本、操作简单、易清洗和低能耗的优点,但易受天气影响,因而难以实现紫色光合细菌长期稳定的生长,且存在生产效率低和易受到其他微生物污染等问题。封闭培养体系(如管式/平板式PBR)具有光照表面积大、气液传质速率高、生产强度高、不易受到污染等优势,但培养成本较高[49],其中平板式PBR应用比较广泛[56]。
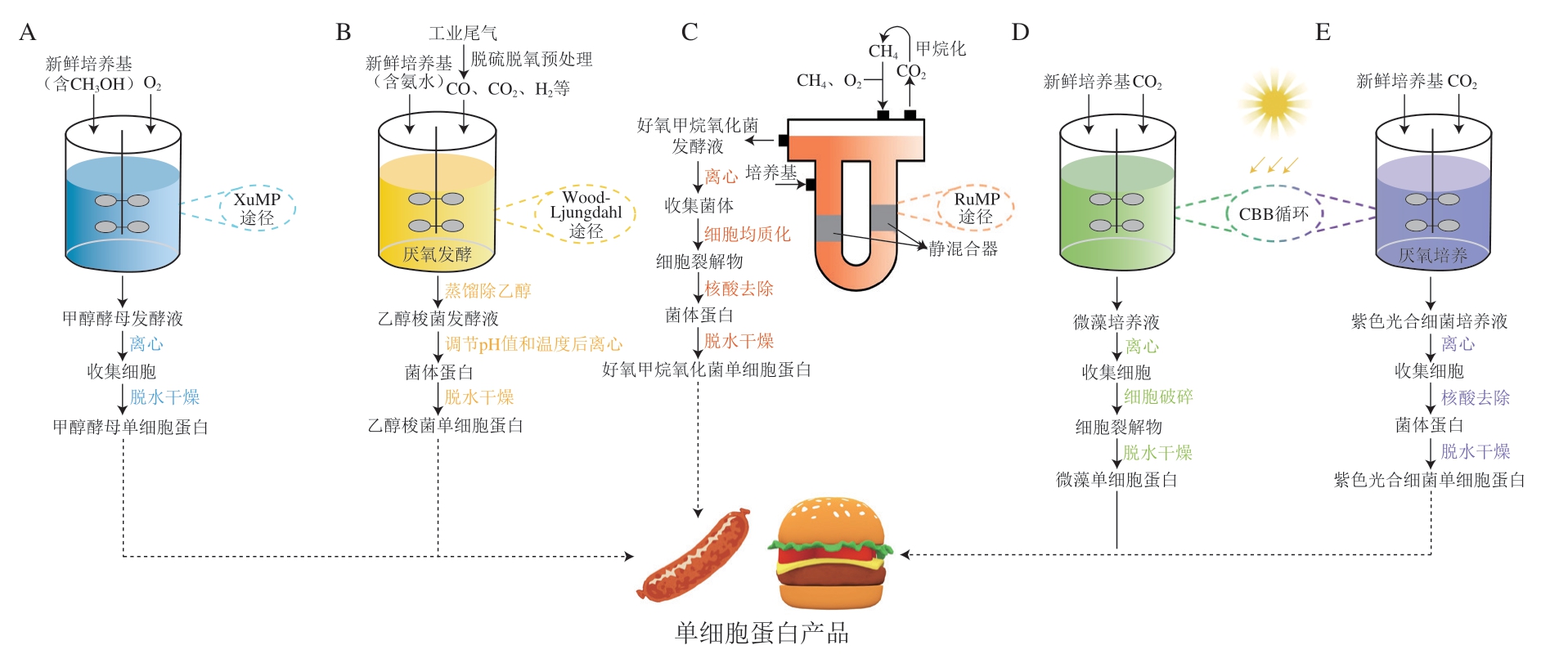
图1 天然微生物利用一碳底物生产单细胞蛋白的工艺流程
Fig.1 Flow chart for the microbial production of SCPs from single carbon substrates
A.甲醇酵母单细胞蛋白生产的工艺流程;B.乙醇梭菌单细胞蛋白生产的工艺流程[37];C.Calysta公司利用U形环流发酵罐生产好氧甲烷氧化菌单细胞蛋白的工艺流程[4,43];D.微藻单细胞蛋白生产的工艺流程[50-51];E.紫色光合细菌单细胞蛋白生产的工艺流程[30,56]。微藻和紫色光合细菌的培养设备包括开放式和封闭式两类,图中为培养设备的简单示意图。
紫色光合细菌单细胞蛋白的蛋白质含量高,含有丰富的必需氨基酸、类胡萝卜素、维生素和聚羟基脂肪酸酯(polyhydroxyalkanoates,PHA),营养价值较高,可用于研究开发功能性食品。目前紫色光合细菌单细胞蛋白主要用于生产饲料,而在食品工业中的应用报道较少,且紫色光合细菌单细胞蛋白商业化生产还处于早期阶段,需进一步研究开发新型紫色光合细菌PBR,使其具备稳定的高生产强度,同时降低生产成本[30]。
不同种类微生物利用一碳底物合成单细胞蛋白的特性如表1所示。
表1 不同种类微生物利用一碳底物合成单细胞蛋白的比较
Table 1 Comparison of SCP synthesis by different microbial species utilizing single carbon substrates

3 天然一碳利用微生物的代谢网络
天然微生物具有丰富的一碳代谢网络,利用这些代谢途径可以实现一碳化合物生产单细胞蛋白。但目前天然微生物的一碳利用效率较低,需要利用合成生物学手段对一碳代谢网络进行分析和改造,以提高微生物一碳利用效率。这样不仅可以高效生产单细胞蛋白,而且有效减少碳排放,助力“双碳”目标的实现[10-11]。当前主要的一碳代谢途径包括以下种类。
3.1 RuMP和XuMP途径
RuMP途径存在于甲基营养细菌中,例如甲醇芽孢杆菌和甲基营养型嗜甲基菌;而XuMP途径主要存在于甲基营养酵母中,包括毕赤酵母(Pichia pastoris)、多形汉逊酵母(Hansenula polymorpha)和博伊丁假丝酵母(Candida boidinii)[57]。RuMP、XuMP途径十分相似,都是甲醛结合戊糖进行碳原子重排,一碳分子后续经由糖酵解途径进入中心碳代谢,而戊糖的再生保证循环的持续运转,这两个途径的主要区别在于甲醛进入磷酸戊糖途径的方式。在RuMP途径中,甲醛在己糖磷酸合成酶(hexulose phosphate synthase,HPS)催化下可以与5-磷酸核酮糖(ribulose 5-phophate,Ru5P)结合生成6-磷酸己酮糖(hexulose 6-phosphate,H6P),然后在磷酸己糖异构酶(phosphohexulose isomerase,PHI)的作用下发生异构化,生成6-磷酸果糖(fructose 6-phosphate,F6P)进入中心碳代谢(图2A)。在XuMP途径中,在二羟丙酮合成酶(dihydroxyacetone synthase,DAS)的作用下,Xu5P的糖醛基团转移到甲醛上,生成3-磷酸甘油醛和二羟丙酮,二羟丙酮可利用二羟丙酮激酶(dihydroxyacetone kinase,DHAK)进一步转化为磷酸二羟丙酮(dihydroxyacetone phosphate,DHAP),从而进入中心代谢(图2B)[10]。
3.2 CBB循环
CBB循环是广泛存在于光合自养和化能自养微生物的一碳利用途径,包括微藻、蓝细菌、光合细菌和甲烷氧化菌等[11]。CBB循环的关键酶是RuBisCO,它催化CO2亲电加成到烯二醇形式的1,5-二磷酸核酮糖(ribulose 1,5-bisphosphate,RuBP),产生不稳定的C6中间体。C6中间体之后自发水解成两个3-磷酸甘油酸分子,在ATP水解驱动下再由NADPH进一步还原为3-磷酸甘油醛(图2C)。CBB循环生成1 个3-磷酸甘油醛分子需要消耗9 个ATP分子和6 个NADPH分子,能量利用效率较低,其关键酶RuBisCO的催化效率低且对底物CO2专一性差[58]。优化其关键酶可以提高CO2利用效率,如Durão等通过过表达辅助RuBisCO折叠的GroEL/ES伴侣蛋白基因和敲除用于RuBisCO组装的RbcX伴侣蛋白基因,将RuBisCO的CO2羧化效率提高了大约3 倍[59]。
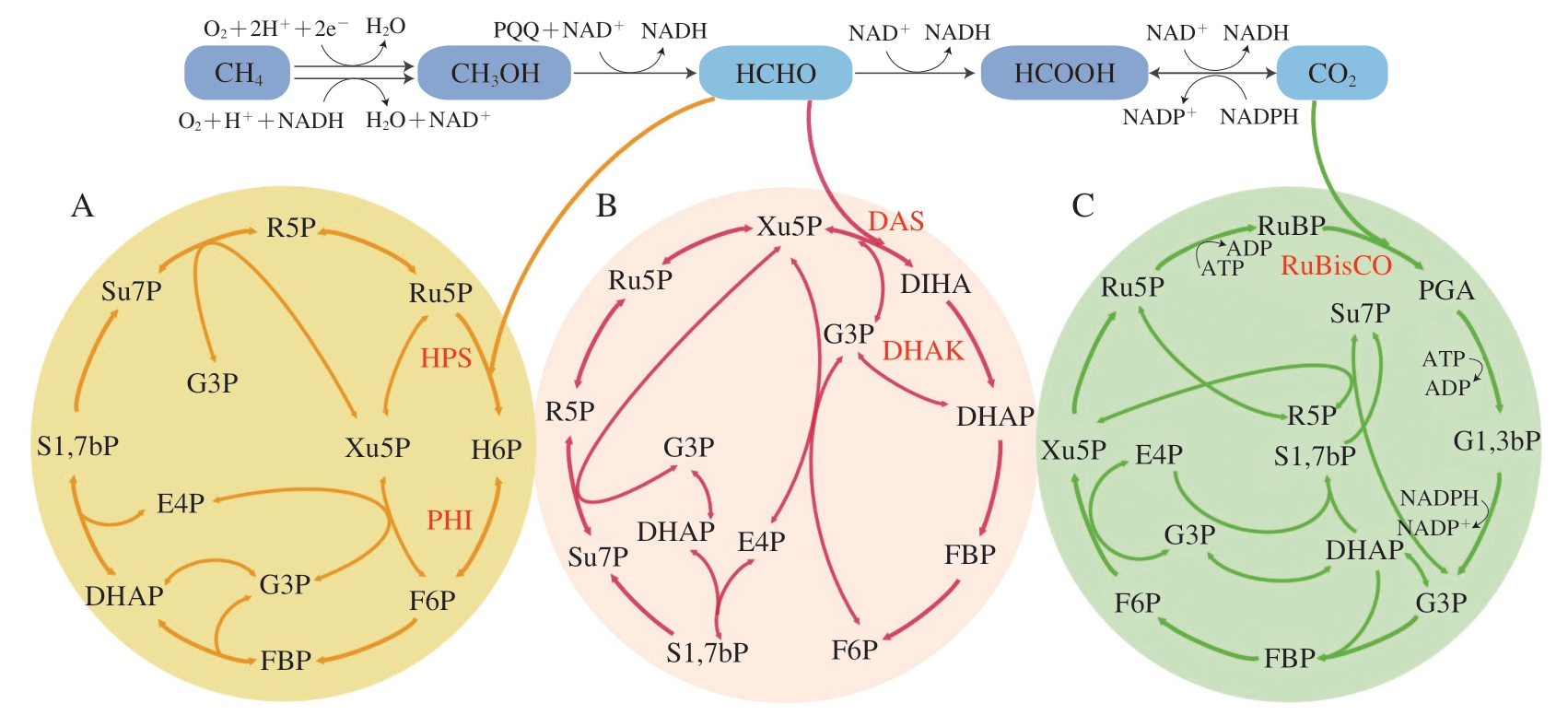
图2 基于戊糖磷酸途径的天然一碳利用途径
Fig.2 Pathways for the utilization of natural single carbon compounds based on pentose phosphate pathway
A.RuMP途径;B.XuMP途径;C.CBB循环。PGA.3-磷酸甘油酸(3-phosphoglycerate);G1,3bP.1,3-二磷酸甘油酸(glycerate 1,3-bisphosphate);G3P.3-磷酸甘油醛(glyceraldehyde 3-phosphate);FBP.1,6-二磷酸果糖(fructose 1,6-bisphosphate);DIHA.二羟丙酮(dihydroxyacetone);R5P.5-磷酸核糖(ribose 5-phosphate);E4P.4-磷酸赤藓糖(erythrose 4-phosphate);Su7P.7-磷酸景天庚酮糖(sedoheptulose 7-phosphate);S1,7bP.1,7-二磷酸景天庚酮糖(sedoheptulose 1,7-bisphosphate)。
3.3 丝氨酸循环
甲烷氧化菌等许多甲基营养菌可以通过丝氨酸循环来代谢利用甲烷、甲醇、甲醛和甲酸。如图3A所示,甲酸通过多步催化反应首先生成活性中间体——5,10-亚甲基-四氢叶酸,在丝氨酸羟甲基转移酶(serine hydroxymethyltransferase,SHMT)的作用下,5,10-亚甲基-四氢叶酸将其一碳单元转移至甘氨酸从而生成丝氨酸,并经后续多步催化被依次转化为丙酮酸、草酰乙酸、苹果酸等重要中间体,苹果酸则与辅酶A反应生成苹果酰辅酶A,再进一步生成乙醛酸和乙酰辅酶A,乙酰辅酶A作为重要的中心代谢产物可进入后续代谢途径中。丝氨酸循环生成1 分子乙酰辅酶A理论上需要消耗2 分子ATP和3 分子NADPH,还原力和ATP消耗较少。丝氨酸循环与中心碳代谢通路有较多重叠,因此在对该循环进行人工改造时需要考虑如何减少中心代谢通路的干扰[60],如Yu Hong等[61]通过引入丝氨酸脱水酶实现丝氨酸一步生成丙酮酸,改造了天然的丝氨酸循环。新的丝氨酸循环反应步骤较少,并且消除了影响甲酸利用效率的副反应。
3.4 Wood-Ljungdahl途径
Wood-Ljungdahl途径(也称还原性乙酰辅酶A途径)可将CO2和甲酸转化为乙酰辅酶A进入中心碳代谢,该途径需要金属离子和铁氧还蛋白的参与。还原性乙酰辅酶A途径的关键酶包括一氧化碳脱氢酶、甲酸脱氢酶和亚甲基呋喃脱氢酶,这些关键酶对氧敏感,该通路主要存在于化能自养厌氧微生物中,包括产乙酸菌(如杨氏梭菌(Clostridium ljungdahlii))和产甲烷菌[11,62],其中产乙酸菌通过H2或NADPH提供还原力,而产甲烷菌利用金属还原剂提供还原力。Wood-Ljungdahl途径固定1 分子CO2仅需要消耗1 分子ATP和2 分子NADPH,是一种能源利用效率高、生物质产量高的一碳利用途径[63](图3B)。调控该途径关键酶的表达可显著提高微生物合成单细胞蛋白的效率。Straub等在伍氏醋酸杆菌(Acetobacterium woodii)中选择性过表达了Wood-Ljungdahl途径中4 个关键酶的基因和与ATP生成相关的两个基因,提高了伍氏醋酸杆菌的生长速率[64]。
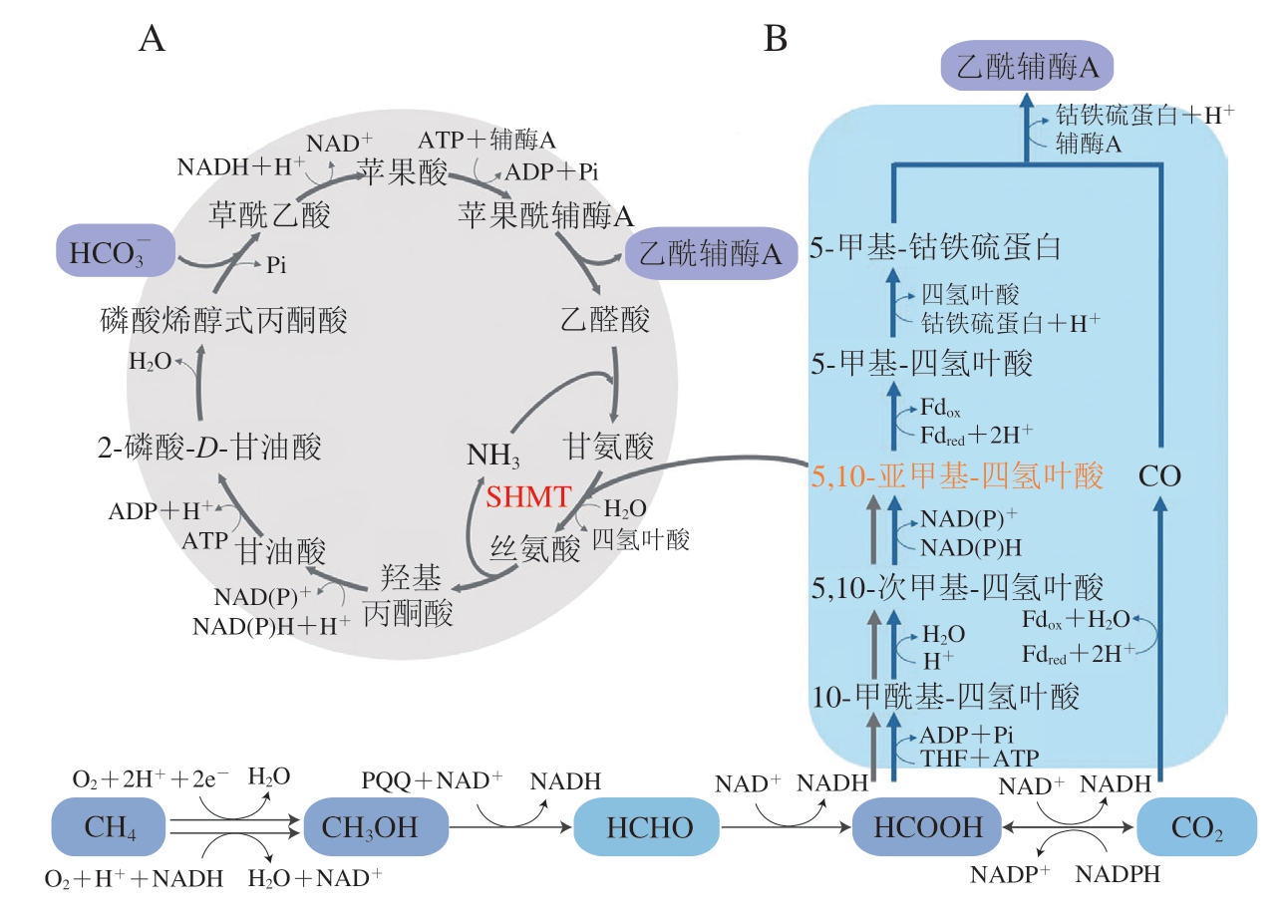
图3 基于5,10-亚甲基-四氢叶酸同化的天然一碳利用途径
Fig.3 Pathways for the utilization of natural single carbon compounds based on 5,10-methylenetetrahydrofolate assimilation
A.丝氨酸循环;B.Wood-Ljungdahl途径;Fdox.氧化态铁氧化还原蛋白;Fdred.还原态铁氧化还原蛋白。
3.5 围绕乙酰辅酶A到琥珀酰辅酶A的一碳利用途径
还原性三羧酸(reductive tricarboxylic acid,rTCA)循环、二羧酸/4-羟基丁酸(dicarboxylate/4-hydroxybutyrate,DC/HB)循环、3-羟基丙酸/4-羟基丁酸(3-hydroxypropionate/4-hydroxybutyrate,HP/HB)循环和3-羟基丙酸(3-hydroxypropionate,3-HPA)双循环是围绕两种常见的代谢物乙酰辅酶A和琥珀酰辅酶A演化而来,并且每个循环与该组中的另一个循环共享多个反应[65]。
rTCA循环通过逆转三羧酸循环固定了2 分子CO2,它主要存在于变形菌、绿硫细菌和水生细菌中[28]。rTCA循环利用铁氧还蛋白和NADPH作为电子供体,该循环生成1 分子乙酰辅酶A需要消耗2 分子ATP,耗能较少[58]。rTCA循环的关键步骤是柠檬酸分解成乙酰辅酶A和草酰乙酸。一直以来认为,该柠檬酸分解反应由可逆的ATP依赖性柠檬酸裂合酶(adenosine triphosphate dependent citrate lyase,ACL)催化或者由柠檬酰辅酶A合成酶和柠檬酰辅酶A裂解酶催化的两步反应来代替,直到2018年才在乙酸脱硫杆菌中发现了具有可逆活性的柠檬酸合酶,该酶不仅能够催化乙酰辅酶A和草酰乙酸生成柠檬酸,还可以催化柠檬酸分解反应,为该途径的优化提供了新的思路[66-67]。
DC/HB循环可通过丙酮酸合酶固定1 分子CO2,还可利用磷酸烯醇丙酮酸羧化酶固定1 分子的![]() 。DC/HB循环合成1 分子丙酮酸需要消耗5 分子ATP,其关键酶是4-羟基丁酰辅酶A脱水酶,它是一种含有铁硫中心和FAD的酶[68-69]。目前在热变形菌(Thermoproteales)、硫还原球菌(Desulfurococcales)等厌氧菌和兼性需氧菌中都发现了DC/HB循环[68]。
。DC/HB循环合成1 分子丙酮酸需要消耗5 分子ATP,其关键酶是4-羟基丁酰辅酶A脱水酶,它是一种含有铁硫中心和FAD的酶[68-69]。目前在热变形菌(Thermoproteales)、硫还原球菌(Desulfurococcales)等厌氧菌和兼性需氧菌中都发现了DC/HB循环[68]。
HP/HB循环和3-HPA双循环通过乙酰辅酶A羧化酶和丙酰辅酶A羧化酶吸收2 分子![]() [65]。3-HPA双循环合成1 分子丙酮酸需要消耗7 分子ATP,而HP/HB循环需要消耗9 分子ATP,这两个循环都具有非常高的能量需求[68],但二者对O2的耐受性高且可利用
[65]。3-HPA双循环合成1 分子丙酮酸需要消耗7 分子ATP,而HP/HB循环需要消耗9 分子ATP,这两个循环都具有非常高的能量需求[68],但二者对O2的耐受性高且可利用![]() 。细胞内
。细胞内![]() 的浓度比细胞内CO2的浓度高得多,所以可以利用
的浓度比细胞内CO2的浓度高得多,所以可以利用![]() 成为其显著的优势。HP/HB循环中的关键酶是4-羟基丁酰辅酶A脱水酶,该循环主要存在于有氧泉古菌等化能自养生物。3-HPA双循环中的关键酶包括丙二酰辅酶A还原酶和丙酰辅酶A合酶,该循环存在于绿色非硫细菌以及其他光能自养微生物[62,68]。
成为其显著的优势。HP/HB循环中的关键酶是4-羟基丁酰辅酶A脱水酶,该循环主要存在于有氧泉古菌等化能自养生物。3-HPA双循环中的关键酶包括丙二酰辅酶A还原酶和丙酰辅酶A合酶,该循环存在于绿色非硫细菌以及其他光能自养微生物[62,68]。
围绕乙酰辅酶A到琥珀酰辅酶A的一碳利用途径如图4所示。
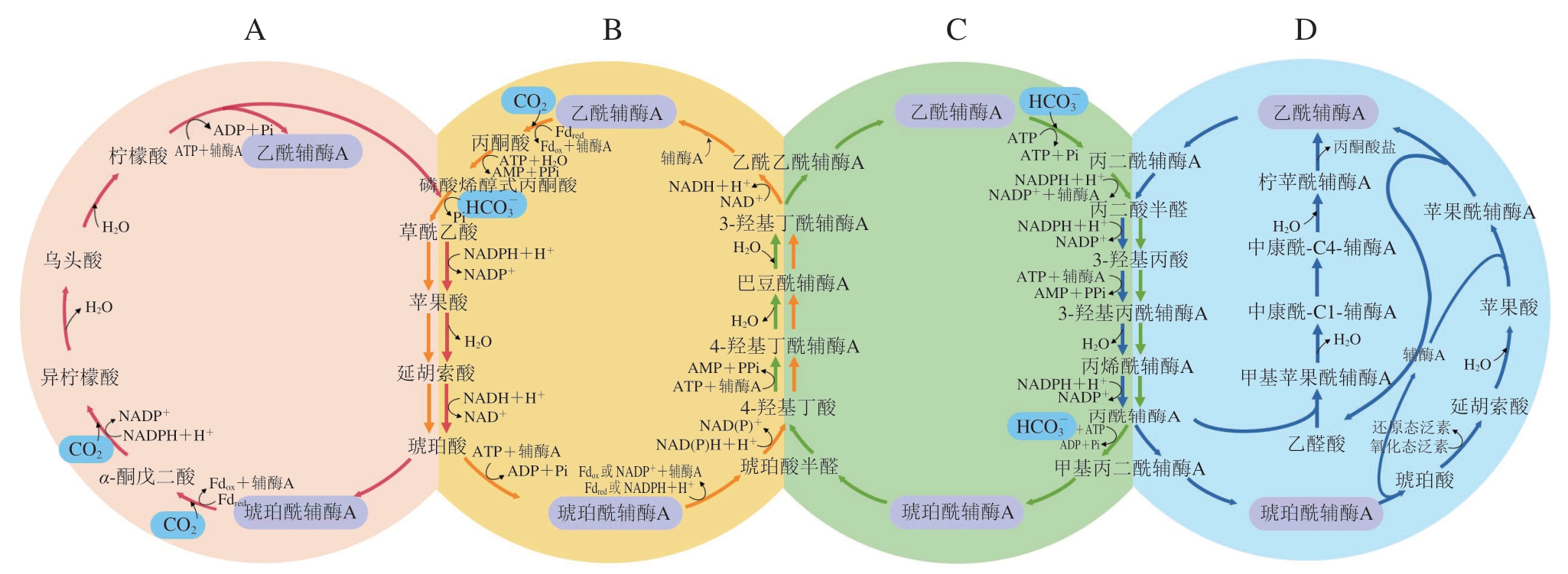
图4 围绕乙酰辅酶A到琥珀酰辅酶A的天然一碳利用途径
Fig.4 Pathways for the utilization of natural single carbon compounds with transformation from acetyl-CoA to succinyl-CoA
A.rTCA循环;B.DC/HB循环;C.HP/HB循环;D.3-HPA双循环。
4 结语
作为一种新型食品蛋白,微生物单细胞蛋白不仅蛋白质含量高,还含有糖类、脂质、维生素、无机盐和必需氨基酸,具有很高的营养价值。目前发展和应用单细胞蛋白已经成为全球广受关注的食品创新领域,许多企业和组织将业务聚焦于单细胞蛋白生产,将其转化为更可口、更营养的食品原料,不断丰富和改善人类食品[70]。其中,微生物利用一碳化合物生产单细胞蛋白,不仅原料来源广、生产周期短、生产设备占地面积小、不受天气和气候变化影响、能源利用效率高,还能促进一碳资源的清洁利用,减少碳排放。
基于丰富的一碳代谢途径,目前已实现天然一碳利用微生物生产单细胞蛋白,但由于这类微生物存在一碳利用效率低、单细胞蛋白生产成本高的问题,因此利用合成生物学和基因工程手段改良微生物性状,进一步强化底物利用效率,有望助力实现单细胞蛋白的工业化生产[71]。微藻和光合细菌通过CBB循环以CO2为碳源生产单细胞蛋白,利用基因工程方法优化其关键酶可提高CO2利用效率,进一步提高单细胞蛋白生产效率[9]。在酿酒酵母等传统被认为可食用的菌种中构建异源一碳利用途径生产单细胞蛋白也是一种新的研究方向[72-73]。酿酒酵母作为真核模式生物,具有安全无毒、易于生产、基因背景清晰,基因操作容易等优点。改造模式微生物利用一碳化合物生产单细胞蛋白,不仅可以拓展食品蛋白供给来源,还可以促进一碳资源的高效利用。
目前利用一碳化合物实现大规模生产单细胞蛋白的微生物种类主要包括细菌和微藻。这两类微生物单细胞蛋白的蛋白质含量较高,但微藻细胞壁较厚,需要经过细胞破碎来提高单细胞蛋白的可消化性;而细菌蛋白的核酸(尤其是RNA)含量较高,需要增加核酸脱除工艺。与动物和植物蛋白生产相比,目前微生物利用一碳底物生产单细胞蛋白供人类食用成本较高,且相关培养工艺和生产技术仍不成熟。一些微生物单细胞蛋白如乙醇梭菌蛋白已用作饲料蛋白生产[41],可通过升级生产工艺提高单细胞蛋白的安全性和可接受度,进而用于生产食品蛋白。此外,虽然微生物单细胞蛋白可用于生产高营养食品原料、可直接改善终产品的功能属性,但目前受众面较窄。未来在保持其营养价值的前提下,既要确保单细胞蛋白的安全性和功能性,更要注重产品的颜色、气味、口味等感官特性为食用者所喜欢,从而提高产品在消费者中的可接受度,实现微生物单细胞蛋白食品的产业化发展。
[1]LINDER T.Making the case for edible microorganisms as an integral part of a more sustainable and resilient food production system[J].Food Security,2019,11(2):265-278.DOI:10.1007/s12571-019-00912-3.
[2]侯悦,张彦龙,张多英,等.细菌单细胞蛋白:机遇、挑战与前景[J].生物技术,2020,30(6):615-621.DOI:10.16519/j.cnki.1004-311x.2020.06.0097.
[3]刘素素,沙磊.植物蛋白基肉制品的营养安全性分析[J].食品与发酵工业,2021,47(8):297-303.DOI:10.13995/j.cnki.11-1802/ts.025807.
[4]RITALA A,HAKKINEN S T,TOIVARI M,et al.Single cell protein-state-of-the-art,industrial landscape and patents 2001–2016[J].Frontiers in Microbiology,2017,8:2009.DOI:10.3389/fmicb.2017.02009.
[5]SEMBA R D.The rise and fall of protein malnutrition in global health[J].Annals of Nutrition and Metabolism,2016,69(2):79-88.DOI:10.1159/000449175.
[6]SILLMAN J,NYGREN L,KAHILUOTO H,et al.Bacterial protein for food and feed generated via renewable energy and direct air capture of CO2:can it reduce land and water use[J].Global Food Security,2019,22:25-32.DOI:10.1016/j.gfs.2019.09.007.
[7]UGALDE U O,CASTRILLO J I.Single cell proteins from fungi and yeasts[J].Applied Mycology and Biotechnology,2002,2:123-149.DOI:10.1016/s1874-5334(02)80008-9.
[8]BRATOSIN B C,DARJAN S,VODNAR D C.Single cell protein:a potential substitute in human and animal nutrition[J].Sustainability,2021,13(16):9284.DOI:10.3390/su13169284.
[9]张虎,谭英南,朱瑞鸿,等.微藻生物固碳技术在“双碳”目标中的应用前景[J/OL].生物加工过程.(2022-07-14)[2022-08-27].https://kns.cnki.net/kcms/detail/32.1706.q.20220713.1523.002.html.
[10]郭姝媛,吴良焕,刘香健,等.微生物中一碳代谢网络构建的进展与挑战[J].合成生物学,2022,3(1):116-137.DOI:10.12211/2096-8280.2021-079.
[11]史硕博,孟琼宇,乔玮博,等.塑造低碳经济的第三代固碳生物炼制[J].合成生物学,2020,1(1):44-59.DOI:10.12211/2096-8280.2020-015.
[12]YANG X,YUAN Q Q,LUO H,et al.Systematic design and in vitro validation of novel one-carbon assimilation pathways[J].Metabolic Engineering,2019,56:142-153.DOI:10.1016/j.ymben.2019.09.001.
[13]GASSLER T,SAUER M,GASSER B,et al.The industrial yeast Pichia pastoris is converted from a heterotroph into an autotroph capable of growth on CO2[J].Nature Biotechnology,2020,38(2):210-216.DOI:10.1038/s41587-019-0363-0.
[14]CHEN F Y H,JUNG H W,TSUEI C Y,et al.Converting Escherichia coli to a synthetic methylotroph growing solely on methanol[J].Cell,2020,182(4):933-946.DOI:10.1016/j.cell.2020.07.010.
[15]黄群,马美湖,杨抚林,等.单细胞蛋白及其在食品加工中应用[J].粮食与油脂,2003(9):17-19.DOI:10.3969/j.issn.1008-9578.2003.09.006.
[16]MATASSA S,BOON N,PIKAAR I,et al.Microbial protein:future sustainable food supply route with low environmental footprint[J].Microbial Biotechnology,2016,9(5):568-575.DOI:10.1111/1751-7915.12369.
[17]王宇灵,覃瑞,刘虹,等.单细胞蛋白应用于食品工业的现状和展望[J].中国食物与营养,2019,25(10):29-32.DOI:10.19870/j.cnki.11-3716/ts.2019.10.006.
[18]陈峰,杨帅伶,刘宾.微藻蛋白质及其在食品中的应用研究进展[J].中国食品学报,2022,22(6):21-32.DOI:10.16429/j.1009-7848.2022.06.003.
[19]TORRES-TIJI Y,FIELDS F J,MAYFIELD S P.Microalgae as a future food source[J].Biotechnology Advances,2020,41:107536.DOI:10.1016/j.biotechadv.2020.107536.
[20]JACH M E,SEREFKO A,ZIAJA M,et al.Yeast protein as an easily accessible food source[J].Metabolites,2022,12(1):63.DOI:10.3390/metabo12010063.
[21]CHEN C,TANG T,SHI Q W,et al.The potential and challenge of microalgae as promising future food sources[J].Trends in Food Science &Technology,2022,126:99-112.DOI:10.1016/j.tifs.2022.06.016.
[22]ATITALLAH A B,HENTATI F,DAMMAK M,et al.Effect of microalgae incorporation on quality characteristics and functional and antioxidant capacities of ready-to-eat fish burgers made from common carp (Cyprinus carpio)[J].Applied Sciences,2019,9(9):1830.DOI:10.3390/app9091830.
[23]王宝贝,蔡舒琳,李丽婷,等.小球藻在食品中的应用研究进展[J].食品工业科技,2017,38(17):341-346;352.DOI:10.13386/j.issn1002-0306.2017.17.066.
[24]MONTE J,RIBEIRO C,PARREIRA C,et al.Biorefinery of Dunaliella salina:sustainable recovery of carotenoids,polar lipids and glycerol[J].Bioresource Technology,2020,297:122509.DOI:10.1016/j.biortech.2019.122509.
[25]NISHSHANKA G K S H,LIYANAARACHCHI V C,NIMARSHANA P H V,et al.Haematococcus pluvialis:a potential feedstock for multiple-product biorefining[J].Journal of Cleaner Production,2022,344:131103.DOI:10.1016/j.jclepro.2022.131103.
[26]GARATTINI S,PAGLIALUNGA S,SCRIMSHAW N S.Single-cell protein:safety for animal and human feeding[M].Oxford:Pergamon Press,1979.
[27]吴文礼.食品微生物学进展[M].北京:中国农业科学技术出版社,2002:185.
[28]ANUPAMA,RAVINDRA P.Value-added food:single cell protein[J].Biotechnology Advances,2000,18(6):459-479.DOI:10.1016/s0734-9750(00)00045-8.
[29]肖静,邹萍萍,田琳,等.动物性食品过敏导致的食品安全风险及其控制措施[J].食品工业,2020,41(5):245-249.
[30]HULSEN T,BARNES A C,BATSTONE D J,et al.Creating value from purple phototrophic bacteria via single-cell protein production[J].Current Opinion in Biotechnology,2022,76:102726.DOI:10.1016/j.copbio.2022.102726.
[31]高琳惠,蔡鹏,周雍进.甲醇酵母代谢工程研究进展[J].生物工程学报,2021,37(3):966-979.DOI:10.13345/j.cjb.200645.
[32]高教琪,周雍进.甲醇生物转化的机遇与挑战[J].合成生物学,2020,1(2):158-173.DOI:10.12211/2096-8280.2020-017.
[33]JOHNSON E A.Biotechnology of non-Saccharomyces yeasts-the basidiomycetes[J].Applied Microbiology and Biotechnology,2013,97(17):7563-7577.DOI:10.1007/s00253-013-5046-z.
[34]BUSTOS C,QUEZADA J,VEAS R,et al.Advances in cell engineering of the Komagataella phaffii for recombinant protein production[J].Metabolites,2022,12(4):346.DOI:10.3390/metabo12040346.
[35]SCHWARZHANS J P,LUTTERMANN T,GEIER M,et al.Towards systems metabolic engineering in Pichia pastoris[J].Biotechnology Advances,2017,35(6):681-710.DOI:10.1016/j.biotechadv.2017.07.009.
[36]LIEW F,HENSTRA A M,KOPKE M,et al.Metabolic engineering of Clostridium autoethanogenum for selective alcohol production[J].Metabolic Engineering,2017,40:104-114.DOI:10.1016/j.ymben.2017.01.007.
[37]蔺兴法,邹方起,莫志朋,等.钢铁工业尾气发酵乙醇醪液菌体蛋白的制备工艺[J].化工管理,2022(11):143-145.DOI:10.19900/j.cnki.ISSN1008-4800.2022.11.043.
[38]HEFFERNAN J K,VALGEPEA K,LEMGRUBER R S P,et al.Enhancing CO2-valorization using Clostridium autoethanogenum for sustainable fuel and chemicals production[J].Frontiers in Bioengineering and Biotechnology,2020,8:204.DOI:10.3389/fbioe.2020.00204.
[39]贾德臣,姜卫红,顾阳.食气梭菌的研究进展[J].微生物学通报,2019,46(2):374-387.DOI:10.13344/j.microbiol.china.180841.
[40]徐惠娟,梁翠谊,许敬亮,等.CO一步法C.autoethanogenum发酵产乙醇的工艺研究[J].农业工程学报,2017,33(23):246-251.DOI:10.11975/j.issn.1002-6819.2017.23.032.
[41]赵广立.乙醇梭菌蛋白何以成了“香饽饽”[N].中国科学报,2021-11-02(001).DOI:10.28514/n.cnki.nkxsb.2021.003586.
[42]魏洪城,郁欢欢,陈晓明,等.乙醇梭菌蛋白替代豆粕对草鱼生长性能、血浆生化指标及肝胰脏和肠道组织病理的影响[J].动物营养学报,2018,30(10):4190-4201.DOI:103969/j.issn.1006-267x.2018.10.045.
[43]高子熹,郭树奇,费强.生物转化温室气体生产单细胞蛋白的研究进展[J].化工学报,2021,72(6):3202-3214.DOI:10.11949/0438-1157.20201458.
[44]严程,梅娟,赵由才.好氧甲烷氧化菌及其工程应用进展[J].生物工程学报,2022,38(4):1322-1338.DOI:10.13345/j.cjb.210418.
[45]蔡朝阳,何崭飞,胡宝兰.甲烷氧化菌分类及代谢途径研究进展[J].浙江大学学报(农业与生命科学版),2016,42(3):273-281.DOI:10.3785/j.issn.1008-9209.2015.11.292.
[46]VERBEECK K,VRIEZE J D,PIKAAR I,et al.Assessing the potential for up-cycling recovered resources from anaerobic digestion through microbial protein production[J].Microbial Biotechnology,2021,14(3):897-910.DOI:10.1111/1751-7915.13600.
[47]JONES S W,KARPOL A,FRIEDMAN S,et al.Recent advances in single cell protein use as a feed ingredient in aquaculture[J].Current Opinion in Biotechnology,2020,61:189-197.DOI:10.1016/j.copbio.2019.12.026.
[48]WEI Li,WANG Qintao,XIN Yi,et al.Enhancing photosynthetic biomass productivity of industrial oleaginous microalgae by overexpression of RuBisCO activase[J].Algal Research,2017,27:366-375.DOI:10.1016/j.algal.2017.07.023.
[49]于殿江,施定基,何培民,等.微藻规模化培养研究进展[J].微生物学报,2021,61(2):333-345.DOI:10.13343/j.cnki.wsxb.20200214.
[50]刘玉环,黄磊,王允圃,等.大规模微藻光生物反应器的研究进展[J].生物加工过程,2016,14(1):65-73.DOI:10.3969/j.issn.1672-3678.2016.01.013.
[51]JANSSEN M,WIJFFELS R H,BARBOSA M J.Microalgae based production of single-cell protein[J].Current Opinion in Biotechnology,2022,75:102705.DOI:10.1016/j.copbio.2022.102705.
[52]PAN Minmin,SU Yanyan,ZHU Xinyu,et al.Bioelectrochemically assisted sustainable conversion of industrial organic wastewater and clean production of microalgal protein[J].Resources Conservation and Recycling,2021,168:105441.DOI:10.1016/j.resconrec.2021.105441.
[53]LI X,WANG X Q,DUAN C L,et al.Biotechnological production of astaxanthin from the microalga Haematococcus pluvialis[J].Biotechnology Advances,2020,43:107602.DOI:10.1016/j.biotechadv.2020.107602.
[54]王万能,陈国平,胡宗利,等.紫色光合细菌捕获太阳能的分子机理[J].应用与环境生物学报,2011,17(1):138-143.DOI:10.3724/SP.J.1145.2011.00138.
[55]NYYSSOLA A,SUHONEN A,RITALA A,et al.The role of single cell protein in cellular agriculture[J].Current Opinion in Biotechnology,2022,75:102686.DOI:10.1016/j.copbio.2022.102686.
[56]HULSEN T,STEGMAN S,BATSTONE D J,et al.Naturally illuminated photobioreactors for resource recovery from piggery and chicken-processing wastewaters utilising purple phototrophic bacteria[J].Water Research,2022,214:118194.DOI:10.1016/j.watres.2022.118194.
[57]ZHU T C,ZHAO T X,BANKEFA O E,et al.Engineering unnatural methylotrophic cell factories for methanol-based biomanufacturing:challenges and opportunities[J].Biotechnology Advances,2020,39:107467.DOI:10.1016/j.biotechadv.2019.107467.
[58]BERG I A.Ecological aspects of the distribution of different autotrophic CO2 fixation pathways[J].Applied and Environmental Microbiology,2011,77(6):1925-1936.DOI:10.1128/AEM.02473-10.
[59]DURÃO P,AIGNER H,NAGY P,et al.Opposing effects of folding and assembly chaperones on evolvability of RuBisCO[J].Nature Chemical Biology,2015,11(2):148-155.DOI:10.1038/nchembio.1715.
[60]徐蓉,邓王姝颖,姜卫红,等.甲酸生物利用的研究进展[J].生物工程学报,2020,36(6):1031-1040.DOI:10.13345/j.cjb.190420.
[61]YU Hong,LIAO J C.A modified serine cycle in Escherichia coli coverts methanol and CO2 to two-carbon compounds[J].Nature Communications,2018,9:3992.DOI:10.1038/s41467-018-06496-4.
[62]KUMAR M,SUNDARAM S,GNANSOUNOU E,et al.Carbon dioxide capture,storage and production of biofuel and biomaterials by bacteria:a review[J].Bioresource Technology,2018,247:1059-1068.DOI:10.1016/j.biortech.2017.09.050.
[63]SCHUCHMANN K,MULLER V.Autotrophy at the thermodynamic limit of life:a model for energy conservation in acetogenic bacteria[J].Nature Reviews Microbiology,2014,12(12):809-821.DOI:10.1038/nrmicro3365.
[64]STRAUB M,DEMLER M,BOTZ D W,et al.Selective enhancement of autotrophic acetate production with genetically modified Acetobacterium woodii[J].Journal of Biotechnology,2014,178:67-72.DOI:10.1016/j.jbiotec.2014.03.005.
[65]王凯,刘子鹤,陈必强,等.微生物利用二氧化碳合成燃料及化学品:第三代生物炼制[J].合成生物学,2020,1(1):60-70.DOI:10.12211/2096-8280.2020-058.
[66]MALL A,SOBOTTA J,HUBER C,et al.Reversibility of citrate synthase allows autotrophic growth of a thermophilic bacterium[J].Science,2018,359:563-567.DOI:10.1126/science.aao2410.
[67]NUNOURA T,CHIKARAISHI Y,IZAKI R,et al.A primordial and reversible TCA cycle in a facultatively chemolithoautotrophic thermophile[J].Science,2018,359:559-563.DOI:10.1126/science.aao3407.
[68]EVEN A B,NOOR E,MILO R.A survey of carbon fixation pathways through a quantitative lens[J].Journal of Experimental Botany,2012,63(6):2325-2342.DOI:10.1093/jxb/err417.
[69]FUCHS G.Alternative pathways of carbon dioxide fixation:Insights into the early evolution of life[J].Annual Review of Microbiology,2011,65(1):631-658.DOI:10.1146/annurev-micro-090110-102801.
[70]BANKS M,JOHNSON R,GIVER L,et al.Industrial production of microbial protein products[J].Current Opinion in Biotechnology,2022,75:102707.DOI:10.1016/j.copbio.2022.102707.
[71]BALAGURUNATHAN B,LING H,CHOI W J,et al.Potential use of microbial engineering in single-cell protein production[J].Current Opinion in Biotechnology,2022,76:102740.DOI:10.1016/j.copbio.2022.102740.
[72]CRUZ J G,MACHENS F,MESSERSCHMIDT K,et al.Core catalysis of the reductive glycine pathway demonstrated in yeast[J].ACS Synthetic Biology,2019,8(5):911-917.DOI:10.1021/acssynbio.8b00464.
[73]DAI Z,GU H,ZHANG S,et al.Metabolic construction strategies for direct methanol utilization in Saccharomyces cerevisiae[J].Bioresource Technology,2017,245:1407-1412.DOI:10.1016/j.biortech.2017.05.100.
