肉制品在居民膳食结构中占有重要地位,为消费者提供优质的蛋白质、不饱和脂肪酸、维生素等营养物质[1]。然而,肉制品加工时过多添加NaCl易使消费者血压升高,增加心脑血管疾病的风险。《健康中国行动(2019 2030年)》指出“我国人均食盐摄入量约10.5 g/d”,远超世界卫生组织推荐的人均摄入量(5 g/d)。肉制品是消费者摄入食盐的主要来源,从肉制品中摄入食盐量约占总摄入食盐量的15%~25%[2]。肉品工业须积极结合减盐计划,才能有效实现人均食盐摄入量降低的目标。低温乳化型肉制品(如法兰克福香肠、维也纳香肠、博洛尼亚香肠等)是优质蛋白质的来源,但是,该类产品食盐含量为2~4 g/100 g[3-4],远高于乳制品和植物蛋白制品。减盐会降低肌原纤维蛋白(myofibrillar protein,MP)的持水能力和结合脂肪能力,导致产品品质明显下降,因此,如何在制备低盐肉制品(盐含量0.6~1.4 g/100 g)的同时较好地保持水分和脂肪结合能力是肉品蛋白质功能特性研究领域的巨大挑战。
MP是赋予乳化型肉制品良好乳化稳定性的主要蛋白质[5],也被认为是一种理想的封装材料或乳液系统递送材料[6-7]。正常盐含量条件下MP具有良好的溶解性、乳化性等,可以满足肉品加工的需求。而在低盐含量条件下MP易聚集成纤维丝,其功能性基团由于蛋白的聚集而被掩埋在内部,导致溶解性和乳化特性变差等[8-9],限制了MP的应用范围,鲜见其应用在流体类、蛋白类饮品中的相关研究[4]。
近几年,学者们逐渐关注超声处理对畜禽肌肉蛋白乳化特性的影响[10]。Liu Haotian等[11]通过不同功率超声(20 kHz、100~600 W、15 min)处理极低离子强度(5 mmol/L NaH2PO4、1 mol/L乙二胺四乙酸,pH 7.0)下猪肉MP,发现超声处理改善了猪肉MP在极低离子强度下的乳液物理稳定性。Chen Jiahui等[12]通过不同频率超声(频率20、23 kHz和20/23 kHz,时间5 min)处理正常盐含量(0.6 mol/L)条件下鸡肉MP,发现20/23 kHz超声处理MP的EAI、ESI以及乳液的贮藏稳定性明显高于其他组。本课题组前期研究了不同超声波条件(20 kHz,450 W,0、3、6 min)处理对正常盐含量条件下(0.6 mol/L)鸡肉MP结构和乳化特性的影响[13-14],证实了超声波具有抑制肌原纤维自组装的作用,能够提升MP的乳化特性。低盐状态下MP自组装程度会增加[15],而目前有关超声处理对低钠条件下MP的乳液稳定性、油-水界面性质、微观结构等的研究报道仍然较少,因此,本实验主要探讨延长超声时间(0、3、6、9、12 min)对低钠条件下(0.15 mol/L)鸡肉MP的乳化稳定性和乳液流变性质的影响,分析乳液的粒径分布、Zeta-电位、微观结构和油-水界面性质特征等,以期为低钠条件下鸡肉MP超声波加工的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
新鲜鸡胸肉购于本地大张超市。剔除鸡胸肉中的结缔组织和脂肪,后经绞肉机搅碎,混合均匀后用真空包装袋分装,每袋150 g,真空包装后贮藏于-20 ℃冰箱中,2 周内用完。
金龙鱼大豆油 益海嘉里金龙鱼粮油食品有限公司;乙二醇-双-(2-氨基乙醚)四乙酸(glycol-bis-(2-aminoethylether)-N,N,N’,N’-tetraacetic acid,EGTA)北京索莱宝科技有限公司;十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、牛血清白蛋白(纯度98%) 上海源叶生物科技有限公司;所用试剂均为分析纯及以上。
1.2 仪器与设备
GM200型搅碎机 德国Restch公司;Ultra Turrax T-25 BASIC高速匀浆机 德国IKA公司;SCIENTZIID超声波破碎仪 宁波新芝生物科技股份有限公司;CR-GIII高速冷冻离心机 日本日立公司;TU-1810分光光度计 北京普析通用仪器设备有限责任公司;Ultraturrax T25高速分散器 德国IKA公司;Discovery动态流变仪 美国TA仪器公司;Zetasizer Nano ZS 90激光粒度仪 英国Malvern公司;LS13320激光粒度仪美国Beckman公司;K100自动界面张力仪 德国Krüss公司;BX53M偏光显微镜 日本奥林巴斯株式会社;Regulus 8100冷场发射扫描电子显微镜 日本日立有限公司。
1.3 方法
1.3.1 鸡肉肌原纤维蛋白的提取
MP的提取参考Li Ke等[13]的方法。鸡胸肉在4 ℃冰箱中解冻12 h,然后与提取缓冲液(10 mmol/L Na2HPO4/NaH2PO4、0.1 mol/L NaCl、2 mmol/L MgCl2、1 mmol/L EGTA、pH 7.0、4 ℃)以质量体积比1∶4在冰浴条件下用Ultra Turrax T-25 BASIC高速匀浆机均质(10 000 r/min)均质3 次,每次30 s;所得肉浆用20 目过滤网(孔径0.9 mm)过滤后,过滤液以2 000 g离心15 min,收集沉淀物质即得粗MP沉淀。上述步骤重复两次,得到纯度更高的MP沉淀。将此MP沉淀分散在4 倍体积的提取液(0.1 mol/L NaCl)中,在冰浴条件下以10 000 r/min均质3 次,每次30 s,按照之前的条件过滤后,滤液在2 000 r/min下离心15 min,再重复上述步骤两次,得到纯化的MP。整个提取过程在4 ℃下进行。使用结晶牛血清白蛋白作为标准蛋白质,采用双缩脲法测定MP的质量浓度。将提取的MP放入4 ℃冰箱中保存,48 h内用完。
1.3.2 超声处理
参考Li Ke等[13]的方法,将1.3.1节提取的MP用磷酸盐缓冲液(20 mmol/L Na2HPO4/NaH2PO4、0.15 mol/L NaCl,pH 7.0,下同)溶解并调整质量浓度至20 mg/mL,取70 g上述MP溶液于100 mL烧杯中,超声波破碎仪探头浸入液面下25 mm处进行超声处理。超声处理参数:频率20 kHz、功率450 W;工作模式:超声2 s,休息2 s,处理时间为0、3、6、9、12 min。整个超声处理过程温度不高于20 ℃,处理后的样品于4 ℃下保存,48 h内使用完毕。
1.3.3 MP乳液乳化活性、乳化稳定性分析
1.3.3.1 MP乳液的制备
取20 mg/mL 1.3.2节所制备MP溶液与大豆油按照4∶1的体积比混合于直径为40 mm的长玻璃筒内。用Ultraturrax T25高速分散器以10 000 r/min均质混合溶液3 次,每次30 s,两次均质之间间隔30 s,得到MP乳液。整个制备过程在冰浴条件下进行。
1.3.3.2 MP乳化活性指数、乳化稳定性指数的测定
均质后的乳液于0 min和10 min时各吸取50 μL,然后加入5 mL 0.1 g/100 mL SDS溶液充分混合。以SDS溶液为空白,在500 nm波长处测定吸光度。乳化活性指数(emulsifying activity index,EAI)和乳液稳定性指数(emulsion stability index,ESI)分别通过公式(1)、(2)计算。
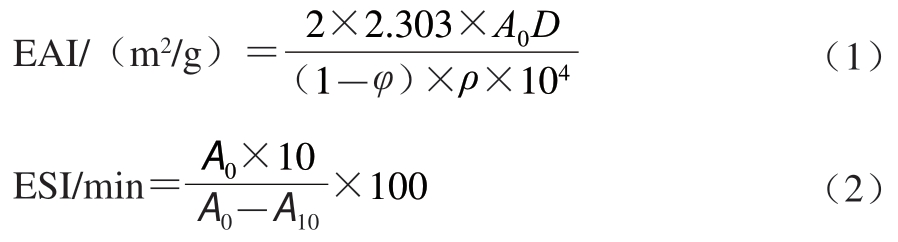
式中:A0和A10分别为0 min和10 min时的吸光度;D为稀释倍数(100);φ是油相体积分数(20%);ρ为蛋白质量浓度/(g/mL)。
1.3.4 MP乳液不稳定性指数的测定
根据1.3.3.1节方法制备MP乳液(下同),取20 mL新鲜乳液于Turbiscan稳定性分析仪专用的样品瓶中进行测试,测试程序为每60 s扫描一次,扫描总时间为3 600 s。在本研究中,由于样品是不透光的,所以通过样品的背散射光强信号变化来计算乳液体系的不稳定性指数(turbiscan stability index,TSI)。
1.3.5 MP乳液平均粒径及粒径分布、液滴微观分布和Zeta-电位的测定
1.3.5.1 MP乳液平均粒径及粒径分布
参考张潮等[16]的方法,利用LS13320激光粒度仪测定MP乳液的平均粒径及粒径分布。
1.3.5.2 MP乳液液滴微观结构观察
将MP乳液用磷酸盐缓冲液稀释20 倍,取10 μL稀释后的MP乳液置于载玻片中心处,利用BX53M光学显微镜放大100 倍进行观察。
1.3.5.3 MP乳液Zeta-电位的测定
用磷酸盐缓冲液将MP乳液稀释至1 mg/mL。使用Zetasizer Nano ZS 90激光粒度仪测定MP乳液的Zeta-电位。
1.3.6 MP乳液流变特性的测定
1.3.6.1 MP乳液角频率的测定
参考Zhao Xue等[17]的方法并稍作修改,使用动态流变仪进行MP乳液的频率扫描,每次测试取600 μL乳液,采用直径40 mm的平板夹具。各乳液样品置于平行板之间,间距为0.5 mm,测试温度为25 ℃。
1.3.6.2 MP乳液黏度的测定
参考Wang Haifeng等[18]的方法并稍作修改,采用流变仪测定MP乳液的黏度。每次取600 μL MP乳液均匀涂布于测试平台,为防止样品中的水分蒸发,用硅油进行密封。整个测试过程在25 ℃下进行。
1.3.7 MP乳液界面张力的测定
参考O’Sullivan等[19]的方法并稍加修改。采用铂金平板法测定水相(0.01 g/100 mL,MP溶液)和油相(大豆油)之间的界面张力。将装有20 g水相的玻璃皿放入K100自动界面张力仪中,使铂金板浸入20 g水相中至3 mm的深度。然后在水相上移入40 g油,在水相-油相间形成界面。使用 K100自动界面张力仪测定界面张力,测试过程持续3 600 s,整个测试过程温度保持在25 ℃。
1.3.8 MP乳液吸附蛋白和未吸附蛋白相对含量的测定
参考Lin Li等[20]的方法稍作修改,将制备好的乳液于4 ℃条件下静置48 h后,收集乳液下层水相,4 000 g离心15 min除去水相中潜在油滴。用双缩脲法对水相中蛋白质量浓度进行测定。未吸附蛋白相对含量表示为下层水相中蛋白质量浓度占乳液总蛋白质量浓度的百分比,吸附蛋白相对含量表示为“1-未吸附蛋白相对含量”。
1.3.9 MP乳液冷场扫描电子显微镜观察
参考Wang Yuntao等[21]的方法加以修改对MP乳液进行冷场扫描电子显微镜观察。将制备好的MP乳液置于液体专用样品盘中观察乳液微观形貌。在雪泥罐中经液氮速冻后,在样品制备腔室中进行升华,时间10 min,经5 mA、60 s的喷金溅射后,在加速电压1 kV条件下,放大1 000 倍观察MP乳液结构并拍照。
1.4 数据处理与分析
各实验重复3 次,结果表示为平均值±标准差。通过SPSS Statistics 25软件进行单因素方差分析,Duncan’s多重比较方法用于检验不同超声处理间的差异显著性(P<0.05表示差异显著),采用Origin 2021软件绘图。
2 结果与分析
2.1 超声处理对低钠条件下MP乳液EAI和ESI的影响
EAI、ESI是用来表征蛋白质乳化特性的重要指标,可反映蛋白质稳定整个乳化体系的能力[22]。其中,EAI代表蛋白质在油-水界面的吸附能力;ESI代表一定时间内,蛋白质维持乳液分散体系稳定的能力。不同超声处理时间对低钠条件下MP乳液EAI、ESI的影响如图1所示。随着超声处理时间的延长,EAI显著增加(P<0.05)。超声处理12 min的MP乳液EAI达到最大值(38.68±0.04)m2/g,相比于未经超声处理组((22.00±0.02)m2/g),EAI增加了75.82%。这说明延长超声处理时间可以增加低钠条件下MP在油-水界面的吸附能力,增强MP-油相和MP-MP之间的相互作用,改善低钠条件下MP的乳化活性。ESI的变化趋势与EAI一致,随着超声处理时间的延长而显著增大(P<0.05)。与未超声处理组((10.67±0.01)min)相比,超声处理12 min时MP乳液的ESI达到最大((87.44±0.24)min),增加了约7 倍,说明超声处理可以显著改善低钠条件下MP的乳化稳定性。Amiri等[23]发现,在不同的超声功率处理条件下(20 kHz,100~300 W,10、20、30 min),牛肉MP乳液的EAI和ESI均增加。刁小琴等[24]研究也发现超声处理(0~200 W)可以改善猪肉MP乳液的乳化活性和乳化稳定性,本研究结果与其类似。本课题组前期研究发现超声处理(20 kHz,450 W,0、3、6 min)能够有效改善正常NaCl浓度(0.6 mol/L)下鸡MP乳液的EAI和ESI[14]。在本研究中低钠条件下延长超声处理时间至12 min,能够有效改善MP的ESI,明显高于前期发现的正常盐含量条件下MP的ESI[14]。综上,延长超声波时间能够显著改善低钠条件下MP乳液的乳化特性。
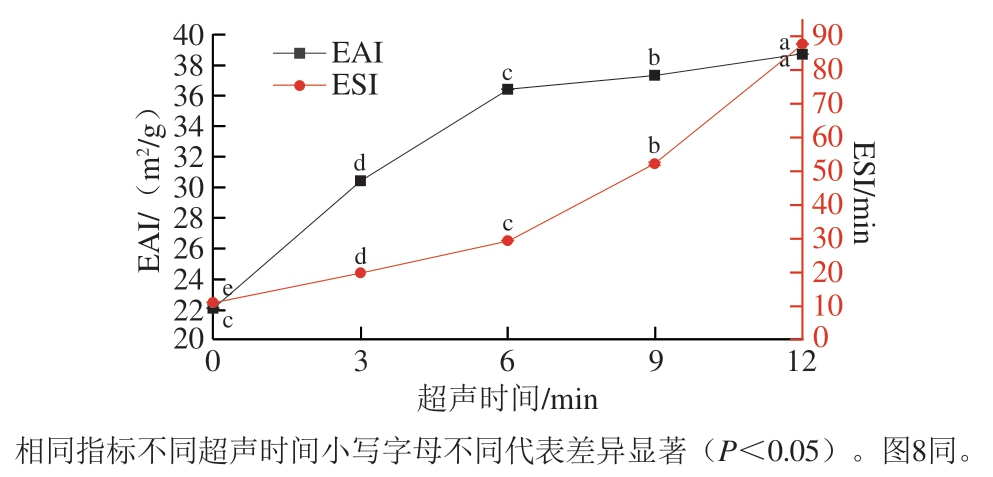
图1 低钠条件下超声处理MP乳液的EAI和ESI变化
Fig. 1 Changes in EAI and ESI of MP emulsions with and without ultrasound treatment under low NaCl condition
2.2 超声处理对低钠条件下MP乳液TSI的影响
TSI是用来衡量分散体系的不稳定性的重要指标,TSI曲线斜率越大,表明整个体系的变化越大,稳定性越差[25]。不同超声时间对低钠条件下MP乳液TSI的影响如图2所示。在乳液放置3 600 s过程中,未超声处理的MP乳液TSI从0增加到2.63。随超声处理时间延长至12 min,MP乳液的TSI逐渐减小。超声处理12 min组MP乳液在放置过程中TSI从0增加到1.63,TSI和曲线斜率均为最小,这说明超声处理有效改善了MP乳液的稳定性。同时,这一结果也与EAI、ESI的变化结果相印证。Liu Haotian等[11]的研究也证实了不同功率超声处理低离子强度下猪MP可明显改善其乳化稳定性;Fu Qingquan等[26]研究不同功率超声处理(20 kHz、100~600 W、10 min)且无NaCl条件下鸡MP乳液TSI的变化,发现与未超声处理相比,不同超声功率处理的无盐MP乳液物理稳定性显著增强。
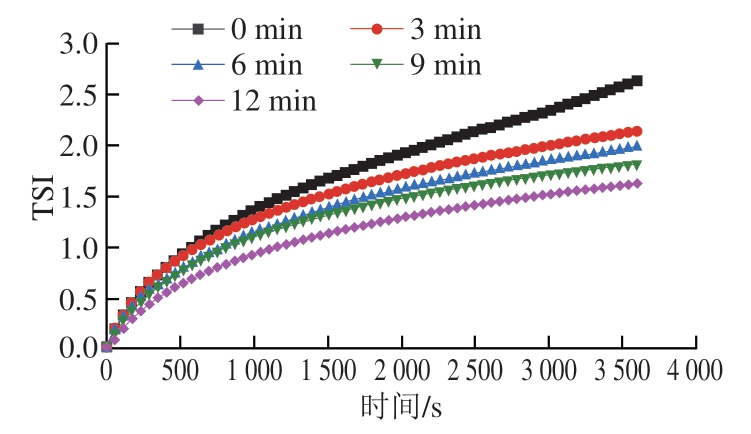
图2 不同超声处理时间对低钠条件下MP乳液TSI的影响
Fig. 2 Effect of TSI of emulsions prepared with MP treated with ultrasound for different periods of time under low NaCl condition
2.3 超声处理对低钠条件下MP乳液粒径及其分布、Zeta-电位和液滴微观结构的影响
2.3.1 MP乳液粒径分布及大小
超声处理对低钠条件下MP乳液粒径分布的影响如图3所示,超声处理提高了MP乳液液滴分布的均匀性。未超声和超声处理组的MP乳液均表现为双峰分布,但经过超声处理后的乳液双峰逐渐向小粒径分布范围移动,而且小粒径范围内(1~5 μm)的乳液液滴占比呈现出增加的趋势。当超声处理时间由9 min延长至12 min时,MP乳液粒径分布未见明显变化。如表1所示,与未超声处理组相比,超声处理显著降低了MP乳液的粒径(P<0.05)。超声处理12 min时,MP乳液的平均粒径达到最小((11.98±0.03)μm),相比于超声9 min时的粒径并未有显著性差异(P>0.05)。粒径分布及大小可用来反映蛋白质或乳滴的聚集程度[27],在乳液生产工艺中,是影响乳液稳定性的重要参数[28]。以上结果表明超声处理MP的乳液粒径减小且分布均匀,有助于增加乳液稳定性。Liu Haotian等[11]通过超声处理蛋白制备乳液的结果也显示乳液粒径减小且均匀性提高能够促进乳液稳定。而乳液粒径降低的原因是高强度超声的空化作用产生了机械力和剪切作用,打散了低NaCl条件下肌球蛋白的粗丝结构,使得MP的粒径显著降低且分布更加均匀[13]。Tang Ling等[29]研究发现高强度超声处理(20 kHz,3、6、9 min)可以使低NaCl浓度(0.1~0.3 mol/L)罗非鱼肌动球蛋白的粒径分布更为均一。本研究中,超声处理12 min组MP乳液粒径与超声处理9 min组无显著差异,可能是此时超声处理9 min对低钠MP的物理作用达到极限,很难进一步展开MP的结构。
表1 超声处理MP制备乳液的平均粒径和Zeta-电位变化
Table 1 Changes in average particle size and zeta potential of emulsions prepared with ultrasound-treated MP under low NaCl condition

注:同列肩标小写字母不同代表差异显著(P<0.05)。
处理时间 平均粒径/μm Zeta-电位/mV 0 20.67±0.21a -4.31±0.14d 14.18±0.06b -7.94±0.81c 6 13.04±0.12c -8.68±0.33cd 9 12.02±0.03d -9.44±0.19ab 12 11.98±0.03d -10.07±0.50a 3
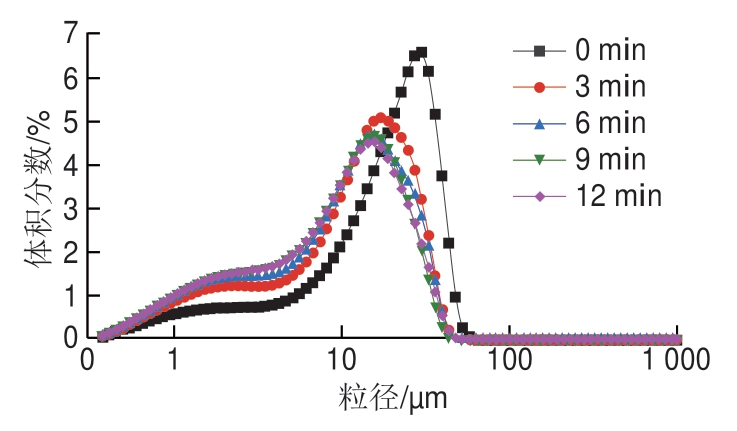
图3 低钠条件下不同超声时间处理MP制备乳液的粒径分布变化
Fig. 3 Changes in particle size distribution of emulsions prepared with MP treated by ultrasound for different treatment periods of time under low NaCl condition
2.3.2 MP乳液Zeta-电位
Zeta-电位能反应乳液分散体系中蛋白质颗粒间的静电相互作用。通常电位的绝对值越大,说明液滴之间的静电斥力越强,有利于整个体系的稳定[30-31]。表1显示了超声处理对低钠条件下MP乳液的Zeta-电位影响。所有组MP乳液的电位均为负值,超声0 min时MP乳液电位为(-4.31±0.14) mV,延长超声处理时间显著减小了MP乳液的Zeta-电位(P<0.05),即增加MP乳液Zeta-电位的绝对值。超声处理12 min MP乳液电位绝对值增加至(-10.07±0.50) mV,而与超声9 min时的Zeta-电位无显著性差异(P>0.05),与粒径变化趋势类似。超声处理可以展开MP内部结构,在MP表面暴露更多带负电的氨基酸,增加了制备成乳液后MP乳液液滴之间的静电斥力,有利于乳液稳定性[13]。Wang等[25]研究表明乳液液滴表面负电荷密度增加,可增大两液滴之间的静电斥力,乳液TSI明显减小,表明乳液体系更加稳定。
2.3.3 MP乳液液滴微观结构
图4显示了低钠条件下超声处理MP后制备的乳液微观结构。未超声处理的MP乳液液滴体积很大且分布不均。较大油滴的出现不利于乳液的稳定且容易造成油滴聚集。与未超声处理组相比,超声处理后的MP乳液液滴体积明显变小。随着超声时间的延长,乳液液滴体积逐渐减小,尤其是超声9 min和12 min时液滴体积不仅小且分布均匀,这与粒径分布和大小的变化结果一致。上述结果表明,超声处理后平均粒径和蛋白质聚集减少,有助于MP在油-水界面的吸附,尤其超声9 min和12 min能够促进乳液更小油滴的形成和更均匀的分布,从而使乳液具有更好的稳定能力。Zhao Xue等[17]使用光学显微观察了由鸡蛋分离蛋白稳定的乳液油滴大小和分布,发现较小的粒径和均匀的分散有助于乳液的稳定。Fu Qingquan等[26]也通过光学显微镜观察了不同超声功率处理鸡MP的乳液液滴分布,发现与对照组相比,超声处理减小了油滴尺寸并提高了乳液的均匀性。
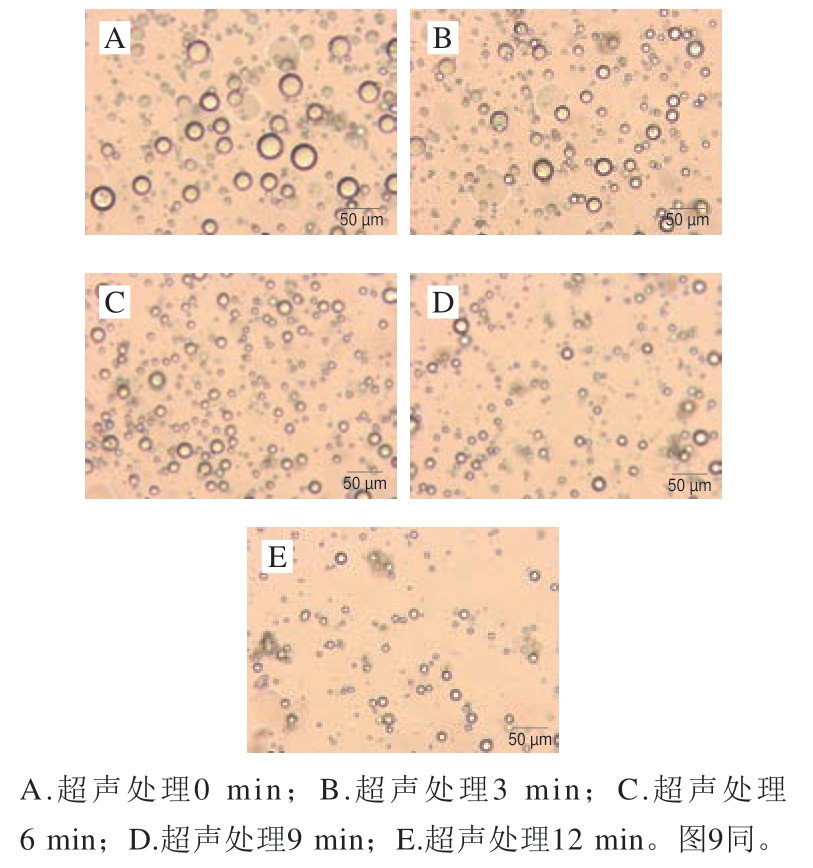
图4 低钠条件下不同超声时间处理MP稳定乳液的液滴微观状态
Fig. 4 Microstructures of emulsions stabilized by MP treated by ultrasound for different periods of time under low NaCl condition
2.4 超声处理对低钠条件下MP乳液流变特性的影响
2.4.1 MP乳液角频率扫描分析结果
低钠条件下超声处理MP乳液的贮能模量(G′)和耗能模量(G”)随角频率变化的曲线如图5所示。所有组MP乳液的G′均高于G”,且未发生交叉现象,表明乳液结构有序且富有弹性[32]。所有乳液G′和G”随着角频率的增加未出现明显变化,说明MP乳液G′和G”对频率没有依赖性。与未超声处理组相比,超声处理MP的乳液G′和G”均高于未处理组,超声处理12 min时MP乳液G′和G”均为最大,表明超声处理MP可以明显增强乳液的黏弹性,有助于提高乳液的稳定性。MP乳液黏弹性的变化趋势与TSI、EAI、ESI分析结果一致。超声处理减小了乳液的粒径,使更多的蛋白颗粒吸附到油-水界面上并呈现出弱凝胶特性,这种弱相互作用确保了乳液的稳定性,从而增加了乳液的G′。这与Diao Xiaoqin等[33]的研究结果相一致,其发现在MP制得的乳液中,G′总是高于G”,并认为G′的增加很可能与液滴和蛋白质之间相互作用有关。Zhao Xue等[17]也报道了乳状液的G′远高于G”,表明形成了有序的弹性凝胶结构。
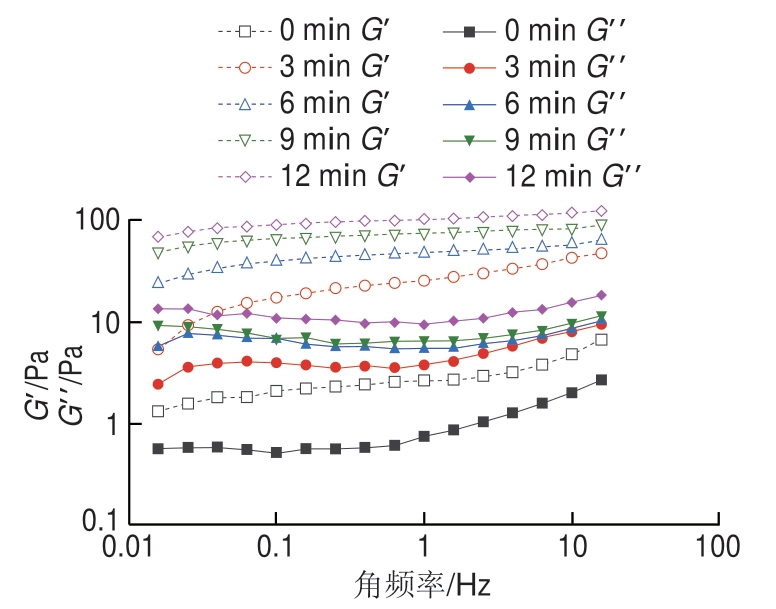
图5 超声处理时间对低钠条件下MP乳液储能模量(G′)和损耗模量(G”)的影响
Fig. 5 Effect of storage modulus (G′) and loss modulus (G”) of emulsions stabilized by MP treated by ultrasound for different periods of time under low NaCl condition
2.4.2 MP乳液表观黏度扫描分析结果
超声处理低钠条件下MP对其乳液表观黏度的影响如图6所示,所有组MP乳液样品均随着剪切速率的增加先迅速降低,后缓慢降低,这一行为称为流体假塑性[14]。与未超声处理组相比,超声处理MP乳液表观黏度明显增大,并随着超声处理时间的延长表观黏度进一步升高,在超声处理12 min后MP乳液的表观黏度最大。根据Stoke定律,乳液体系黏度较大可以减缓液滴上浮的速率,有利于乳化体系的稳定[33]。另外,由前期的研究结果可以确定,随着超声时间的延长,MP乳液粒径逐渐减小,乳液体系中液滴数目随之增加,液滴间进入相互吸引区域的机会增大,导致乳液位移困难。因此,MP乳液黏度增大、TSI降低,表明超声处理可促进低钠条件下MP乳液稳定性的改善。Li Ke[13]、Fu Qingquan[26]等的研究也表明超声处理可改善MP乳液的弹性凝胶结构并增加乳液表观黏度。
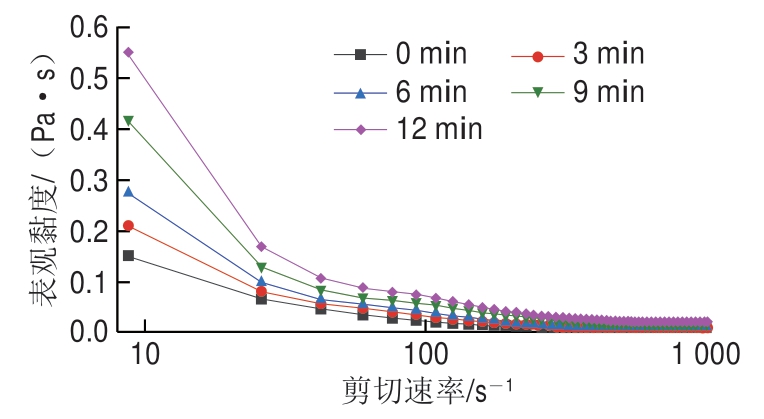
图6 超声处理时间对低钠条件下MP乳液表观黏度的影响
Fig. 6 Effect of apparent viscosity of emulsions stabilized by MP treated by ultrasound for different periods of time under low NaCl condition
2.5 超声处理对低钠条件下MP乳液界面张力的影响
图7显示了低钠条件下超声处理对MP乳液油-水界面张力的影响,所有组MP乳液的油-水界面张力均随时间延长而降低,说明MP是良好的乳化剂,能够有效作用于油-水界面,促进形成稳定的乳液,是潜在的乳液系统营养输送蛋白基质[7]。与未超声处理组相比,超声处理的MP乳液界面张力逐渐降低,尤其是超声处理12 min时MP乳液的油-水界面张力最低。这与O’Sullivan等[19]通过超声处理(频率20 kHz、功率强度34 W/cm2、时间2 min)植物蛋白(豌豆分离蛋白、大豆分离蛋白)的研究结果相似,他们发现超声处理植物蛋白可以显著降低蛋白溶液与植物油的界面张力(P<0.05),提高蛋白的乳化稳定性。前期研究证实超声处理使蛋白质粒径减小[13],增加MP的移动性和灵活性,提高蛋白质在油-水界面的吸附能力,有利于乳液稳定。因此在低NaCl条件下,通过延长超声处理时间可以减小MP粒径进而使MP乳液的粒径显著减小(P<0.05),有利于MP从水相向油滴表面扩散,在油-水界面发挥稳定作用,并使MP界面张力降低。
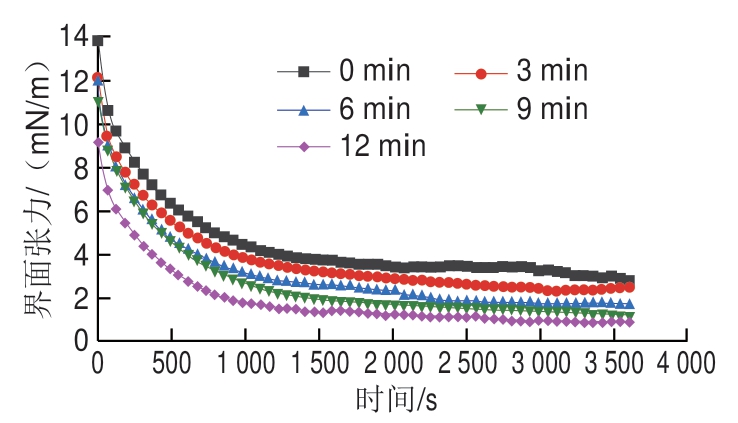
图7 超声处理时间对低钠条件下MP蛋白油-水界面张力的影响
Fig. 7 Effect of ultrasound treatment time on the oil-water interfacial tension of MP under low NaCl condition
2.6 超声处理对低钠条件下MP乳液吸附蛋白和未吸附蛋白相对含量的影响
吸附蛋白可以降低界面张力,同时在相邻液滴之间提供额外的阻力[11,34],其含量决定了界面层的形成情况,因此是形成稳定乳液的先决条件。超声处理对低钠条件下MP乳液吸附蛋白和未吸附蛋白相对含量的影响如图8所示,随着超声处理时间的延长,未吸附蛋白相对含量逐渐降低,吸附蛋白相对含量对应升高,各处理组间均有显著性差异(P<0.05)。其中,未经超声处理的MP乳液中,未吸附蛋白相对含量高达49.37%,超声处理12 min后,未吸附蛋白相对含量下降至7.25%,为所有样品中最低。上述结果说明超声处理可以显著降低MP乳液中未吸附蛋白相对含量(P<0.05),使吸附蛋白相对含量显著提升(P<0.05)。MP在乳化体系中充当乳化剂,吸附蛋白相对含量升高说明吸附在油滴表面的蛋白相对含量增加,乳化体系更加稳定。这一现象的产生是由于超声处理减小了MP乳液的粒径,聚集的MP结构逐渐打开;暴露出更多带负电的氨基酸,增大了液滴间静电斥力;同时,MP的界面张力下降,促进了MP在油-水界面的扩散并有助于油滴均匀分布。因此,乳液EAI、ESI均有明显提高。Lu Junmeng等[34]也报道了较高的吸附蛋白含量有助于乳液稳定,其认为MP负电荷增加,油滴间静电排斥增强,有利于MP吸附到油-水界面并保持稳定。
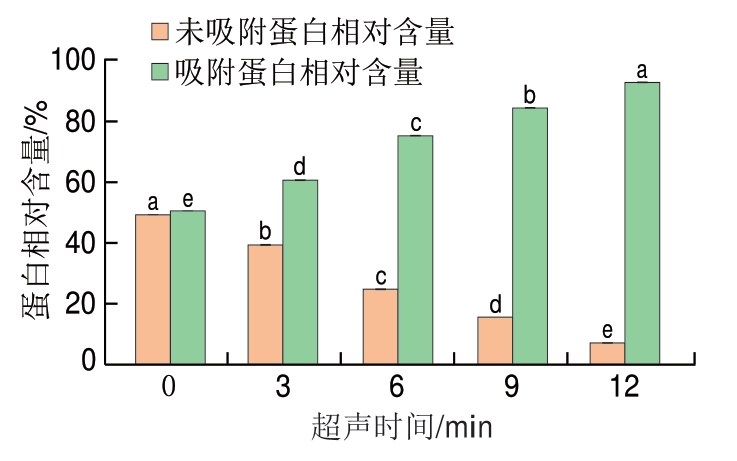
图8 超声处理时间对低钠条件下MP乳液吸附蛋白和未吸附蛋白相对含量的影响
Fig. 8 Effect of amount of adsorbed and non-adsorbed proteins on the interface of emulsions prepared with MP treated by ultrasound for different periods of time under low NaCl condition
2.7 超声处理对低钠条件下MP乳液微观结构的影响
超声处理对低钠MP乳液微观结构的影响如图9所示,球形和椭圆形代表油滴,架桥代表蛋白质[35]。未经超声处理的MP乳液液滴颗粒较大,并呈现出架桥絮凝现象。随着超声处理时间的延长,MP乳液液滴体积逐渐减小且油滴间距增大,架桥絮凝现象减弱。超声处理超过6 min时,架桥絮凝情况明显减弱,尤其是超声处理12 min时,观察到的乳液液滴最小,这一结果与粒径分析和光学显微镜观察结果一致。从图9中还可以看出,油滴表面被蛋白包裹,证明该乳液为水包油型。Wang Yuntao等[21]也通过冷场扫描电子显微镜观察到玉米纤维胶和壳聚糖制备的乳液液滴减小有助于乳液稳定。
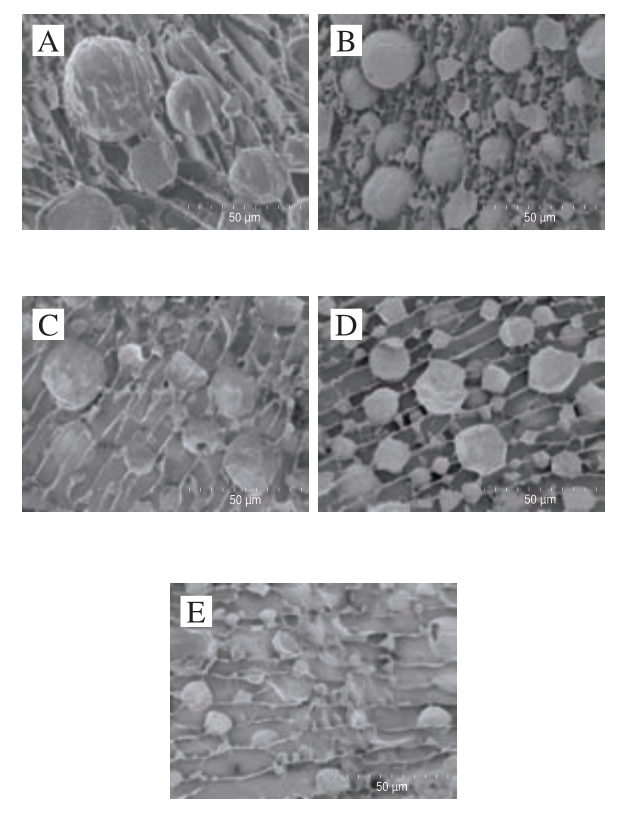
图9 超声处理时间对低钠条件下MP乳液微观结构的影响
Fig. 9 Effect of ultrasonic treatment time on the microstructure of MP emulsions under low NaCl condition
3 结 论
本研究表明低钠条件下超声处理有效地改善了MP乳液的稳定性。与未超声处理组相比,超声处理MP乳液的乳化活性和乳化稳定性显著增加,其中超声处理12 min MP乳液的EAI增加了75.82%,ESI增加了7 倍,TSI降低;由MP乳液粒径分布及大小、Zeta-电位分析和光学显微镜观察发现,随着超声处理MP的时间从0 min延长至12 min,MP制备的乳液粒径明显降低且乳液液滴分布更加均匀,Zeta-电位绝对值增加,进而增强了液滴的静电相互作用。超声处理可以增加乳液的黏弹性,且随着乳液表观黏度的增加,可有效防止乳液上浮现象出现。同时,超声处理MP促进其油-水界面张力的降低,表明超声处理可以增加MP分子的移动性和灵活性,促进MP对油滴的吸附;且超声处理MP后乳液中吸附蛋白相对含量增加、未吸附蛋白相对含量降低也进一步证明了这一事实。此外,通过冷场扫描电子显微镜也观察到MP乳液液滴体积逐渐减小且油滴间距增大,架桥絮凝现象减弱。综上,高强度超声波可以提高MP在低钠条件下的乳化稳定性,本研究可为超声处理在低钠条件下MP的进一步加工利用提供理论参考。
[1]李春保, 印遇龙, 周光宏. 肉类营养与人体健康研究的战略思考[J].中国科学院院刊, 2019, 34(2): 190-196. DOI:10.16418/j.issn.1000-3045.2019.02.008.
[2]INGUGLIA E S, ZHANG Z, TIWARI B K, et al. Salt reduction strategies in processed meat products: a review[J]. Trends in Food Science &Technology, 2017, 59: 70-78. DOI:10.1016/j.tifs.2016.10.016.
[3]陈益春, 姜帅, 曹传爱, 等. 植物油预乳状液替代猪脂肪对法兰克福香肠品质特性的影响[J]. 食品科学, 2019, 40(24): 86-93.DOI:10.7506/spkx1002-6630-20180906-060.
[4]WU L, WU T, WU J, et al. Effects of cations on the “salt in” of myofibrillar proteins[J]. Food Hydrocolloids, 2016, 58: 179-183.DOI:10.1016/j.foodhyd.2016.02.028.
[5]CHEN X, TUME K R, XIONG Y L, et al. Structural modification of myofibrillar proteins by high-pressure processing for functionally improved, value-added and healthy muscle gelled foods[J]. Critical Reviews in Food Science and Nutrition, 2017, 58(2): 2981-3003. DOI:10.1080/10408398.2017.1347557.
[6]WU C L, LI L Y, ZHONG Q X, et al. Myofibrillar protein-curcumin nanocomplexes prepared at different ionic strengths to improve oxidative stability of marinated chicken meat products[J]. LWT-Food Science and Technology, 2019, 99: 69-76. DOI:10.1016/j.lwt.2018.09.024.
[7]CHEN J, XU Y, PIUS B A, et al. Changes of myofibrillar protein structure improved the stability and distribution of baicalein in emulsion[J]. LWT-Food Science and Technology, 2020, 137: 110404.DOI:10.1016/j.lwt.2020.110404.
[8]XIONG Youling L. Chemical and physical characteristics of meat:protein functionality[M]// DIKEMAN M, DEVINE C. Encyclopedia of meat sciences. Amsterdam: Elsevier, 2004: 267-273.
[9]XIA G, XIE Y R, YIN T, et al. Effect of high intensity ultrasound on gelation properties of silver carp surimi with different salt contents[J].Ultrasonics Sonochemistry, 2020, 70: 105326. DOI:10.1016/j.ultsonch.2020.105326.
[10]KANG D C, ZHANG W G, LORENZO J M, et al. Structural and functional modification of food proteins by high power ultrasound and its application in meat processing[J]. Critical Reviews in Food Science and Nutrition, 2021, 61: 1914-1933. DOI:10.1080/10408398.2020.1767538.
[11]LIU Haotian, ZHANG Jingnan, WANG Hui, et al. High-intensity ultrasound improves the physical stability of myofibrillar protein emulsion at low ionic strength by destroying and suppressing myosin molecular assembly[J]. Ultrasonics Sonochemistry, 2021, 74: 105554.DOI:10.1016/j.ultsonch.2021.105554.
[12]CHEN Jiahui, ZHANG Xing, XUE Siwen, et al. Effects of ultrasound frequency mode on myofibrillar protein structure and emulsifying properties[J]. International Journal of Biological Macromolecules,2020, 163: 1768-1779. DOI:10.1016/j.ijbiomac.2020.09.114.
[13]LI Ke, FU Lei, ZHAO Yingying, et al. Use of high-intensity ultrasound to improve emulsifying properties of chicken myofibrillar protein and enhance the rheological properties and stability of the emulsion[J]. Food Hydrocolloids, 2020, 98: 105275. DOI:10.1016/j.foodhyd.2019.105275.
[14]李可, 李三影, 扶磊, 等. 低频高强度超声波对鸡胸肉肌原纤维蛋白性质的影响[J]. 食品科学, 2020, 41(23): 122-129. DOI:10.7506/spkx1002-6630-20191205-067.
[15]WANG Guan, LIU Manman, CAO Liwei, et al. Effects of different NaCl concentrations on self-assembly of silver carp myosin[J]. Food Bioscience, 2018, 24: 1-8. DOI:10.1016/j.fbio.2018.05.002.
[16]张潮, 吴宇桐, 孔保华. 超声辅助冷冻对鸡胸肉肌原纤维蛋白乳化稳定性的影响[J]. 食品科学, 2020, 41(17): 104-110. DOI:10.7506/spkx1002-6630-20190817-189.
[17]ZHAO Xue, WU Tao, XING Tong, et al. Rheological and physical properties of O/W protein emulsions stabilized by isoelectric solubilization/precipitation isolated protein: the underlying effects of varying protein concentrations[J]. Food Hydrocolloids, 2019, 95: 580-589. DOI:10.1016/j.foodhyd.2018.03.040.
[18]WANG Haifeng, YANG Huijuan, CHEN Xing, et al. Structural basis for high-intensity ultrasound treatment in rheology of myofibrillar protein extracted from white croaker in relation to their solubility[J]. Social Science Electronic Publishing, 2022, 156: 112979.DOI:10.1016/j.lwt.2021.112979.
[19]O’SULLIVAN J, MURRAY B, FLYNN C, et al. The effect of ultrasound treatment on the structural, physical and emulsifying properties of animal and vegetable proteins[J]. Food Hydrocolloids,2016, 53: 141-154. DOI:10.1016/j.foodhyd.2015.02.009.
[20]LIN Li, XIONG Youling L. Competitive adsorption and dilatational rheology of pork myofibrillar and sarcoplasmic proteins at the O/W emulsion interface[J]. Food Hydrocolloids, 2021, 118(1): 106816.DOI:10.1016/j.foodhyd.2021.106816.
[21]WANG Yuntao, WANG Shasha, LI Rui, et al. Synergistic effect of corn fiber gum and chitosan in stabilization of oil in water emulsion[J].LWT-Food Science and Technology, 2022, 154: 112592. DOI:10.1016/j.lwt.2021.112592.
[22]YU C, LI S, SUN S, et al. Modification of emulsifying properties of mussel myofibrillar proteins by high-intensity ultrasonication treatment and the stability of O/W emulsion[J]. Colloids and Surfaces A, 2022,641: 128511. DOI:10.1016/j.colsurfa.2022.128511.
[23]AMIRI A, SHARIFIAN P, SOLTANIZADEH N. Application of ultrasound treatment for improving the physicochemical, functional and rheological properties of myofibrillar proteins[J]. International Journal of Biological Macromolecules, 2018, 111: 139-147.DOI:10.1016/j.ijbiomac.2017.12.167.
[24]刁小琴, 关海宁, 乔秀丽, 等. 超声波处理对猪肉肌原纤维蛋白理化及乳化特性的影响[J]. 食品与机械, 2019, 35(4): 26-30; 36.DOI:10.13652/j.issn.1003-5788.2019.04.005.
[25]WANG K, ZHANG B, LI G. Effects of weak-alkali ASP composition on the stability of O/W emulsions[J]. Energy Sources Part A, 2018, 41:1-13. DOI:10.1080/15567036.2018.1520328.
[26]FU Qingquan, SHI Haibo, ZHOU Lei, et al. Effects of ultrasound power on the properties of non-salt chicken myofibrillar protein emulsions[J]. International Journal of Food Science and Technology,2022, 57(4): 2523-2534. DOI:10.1111/ijfs.15626.
[27]KANG Z L, ZHANG X H, LI X, et al. The effects of sodium chloride on proteins aggregation, conformation and gel properties of pork myofibrillar protein running head: relationship aggregation,conformation and gel properties[J]. Journal of Food Science and Technology-Mysore, 2021, 58(6): 2258-2264. DOI:10.1007/s13197-020-04736-4.
[28]YILDIRIM M, SUMNU G, SAHIN S. The effects of emulsifier type,phase ratio, and homogenization methods on stability of the double emulsion[J]. Journal of Dispersion Science and Technology, 2016,38(6): 807-814. DOI:10.1080/01932691.2016.1201768.
[29]TANG Ling, YONGSAWATDIGUL J. Physicochemical properties of tilapia (Oreochromis niloticus) actomyosin subjected to high intensity ultrasound in low NaCl concentrations[J]. Ultrasonics Sonochemistry,2020, 63: 104922. DOI:10.1016/j.ultsonch.2019.104922.
[30]LIU H, HAN G, ZHANG H, et al. Improving the physical and oxidative stability of emulsions based on the interfacial electrostatic effects between porcine bone protein hydrolysates and porcine bone protein hydrolysate-rutin conjugates[J]. Food Hydrocolloids, 2019, 94:418-427. DOI:10.1016/j.foodhyd.2019.03.037.
[31]ZOU H, ZHAO N, SUN S, et al. High-intensity ultrasonication treatment improved physicochemical and functional properties of mussel sarcoplasmic proteins and enhanced the stability of oil-inwater emulsion[J]. Colloids and Surfaces A, 2020, 589: 124463.DOI:10.1016/j.colsurfa.2020.124463.
[32]GAO T, ZHAO X, LI R, et al. Synergistic effects of polysaccharide addition-ultrasound treatment on the emulsified properties of lowsalt myofibrillar protein[J]. Food Hydrocolloids, 2021, 123: 107143.DOI:10.1016/j.foodhyd.2021.107143.
[33]DIAO Xiaoqin, GUAN Haining, ZHAO Xinxin, et al. Properties and oxidative stability of emulsions prepared with myofibrillar protein and lard diacylglycerols[J]. Meat Science, 2016, 115: 16-23. DOI:10.1016/j.meatsci.2016.01.001.
[34]LU Junmeng, ZHANG Weiyi, ZHAO Xue, et al. Comparison of the interfacial properties of native and refolded myofibrillar proteins subjected to pH-shifting[J]. Food Chemistry, 2022, 380: 131734.DOI:10.1016/j.foodchem.2021.131734
[35]MA W C, WANG J M, WU D, et al. The mechanism of improved thermal stability of protein-enriched O/W emulsions by soy protein particles[J]. Food & Function, 2020, 11(2): 1385-1396. DOI:10.1039/c9fo02270h.