随着新食品安全法《特殊医学用途配方食品注册管理办法》正式实施,特殊医学用途配方食品(后简称特医食品)的申报、生产、流通等过程已实现国家层面上的规范管理,特医食品行业进入蓬勃发展阶段[1]。肠内营养是指对于消化功能障碍而不能耐受正常饮食的患者,选择口服或管饲等途径,经胃肠道提供代谢需要的营养物质及其他各种营养素的营养支持方式[2]。该方法有助于维持肠黏膜结构和屏障功能完整性,因此是临床医师首选的营养支持方式[3]。蛋白质是肠内营养配方中重要的组成成分,具有促进胃肠道功能恢复、维持机体机能等多种生理功能[4]。蛋清蛋白质是自然界中最优质的蛋白质源,各氨基酸比例合理,且最接近人体的氨基酸模式,吸收利用率高达98%以上[5]。目前市场上的肠内营养产品多以大豆分离蛋白、乳清蛋白为蛋白来源,关于蛋清蛋白源的此类产品较少。因此,选用蛋清蛋白作为肠内营养粉(enteral nutrition powder,ENP)的蛋白源,可为开发新蛋白源肠内营养产品提供一个重要方向。
在众多肠内营养产品中,ENP因成本低、保质期长、贮存运输及使用方便等优点,占据较高的市场份额,具有广阔的发展前景[6]。目前关于ENP的研究多集中于产品原料开发及适用范围方面,如刘静波等[7]申请了以咸蛋清蛋白肽粉和大豆蛋白作为蛋白源的肠内营养制剂专利,该制剂营养成分全面,具有增强免疫力的作用。吴园涛等[8]研制了牡蛎肽蛋白源的ENP产品,结果表明牡蛎肽的营养价值高于大豆和牛奶蛋白,与鸡蛋蛋白相当,是作为肠内营养产品的优质蛋白源原料。针对糖尿病,赵清波等[9]开发了以蚕蛹蛋白及其短肽为蛋白的源肠内营养剂,发现该产品可明显降低II型糖尿病小鼠的血糖值。舒晓亮等[10]选用乳清蛋白和大豆蛋白为蛋白质来源开发了一种整蛋白型肠内营养产品,适合手术期或危重期营养不良患者的营养补充。但目前关于ENP产品特性及品质稳定性的研究比较少。
ENP是为临床病人和特殊人群研发的营养类产品,其产品冲调特性及品质稳定性是生产厂家和医疗机构共同关注的问题。ENP在使用时,需用水或其他溶液将粉剂冲调,最终以营养液的状态发挥作用,因此在ENP的研究中,冲调性是评价产品品质的重要指标。张凌泓[11]对临床营养粉剂冲调性的评价标准及影响因素进行了研究,并建立了其冲调性综合评价模型方程。同时,贮藏条件会对ENP的品质稳定性产生重要影响。García-Baños等[12]研究了4 种含有不同单糖及双糖的ENP在贮藏期间的美拉德反应,提出麦芽糖和麦芽酮糖的比例可以作为商业肠内营养产品生产过程中的质量指标;Fávaro等[13]将15 种肠内营养产品于不同条件下贮藏,通过监测VA含量的变化,发现该类产品适于低温(<30 ℃)避光环境保存。开展ENP冲调特性及品质稳定化的研究对产品的开发及应用有重要指导意义。因此,本研究基于本课题组开发的一种蛋清蛋白源ENP,在分析其营养成分的基础上,对产品的最佳冲调条件进行了探索,并进一步研究了其在不同贮藏条件下,溶解性、结块率、稳定系数等冲调特性,及外观色泽、脂肪氧化等品质参数的变化,最后对其保质期进了预测。
1 材料与方法
1.1 材料与试剂
速溶型蛋清粉(溶解性90.25%)[14]为实验室自制;大豆油和米糠油均为市售。
麦芽糊精(食品级)、变性淀粉(食品级) 西王药业有限公司;果蔬粉、复合矿物质粉 天津秀谷生物技术发展有限公司;卵磷脂、中链甘油三酯 道勤生物科技(上海)有限公司。其他试剂均为分析纯。
1.2 仪器与设备
DFT-500小型混料机 深圳市雷通实业有限公司;TU-1810紫外-可见分光光度计 北京普析通用仪器有限责任公司;KDN-818凯氏定氮仪 上海纤检仪器有限公司;MB35卤素水分测定仪 奥豪斯国际贸易有限公司;WSC-S色差计 上海精密科学有限公司;DGG-9023A型电热恒温鼓风干燥箱 上海森信实验仪器有限公司;Mastersizer 2000激光粒度仪 英国马尔文仪器有限公司。
1.3 方法
1.3.1 ENP的制备与贮藏
依据本课题前期的研究[15]确定ENP的配方:以速溶型蛋清粉(25%(质量分数,下同))和大豆蛋白粉(6%)为蛋白质来源,大豆油(8%)、米糠油(4%)、卵磷脂(2%)和中链甘油三酯(2%)为脂肪来源,麦芽糊精(40%)、变性淀粉(5%)、L-阿拉伯糖(4%)、低聚木糖(1%)为碳水化合物来源,复合果蔬粉(2%)和复合矿物质粉(1%)为维生素和矿物质来源。采用干混法进行混合,具体操作为各原料按配方添加量,先加入麦芽糊精及大豆油、米糠油等脂肪来源原料混合5 min,再加入其他原料混合5 min制成成品,成品采用微波杀菌(700 W、100 s)。将配制好的ENP(约500 g)使用锡箔袋密封包装,分别于4、25 ℃和37 ℃下贮藏。于贮藏第1、2、3、4、5个月取出样品进行相应指标测定,以贮藏前的ENP为对照组。
1.3.2 ENP营养成分的测定
ENP中蛋白质、脂肪、水分含量的测定分别参照GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》、GB 5009.6—2016《食品安全国家标准食品中脂肪的测定标准名称》、GB 5009.3—2016《食品安全国家标准 食品中水分的测定》,菌落总数的测定参照GB 4789—2016《食品安全国家标准食品微生物学检验菌落总数测定》。VA、VD、VE含量的测定参照GB 5009.82—2016《食品安全国家标准 食品中维生素A、D、E的测定》;VK1、VB1、VB2、VB6、VB12含量的测定分别参照GB 5009.158—2016《食品安全国家标准食品中维生素K1的测定》、GB 5009.84—2016《食品安全国家标准 食品中维生素B1的测定》、GB 5009.85—2016《食品安全国家标准 食品中维生素B2的测定》、GB 5009.154—2016《食品安全国家标准 食品中维生素B6的测定》、GB/T 5009.217—2008《保健食品中维生素B12的测定》;烟酸含量的测定参照GB 5009.89—2016《食品安全国家标准 食品中烟酸和烟酰胺的测定》;泛酸含量的测定参照GB 5009.210—2016《食品安全国家标准 食品中泛酸的测定》;叶酸、VC、生物素、胆碱含量的测定分别参照GB 5009.211—2014《食品安全国家标准 食品中叶酸的测定》、GB 5009.86—2016《食品安全国家标准 食品中抗坏血酸的测定》、GB 5009.259—2016《食品安全国家标准 食品中生物素的测定》、GB 5413.20—2013《食品安全国家标准 婴幼儿食品和乳品中胆碱的测定》;钠、钾和铜、镁、铁、锌、锰、钙含量的测定分别参照GB 5009.91—2017《食品安全国家标准 食品中钾、钠的测定》、GB 5009.13—2017《食品安全国家标准 食品中铜的测定》、GB 5009.241—2017《食品安全国家标准 食品中镁的测定》、GB 5009.90—2016《食品安全国家标准 食品中铁的测定》、GB 5009.14—2017《食品安全国家标准 食品中锌的测定》、GB 5009.242—2017《食品安全国家标准 食品中锰的测定》、GB 5009.92—2016《食品安全国家标准 食品中钙的测定》;磷、氯含量的测定分别参照GB 5009.87—2016《食品安全国家标准 食品中磷的测定》、GB 5009.44—2016《食品安全国家标准 食品中氯化物的测定》。
1.3.3 ENP的冲调实验
分别选取冲调水温为50~90 ℃(冲调水量为ENP质量的10 倍),冲调水量为ENP质量的5、10、15、20、25 倍(冲调水温为65 ℃)的条件进行实验,以冲调溶解性及冲调稳定性系数为指标,确定ENP的最适冲调水温及最佳冲调水量。
1.3.4 冲调特性的测定
1.3.4.1 溶解性测定
参照Anema等[16]的方法并略作修改,将一定质量(m0/g)的ENP配成质量分数5%的样品溶液,于30 ℃水浴搅拌30 min以确保样品完全分散,然后于3 000 r/min离心15 min,取上清液倒入已知质量(m2/g)的铝盒中,置于105 ℃烘箱中烘干至恒质量,记录干燥后的质量(m1/g)。冲调溶解性按公式(1)计算。
1.3.4.2 分散性测定
取去离子水80 mL于250 mL烧杯中,使用搅拌器以1 000 r/min的转速搅拌,而后将2.0 g样品快速加入烧杯中,同时按下秒表开始计时,观察样品在水中的分散情况,记录从搅拌开始到粉块全部分散所需要的时间。
1.3.4.3 结块率测定
精确称取10.0 g ENP样品于玻璃烧杯中,加60 mL 75 ℃的去离子水,静置10 min;然后取已知质量(m1/g)的20 目小筛子过滤,将筛网在105 ℃烘箱中烘至恒质量,带筛网称质量(m2/g),样品冲调结块率的计算见公式(2)。
1.3.4.4 稳定系数测定
精确称取1.0 g样品,用去离子水定容至100 mL,于625 nm波长处测定吸光度(A2),取一定体积的样品溶液于50 mL离心管中,于3 000 r/min离心20 min,取上清液稀释10 倍,于625 nm波长处测定吸光度(A1),稳定系数按公式(3)计算。
1.3.4.5 流动性的测定
采用注入法测定休止角,进而考察样品的流动性。将漏斗固定于坐标纸上方一定高度,准确称取25 g的ENP从漏斗加入,直到形成的堆积圆锥顶部与漏斗底部刚好接触,测定圆锥半径(r/cm)和漏斗底高度(h/cm),按公式(4)计算休止角(θ/(°))的正切值tan θ[17]。
1.3.4.6 鼻饲管流动性测定
将ENP样品与去离子水(75 ℃)以1∶10(m/V)的比例复水冲调成500 mL的营养液,转移到重力鼻饲管中,将鼻饲管放置于距离出液口量筒1 m处,记录1 min内流入500 mL量筒中营养液的体积,以此表征该样品鼻饲管流动性。
1.3.5 ENP颗粒粒径分布测定
用去离子水配制0.1 g/100 mL的ENP样品溶液,采用Mastersizer 2000激光粒度仪测定样品的粒径分布。参数设置为:介质水溶液、扫描角度90°、温度25 ℃、波长632.8 nm、介质折射率1.332、物质折射率1.45。
1.3.6 色泽的测定
取ENP样品于测试盒中,使用WSC-S色差计对样品表面进行测定,每个样品测定3 次取平均值。其中L*值代表亮度,a*值代表红绿度,b*值代表黄蓝度。颜色的校准用CR-400的标准白板,以未贮藏的样品为空白组。
1.3.7 脂质氧化程度的测定
通过测定硫代巴比妥酸反应产物(thiobarbituric acid reactive substances,TBARS)值来评估ENP贮藏期间脂质氧化情况,具体实验参照Wang等[18]的方法,并略有修改。准确称取1.5 g样品置于试管中,加入1.5 mL硫代巴比妥酸溶液,再加入7.5 mL、体积分数50%三氯乙酸-盐酸溶液,混匀后沸水浴中反应30 min,冷却后取5 mL溶液加入等体积的氯仿,于1 000 r/min下离心10 min,在532 nm波长处测定其吸光度。TBARS值按公式(5)计算。
式中:m表示样品质量/g。
1.3.8 ENP货架期的预测
选择加速破坏实验[19]对ENP的保质期进行预测,其通过提高产品贮存温度,加速微生物的繁殖,使产品品质在短时间内劣变,进而预测ENP的保质期。货架期预测模型计算见公式(6)。
式中:Q5表示温度相差5 ℃时货架期的比值;T1表示确定货架期的已知温度/℃;T2表示所求货架期的温度/℃;f1、f2分别表示在温度T1、T2条件下的货架期/d。
取各样品,均分为3 个批次,将这些产品分别贮存于47、42 ℃和37 ℃的恒温培养箱中,以菌落总数为考察指标。在47 ℃条件下的样品每隔10 d进行一次检测,在42 ℃条件下的样品每隔15 d测定一次,在37 ℃条件下的样品每30 d进行一次检测。并在贮藏当天对3 个温度下的样品进行起始菌落总数的测定。当菌落总数超标(菌落总数大于10 000 CFU/g,GB 29922—2013《食品安全国家标准 特殊医学用途配方食品通则》[20])时停止测定,记录贮存时间。依据每个样品在特定温度下的贮存时间,按公式(7)~(9)计算Q5。

式中:Q5表示温度相差5 ℃产品货架期比值;f47 ℃、f42 ℃、f37 ℃分别表示在47、42、37 ℃条件下产品的货架期/d。
再按公式(10)推算产品在常温25 ℃条件下的货架期(f25 ℃/d)。
1.4 数据处理与分析
采用Origin 8.6软件对数据进行分析与作图,采用SPSS 20.0软件进行方差分析,结果以平均值±标准差表示。
2 结果与分析
2.1 ENP的营养成分分析结果
表1 ENP的营养成分含量
Table 1 Nutrient contents of ENP
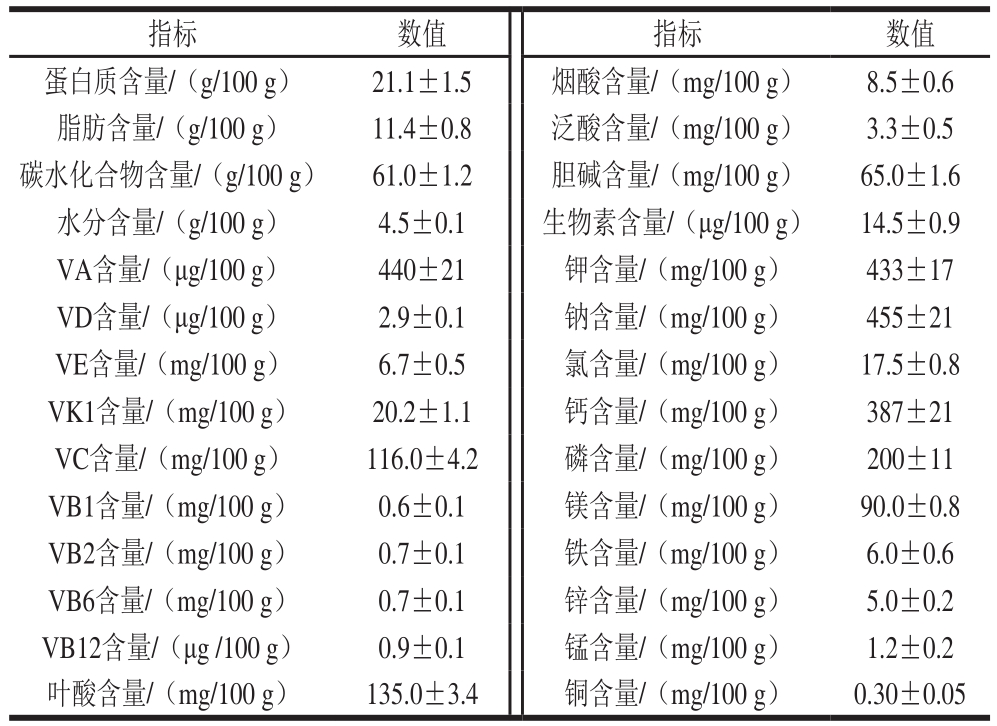
指标 数值 指标 数值蛋白质含量/(g/100 g) 21.1±1.5 烟酸含量/(mg/100 g) 8.5±0.6脂肪含量/(g/100 g) 11.4±0.8 泛酸含量/(mg/100 g) 3.3±0.5碳水化合物含量/(g/100 g) 61.0±1.2 胆碱含量/(mg/100 g) 65.0±1.6水分含量/(g/100 g) 4.5±0.1 生物素含量/(μg/100 g) 14.5±0.9 VA含量/(μg/100 g) 440±21 钾含量/(mg/100 g) 433±17 VD含量/(μg/100 g) 2.9±0.1 钠含量/(mg/100 g) 455±21 VE含量/(mg/100 g) 6.7±0.5 氯含量/(mg/100 g) 17.5±0.8 VK1含量/(mg/100 g) 20.2±1.1 钙含量/(mg/100 g) 387±21 VC含量/(mg/100 g) 116.0±4.2 磷含量/(mg/100 g) 200±11 VB1含量/(mg/100 g) 0.6±0.1 镁含量/(mg/100 g) 90.0±0.8 VB2含量/(mg/100 g) 0.7±0.1 铁含量/(mg/100 g) 6.0±0.6 VB6含量/(mg/100 g) 0.7±0.1 锌含量/(mg/100 g) 5.0±0.2 VB12含量/(μg /100 g) 0.9±0.1 锰含量/(mg/100 g) 1.2±0.2叶酸含量/(mg/100 g) 135.0±3.4 铜含量/(mg/100 g) 0.30±0.05
在临床应用中,ENP可作为唯一营养来源或部分营养补充,因此,要求ENP产品营养全面均衡,可以满足日常所需。为了评估本产品的营养成分,本实验测定了ENP中蛋白质、脂肪、碳水化合物、维生素、矿物质等营养成分。如表1所示,本团队开发的ENP产品各营养成分全面且均衡,可以满足《中国居民膳食营养素参考摄人量》的要求。同时,依据能量计算方法,每100 g产品可提供约1 817.5 kJ的能量,ENP产品符合GB 29922—2013中对产品的能量、蛋白质、脂肪、碳水化合物、各种维生素和矿物质等必需营养素含量的最大值和最小值的限定,以及各个营养素含量的要求。因此,基于ENP均衡的营养成分,其可以较好地为患者提供营养来源或营养补充,可作为特定人群的营养来源或补充。
2.2 冲调条件对ENP溶解性和稳定系数的影响
ENP在使用时,需用水或其他水溶液将粉剂冲调,最终以营养液的状态被食用,所以探究最佳的冲调条件对产品使用有重要意义。在实际使用中,水温及冲调水量是最容易控制的冲调条件,因此,本实验首先研究了不同冲调水温及冲调水量对ENP溶解性及稳定系数的影响,以反映产品冲调性的变化。
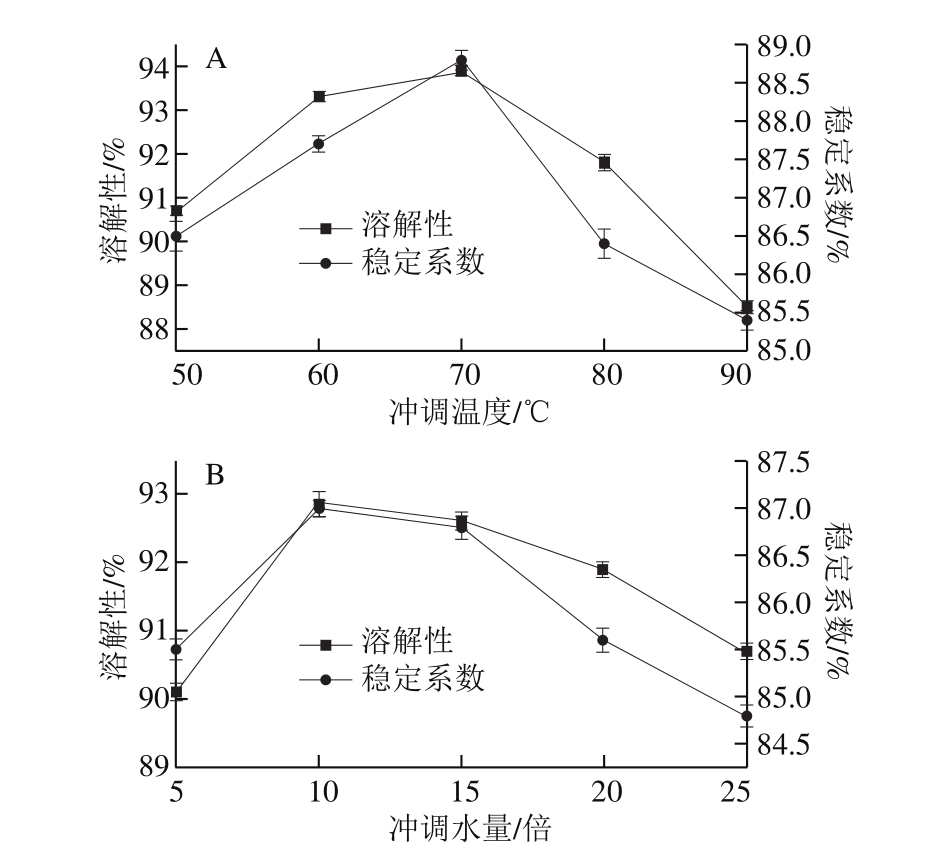
图1 冲调水温(A)及水量(B)对ENP溶解性及稳定系数的影响
Fig. 1 Effect of water temperature (A) and volume (B) on solubility and stability coefficient of ENP
由图1A可知,随着冲调水温的上升,ENP的溶解性及稳定系数均呈先上升后下降的趋势,在冲调水温为70 ℃时,ENP溶解性为93.9%,稳定系数为88.8%,ENP的冲调性最佳。这是因为在较低的冲调温度下,ENP和水分子的相互作用力较弱,样品中各组分并未充分溶解于水中,存在固-液两相分离[21],因此ENP的溶解性及稳定系数较低;而随着冲调温度的升高,溶质分子和水分子的扩散及热运动加快,从而ENP的冲调性得以提高;但温度过高时,ENP中蛋白质变性,油脂聚集,溶质分子间产生较大的排斥力,出现凝结沉淀现象,从而降低了ENP的冲调品质。因此,适度的水温可使产品迅速均匀溶解,且不易产生凝块,便于食用。
冲调水量将决定产品冲调后溶液的稀稠程度,影响消费者的感官评价。在满足营养需求的前提下,溶液过稀时会导致总体供给量增加;而溶液过黏稠时,会导致饮用不便,使用鼻饲管时难度增加,所以适宜的冲调水量可使产品发挥最佳使用效果[22]。由图1B可知,ENP溶解性及稳定系数随着冲调水量的增加呈先上升后下降的趋势,在冲调水量为ENP质量的10 倍时均达到最大,分别为92.9%和87%,即表现为最佳的冲调性。可见冲调水量的增加会提高ENP的溶解性及稳定系数,使冲调性增强,但水量过多,ENP稀释程度变大,其组分间相互作用也变弱,从而导致冲调性降低。
2.3 ENP贮藏期间冲调特性的变化
ENP属于针对无法进食的住院患者和营养不良的特殊人群开发的专用型营养类产品,具有保质期长、便于贮存运输等优点,但贮藏条件会对ENP的品质稳定性产生一定影响。因此有必要对产品品质的稳定性进行评估,不同贮藏条件下ENP冲调性的变化见表2。
表2 不同贮藏条件下ENP冲调性的变化
Table 2 Changes in reconstitution characteristics of ENP during storage under different conditions
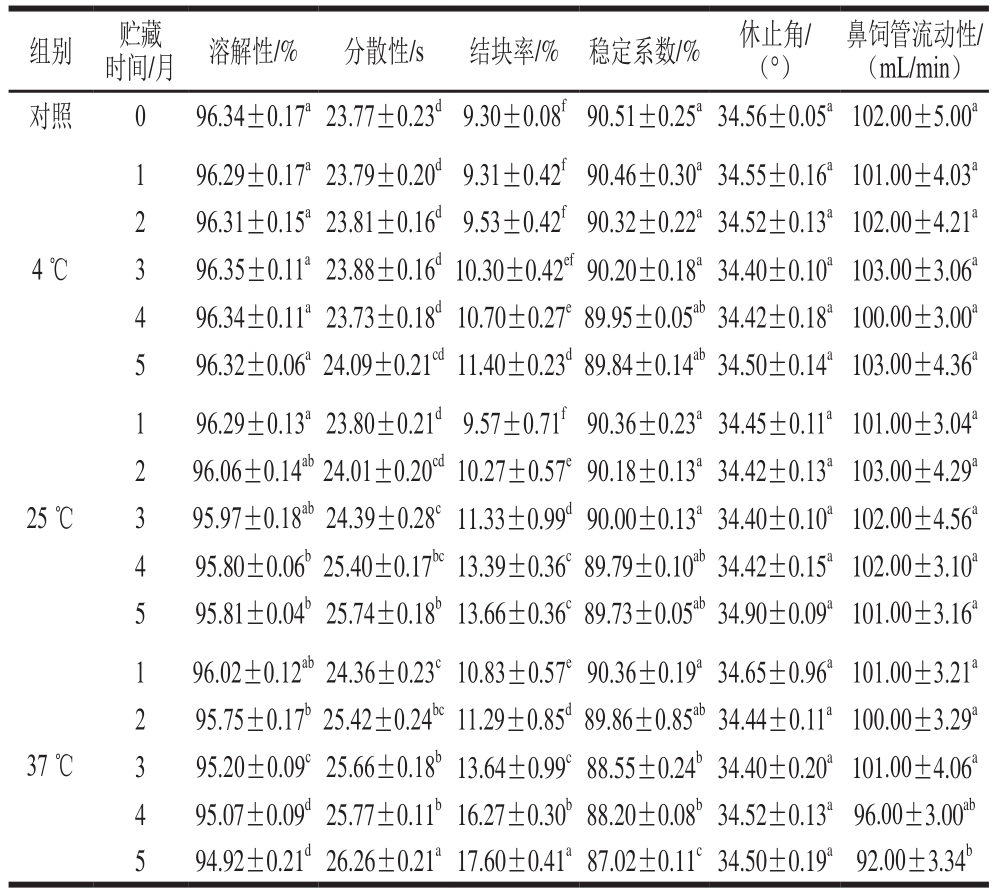
注:同列肩标小写字母不同表示差异显著(P<0.05)。
组别 贮藏鼻饲管流动性/(mL/min)对照 0 96.34±0.17a23.77±0.23d9.30±0.08f90.51±0.25a34.56±0.05a102.00±5.00a时间/月 溶解性/% 分散性/s 结块率/% 稳定系数/% 休止角/(°)4 ℃1 96.29±0.17a23.79±0.20d9.31±0.42f90.46±0.30a34.55±0.16a101.00±4.03a 2 96.31±0.15a23.81±0.16d9.53±0.42f90.32±0.22a34.52±0.13a102.00±4.21a 3 96.35±0.11a23.88±0.16d10.30±0.42ef90.20±0.18a34.40±0.10a103.00±3.06a 4 96.34±0.11a23.73±0.18d10.70±0.27e89.95±0.05ab34.42±0.18a100.00±3.00a 5 96.32±0.06a24.09±0.21cd11.40±0.23d89.84±0.14ab34.50±0.14a103.00±4.36a 25 ℃1 96.29±0.13a23.80±0.21d9.57±0.71f90.36±0.23a34.45±0.11a101.00±3.04a 2 96.06±0.14ab24.01±0.20cd10.27±0.57e90.18±0.13a34.42±0.13a103.00±4.29a 3 95.97±0.18ab24.39±0.28c11.33±0.99d90.00±0.13a34.40±0.10a102.00±4.56a 4 95.80±0.06b25.40±0.17bc13.39±0.36c89.79±0.10ab34.42±0.15a102.00±3.10a 5 95.81±0.04b25.74±0.18b13.66±0.36c89.73±0.05ab34.90±0.09a101.00±3.16a 1 96.02±0.12ab24.36±0.23c10.83±0.57e90.36±0.19a34.65±0.96a101.00±3.21a 2 95.75±0.17b25.42±0.24bc11.29±0.85d89.86±0.85ab34.44±0.11a100.00±3.29a 3 95.20±0.09c25.66±0.18b13.64±0.99c88.55±0.24b34.40±0.20a101.00±4.06a 4 95.07±0.09d25.77±0.11b16.27±0.30b88.20±0.08b34.52±0.13a96.00±3.00ab 5 94.92±0.21d26.26±0.21a17.60±0.41a87.02±0.11c34.50±0.19a92.00±3.34b 37 ℃
溶解性、分散性和结块率是评价干粉复水情况的重要指标。从表2可见,4 ℃贮藏条件下,随着贮藏时间的延长,ENP溶解性、分散性无显著性变化,结块率缓慢增加;25 ℃时,ENP溶解性略微下降,而分散性和结块率有所增加;但在37 ℃贮藏条件下,ENP的分散性和结块率增加显著,贮藏5 个月时最大,分别为26.26 s和17.60%,与对照组相比,分别增加了10.48%、89.25%,而其溶解性在贮藏5 个月时下降了1.47%,这可能是因为高温贮藏加速了ENP中油脂与其他成分的交联作用,导致产品结块或凝结,从而使结块率增加,进而造成ENP冲调需要更长的分散时间,最终影响产品的溶解性[23]。研究发现,粉末产品中脂质含量与其溶解性紧密相关[24]。稳定系数主要用于评价粉末产品复水冲调后的稳定性。与溶解性结果相似,37 ℃贮藏条件下ENP产品的稳定系数最低,范围在87.02%~90.36%之间,与对照组相比,贮藏5 个月时下降了3.86%。这是因为高温贮藏条件下,ENP中蛋白质变性,油脂氧化聚集,配制成溶液后导致凝结沉淀现象的发生[24],从而使得ENP的稳定系数降低。而在整个贮藏期间,4 ℃和25 ℃贮藏条件下,ENP的稳定系数没有发生显著性变化,表明产品贮藏稳定性较好。在流动性的测定中,休止角增大则意味着产品流动性变差。在所有温度下,贮藏至第5个月时,ENP产品的休止角没有发生显著性变化,表明ENP产品贮藏期内具有较好的流动性。鼻饲管流动性用来反映是否因产品黏度和结块的原因使其无法在鼻饲管中流动,以此评价产品品质的优劣[11]。鼻饲管流动性在整个贮藏期间一直处于92~103 mL/min范围内,整体上未发生显著性变化。综上可知,尽管贮藏条件会对ENP的冲调性产生一定影响,但在低温贮藏条件下,ENP可以保持较好的冲调性,保证产品的品质稳定性。
2.4 ENP贮藏期间的粒径分布
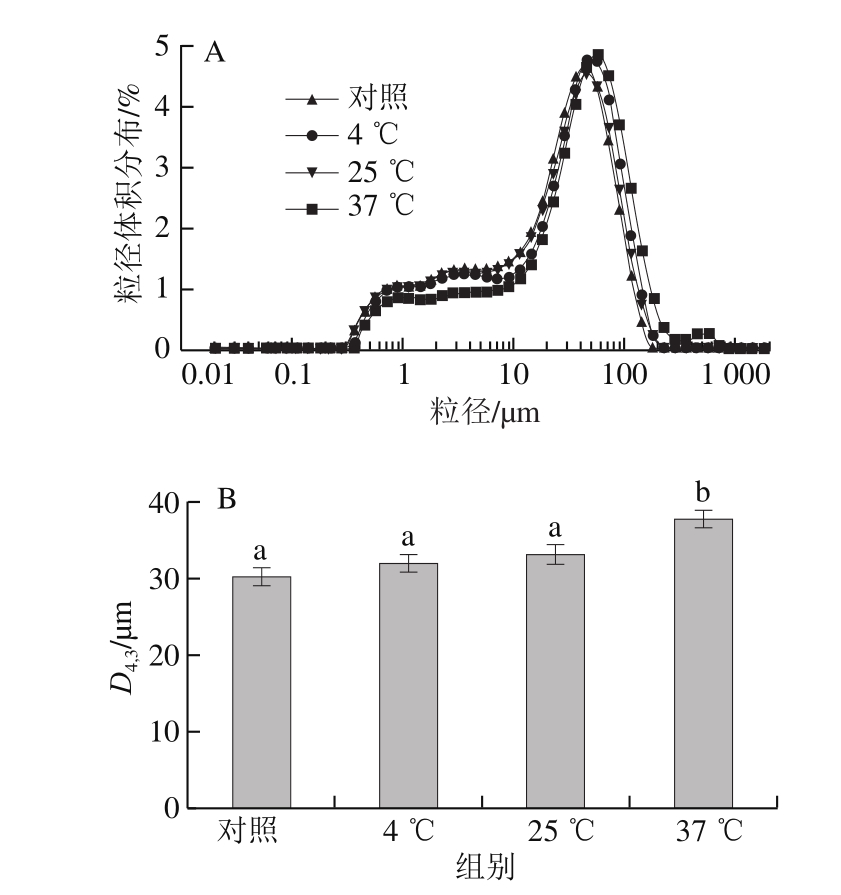
图2 不同贮藏温度下ENP的粒径体积分布(A)和D4,3(B)
Fig. 2 Particle size distribution (A) and D4,3 (B) of ENP under different storage temperatures
图B中小写字母不同表示差异显著(P<0.05)。
粉体的冲调特性与颗粒的大小有关,选取各温度下贮藏第5个月的样品进行粒径分布测定,并计算体积平均粒径(D4,3)。由图2A可知,各样品的粒径分布图均呈多峰分布,且峰分布范围较宽,粒径体积分布在0.5~1 000 μm之间,这是ENP中多组分共存所导致的。与对照组相比,3 个温度贮藏组粒径分布峰有向大粒径方向平移的趋势,表明粒径有增大趋势。由图2B可知,贮藏前ENP(对照)的D4,3为30.18 μm,样品在4、25、37 ℃下贮藏5 个月后D4,3发生变化,分别为31.99、33.20 μm和37.79 μm,且37 ℃贮藏下ENP的D4,3显著高于其他3 组,其他3 组间无显著差异。D4,3的增大可能是贮藏期间ENP的组成成分发生聚集所致。研究表明样品溶解过程其实质是一个传质过程。水由水相主体传递到样品颗粒表面,进而扩散进入颗粒内部,在颗粒的内外表面处溶解颗粒,被溶解的颗粒进入水相并从颗粒内部扩散至颗粒外表面,再从颗粒的外表面通过扩散或对流传递到水相主体,直至颗粒完全溶解[25]。在这一传递过程中,根据分子传质理论可知,颗粒的直径影响传质速率,较小的颗粒直径有利于颗粒的冲调性[26]。本研究中,ENP蛋白源采用的是速溶性蛋清粉,其具有较小的颗粒尺寸,因此保证了产品较好的冲调特性。
2.5 ENP贮藏期间色泽的变化
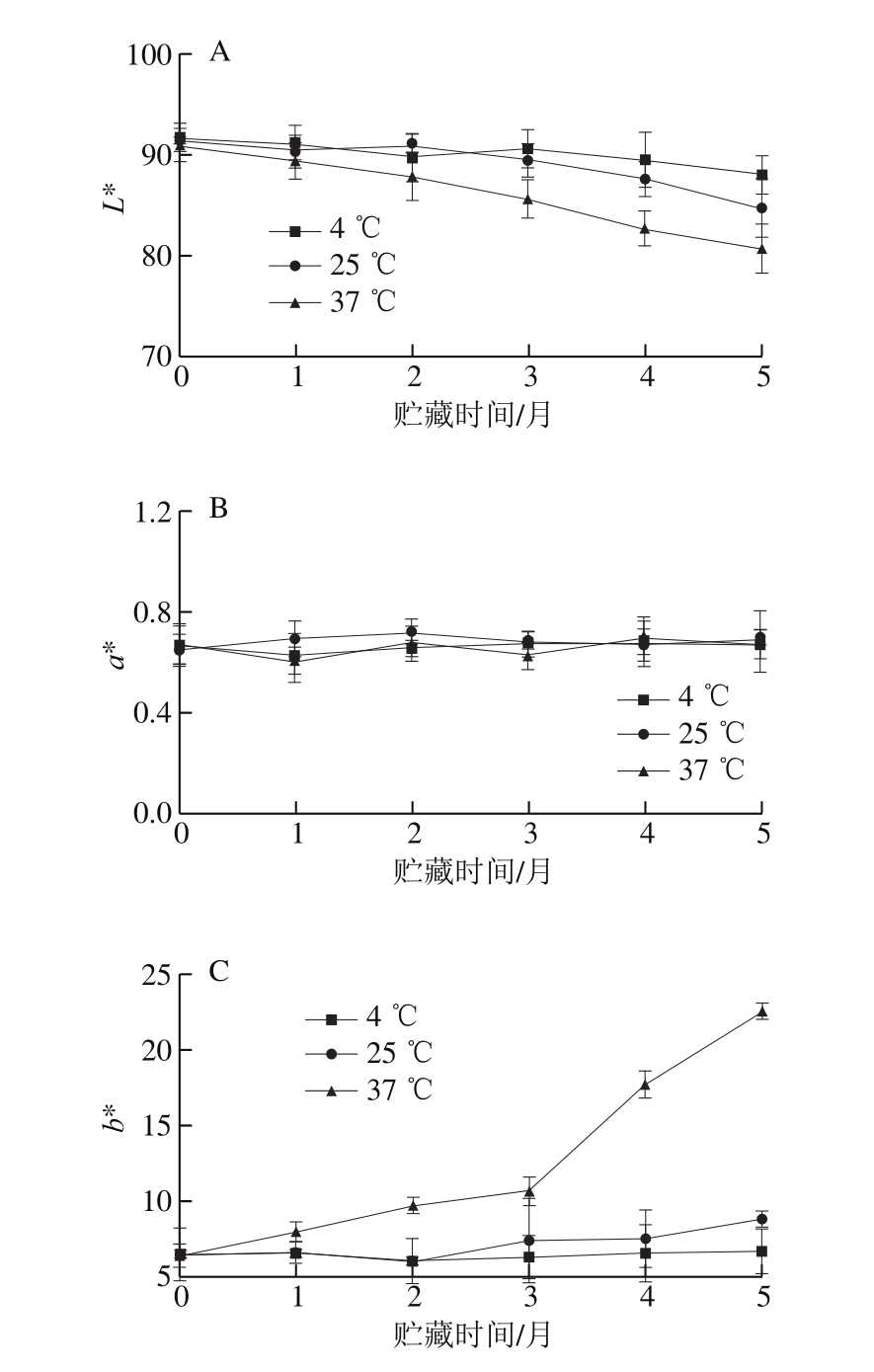
图3 不同贮藏温度和时间对ENP色泽的影响
Fig. 3 Effects of different storage temperatures and times on the color of ENP
A. L*;B. a*;C. b*。
外观色泽是粉末类产品品质的重要考查指标,直接影响消费者对该产品的满意度。由图3可知,在4 ℃贮藏条件下,ENP样品的L*、a*、b*值整体上没有发生明显变化。但在25 ℃和37 ℃条件下,随着贮藏时间的延长,ENP的L*值呈下降趋势,b*值表现为上升趋势,而a*值没有发生明显变化,尤其贮藏3 个月后,ENP的L*和b*值出现明显变化,表明贮藏使ENP颜色变得暗黄,研究表明,贮藏期间蛋清粉中也有相似的颜色变化[19]。这归因于贮藏期间,ENP发生了美拉德反应,生成了类黑素等黄色物质,使得样品的外观色泽发生了变化。同时,贮藏后期(3 个月以后),微生物使得ENP中的蛋白质和淀粉水解,产生了更多的氨基和羰基,促使美拉德反应加剧,黄色产物含量增加,最终导致ENP的L*和b*值出现明显变化[27]。对比可知,37 ℃组的变化程度显著高于25 ℃组,即贮藏温度越高变化越明显,因为高温有利于美拉德反应的进行。ENP色泽的变化会对其感官品质产生不利影响;因此,短期贮藏产品时,可于室温条件(25 ℃左右)下进行,若需要长期贮藏,适于低温条件(4 ℃左右)下贮藏。
2.6 ENP贮藏期间TBARS值变化
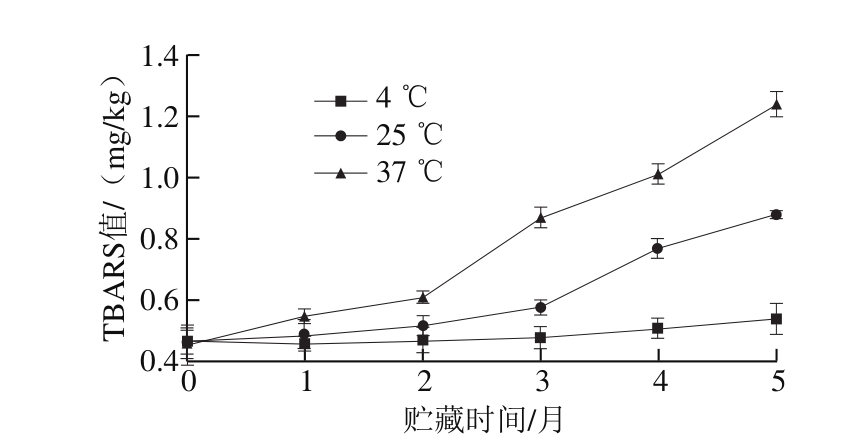
图4 不同贮藏温度和时间对ENP 的TBARS值影响
Fig. 4 Effects of different storage temperatures and times on TBARS value of ENP
ENP配方中添加了一定量的脂肪,因此考察产品贮藏期间的脂质氧化情况,有利于对其品质稳定性的分析。贮藏过程过中,由于受到光和氧气的作用,以及样品中存在的变价金属(Fe、Cu、Zn)、自由基等物质,可诱发脂肪发生氧化反应,包括自动氧化及光敏氧化等,导致产品酸败,品质下降。如图4所示,随着贮藏时间的延长,各贮藏温度ENP的TBARS值整体均呈上升的趋势,在贮藏2 个月后,25 ℃和37 ℃贮藏组样品的TBARS值增加幅度较大,在贮藏5 个月时,其分别增加至0.88 mg/kg和1.24 mg/kg,而低温(4 ℃)条件下TBARS值较贮藏初期仅增加14.89%。这表明由于ENP含有一定量的油脂,在贮藏过程中脂肪由于受到光、氧气及自由基的作用发生了氧化反应,并产生低分子产物,因此导致TBARS值增加[28]。同时,高温可以加速这一反应,加剧了产品的氧化程度。Fávaro等[13]也发现低温(<30 ℃)避光环境保存,可使ENP产品保持较好的营养品质。
2.7 ENP保质期的预测结果
加速性破坏实验指的是将产品处于极其恶劣的贮存条件下,固定时间间隔对某一指标进行测定,用以预测产品的货架期。ENP的加速实验结果如图5所示。加速破坏实验的准确性与引起食品质量损失的质量参数的确定、温度范围的选择等相关。本实验选取47、42 ℃和37 ℃ 3 个温度进行加速实验,以菌落总数为测定指标,预测ENP的保质期[29]。由图5可知,随贮藏时间的延长,ENP菌落总数均呈不断增加的趋势。在47 ℃条件下产品贮藏期为70 d;42 ℃条件下产品贮藏期为120 d;37 ℃条件下产品贮藏期为180 d。根据公式(7)~(9)计算得到Q5’=1.5、Q5”=1.71、Q5=1.61。根据公式(10)计算ENP在常温25 ℃条件下的货架期为569 d,因此本产品的保质期至少为18 个月。
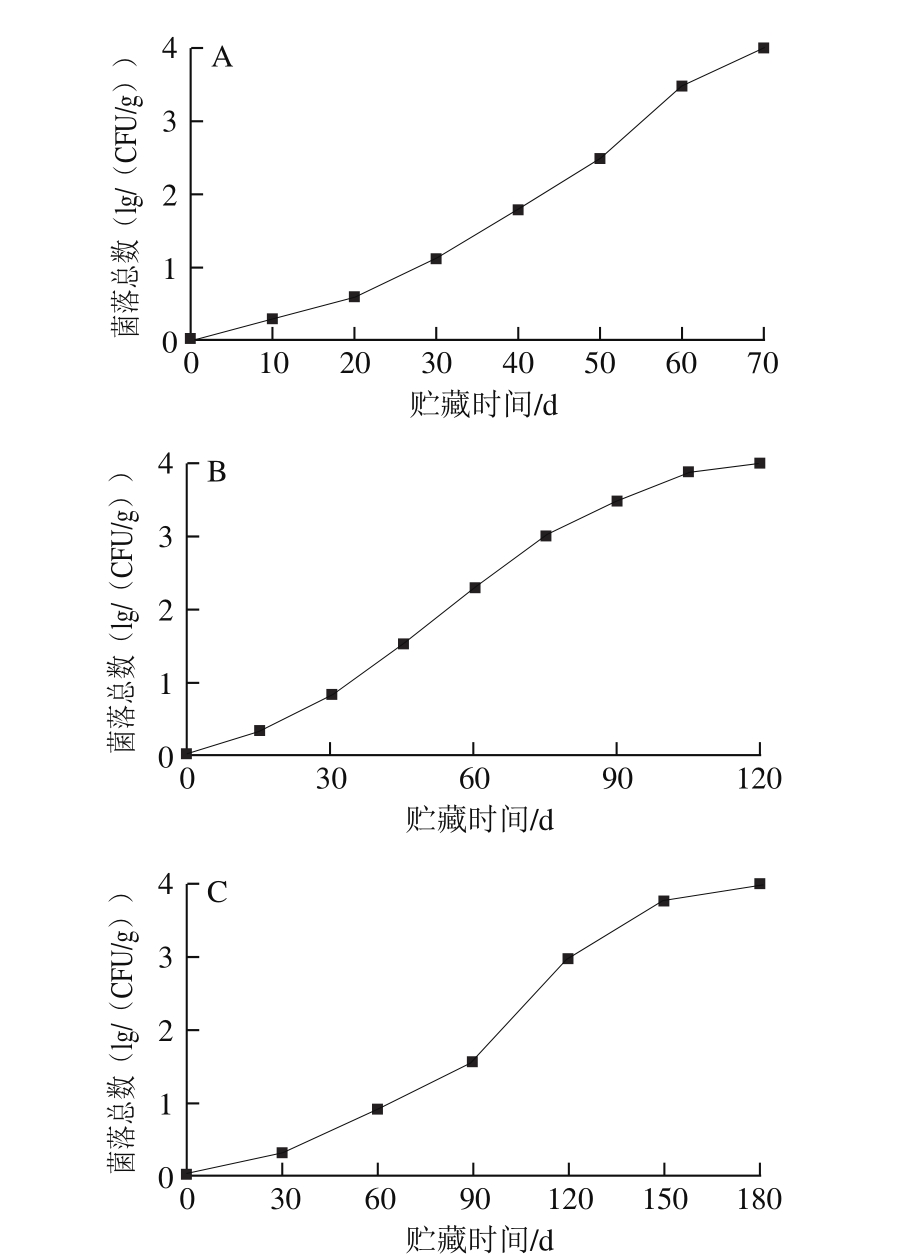
图5 47(A)、42(B)、37 ℃(C)条件下ENP菌落总数生长曲线
Fig. 5 Bacterial growth curves of ENP at 47 (A), 42 (B) and 37 ℃ (C)
3 结 论
本实验针对本团队开发的蛋清蛋白源ENP的营养组成、冲调特性及品质稳定性进行分析及评估,发现该ENP产品营养全面均衡、冲调特性优良、产品品质稳定。经实验优化,最佳冲调条件为水温70 ℃,冲调水量为粉体质量的10 倍。通过不同贮藏条件下ENP冲调性和品质稳定性的对比可知,低温(4 ℃)环境有利于该产品的贮藏,可最大程度保持原有的品质特性。经加速实验预测,其保质期可达18 个月。基于ENP的良好贮藏稳定性,其具有广阔的市场前景。在后续的工作中将进一步对该产品的动物实验及临床实验进行研究。
[1] 马永轩, 张名位, 张瑞芬, 等. 我国特殊医学用途配方食品的现状[J].食品研究与开发, 2018, 39(21): 221-224. DOI:10.3969/j.issn.1005-6521.2018.21.037.
[2] 刘志文, 林海峰. 肠内营养支持的整体研究进展[J]. 世界最新医学信息文摘, 2015, 15(20): 20; 23. DOI:10.3969/j.issn.1671-3141.2015.20.013.
[3] GRAMLICH L, KICHIAN K, PINILLA J, et al. Does enteral nutrition compared to parenteral nutrition result in better outcomes in critically ill adult patients? a systematic review of the literature[J]. Nutrition,2004, 20(10): 843-848. DOI:10.1016/j.nut.2004.06.003.
[4] KREYMANN K G, BERGER M M, DEUTZ N E P, et al. ESPEN guidelines on enteral nutrition: intensive care[J]. Clinical Nutrition,2006, 25(2): 210-223. DOI:10.1016/j.clnu.2006.01.021.
[5] 迟玉杰. 蛋制品加工技术[M]. 北京: 中国轻工业出版社, 2011: 34-39.
[6] 魏翠翠. 国内外肠内营养制剂调查报告[J]. 食品与药品, 2010,12(7): 270-273. DOI:10.3969/j.issn.1672-979X.2010.04.014.
[7] 刘静波, 刘雪, 宫新统. 一种含咸蛋清蛋白多肽的肠内营养制剂及其制备方法: CN102429149A[P]. 2012-05-02[2019-06-15]. http://dbpub.cnki.net/grid2008/dbpub/detail.aspx?dbcode=SCPD&dbname=SCPD2012&filename=CN102429149A.
[8] 吴园涛, 蔡冰娜, 孙恢礼. 牡蛎肽肠内营养制剂的研制和灭菌工艺研究[J]. 广东农业科学, 2010, 37(3): 182-185. DOI:10.16768/j.issn.1004-874x.2010.03.006.
[9] 赵清波, 吴文惠, 周喻, 等. 蚕蛹蛋白肠内营养制剂干预2型糖尿病小鼠代谢特性的研究[J]. 食品工业科技, 2014, 35(23): 342-346.DOI:10.13386/j.issn1002-0306.2014.23.064.
[10] 舒晓亮, 唐诗平, 赵坚. 一种整蛋白型肠内营养多聚合剂:CN104256595A[P]. 2015-01-07[2019-06-15]. http://dbpub.cnki.net/grid2008/dbpub/detail.aspx?dbcode=SCPD&dbname=SCPD2015&fil ename=CN104256595A.
[11] 张凌泓. 临床营养粉剂的冲调性评价及影响因素分析[D]. 武汉: 华中农业大学, 2013: 21-25; 61-62.
[12] GARCÍA-BA ÑOS J L, DEL CASTILLO M D, SANZ M L,et al. Maillard reaction during storage of powder enteral formulas[J]. Food Chemistry, 2005, 89(4): 555-560. DOI:10.1016/j.foodchem.2004.03.008.
[13] FÁVARO R M D, IHA M H, MAZZI T C, et al. Stability of vitamin A during storage of enteral feeding formulas[J]. Food Chemistry, 2011,126(3): 827-830. DOI:10.1016/j.foodchem.2010.09.014.
[14] 迟玉杰, 赵英, 孙临政. 一种高速溶性、无苦腥味蛋清粉的制备方法: CN103263036A[P]. 2013-08-28[2019-06-15]. http://dbpub.cnki.net/grid2008/dbpub/detail.aspx?dbcode=SCPD&dbname=SCPD2013&filename=CN103263036A.
[15] 迟玉杰, 赵英, 王俊彤, 等. 一种营养全面、易消化吸收的肠内营养粉及其制备方法: CN201710126291.2[P]. 2017-03-06[2019-06-15].http://dbpub.cnki.net.neau.vpn358.com/grid2008/dbpub/detail.aspx?db code=SCPD&dbname=SCPD2017&filename=CN107006843A.
[16] ANEMA S G, PINDER D N, HUNTER R J, et al. Effects of storage temperature on the solubility of milk protein concentrate (MPC85)[J].Food Hydrocolloids, 2006, 20(2/3): 386-393. DOI:10.1016/j.foodhyd.2005.03.015.
[17] 刘静波, 马爽, 刘博群, 等. 不同干燥方式对全蛋粉冲调性能的影响[J]. 农业工程学报, 2011, 27(12): 383-388. DOI:10.3969/j.issn.1002-6819.2011.11.068.
[18] WANG L L, XIONG Youling L.. Inhibition of lipid oxidation in cooked beef patties by hydrolyzed potato protein is related to its reducing and radical scavenging ability[J]. Journal of Agricultural and Food Chemistry, 2005, 53(23): 9186-9192. DOI:10.1021/jf051213g.
[19] RAO Q C, JEANCARLO R, SCHOENFUSS T C, et al. Accelerated shelf-life testing of quality loss for a commercial hydrolysed hen egg white powder[J]. Food Chemistry, 2012, 135(2): 464-472.DOI:10.1016/j.foodchem.2012.05.025.
[20] 国家卫生和计划生育委员会. 食品安全国家标准 特殊医学用途配方食品通则: GB 29922—2013[S]. 北京: 中国标准出版, 2013: 1-10.
[21] 华家才, 尤玉如, 钱锋, 等. 婴幼儿配方奶粉生产工艺关键技术对溶解冲调性的影响[J]. 中国乳品工业, 2007, 35(10): 22-25.DOI:10.3969/j.issn.1001-2230.2007.10.006.
[22] 杜连启, 乔亚科, 吕晓琳. 可冲调紫甘薯粉的研制[J]. 食品研究与开发, 2011, 32(9): 96-99. DOI:10.3969/j.issn.1005-6521.2011.09.029.
[23] LIU F X, CAO X M, WANG H Y, et al. Changes of tomato powder qualities during storage[J]. Powder Technology, 2010, 204(1): 159-166. DOI:10.1016/j.powtec.2010.08.002.
[24] 闫忠心, 靳义超. 喷雾干燥温度对牦牛乳粉溶解特性的影响[J].食品科学, 2016, 37(7): 23-26. DOI:10.7506/spkx1002-6630-201607005.
[25] 王晓莹, 迟玉杰, 赵英, 等. 响应面法优化蛋黄粉冲调条件的研究[J]. 中国家禽, 2014, 36(12): 23-27. DOI:10.3969/j.issn.1004-6364.2014.12.007.
[26] 王绍亭, 陈涛. 化工传递过程基础传质理论[M]. 北京: 化学工业出版社, 1987: 20-25.
[27] MA Y Q, ZHAO Y, CHI Y J. Changes in the gel characteristics of two hen egg white powders modified by dry heating and the Maillard reaction during long-term storage[J]. LWT-Food Science and Technology, 2019, 109: 123-129. DOI:10.1016/j.lwt.2019.04.003.
[28] 孙曙庆. 油脂氧化稳定性的研究[J]. 食品与发酵工业, 1999, 25(3):20-22. DOI:10.3321/j.issn:0253-990X.1999.03.005.
[29] OZTURK I, SAGDIC O, YALCIN H, et al. The effects of packaging type on the quality characteristics of fresh raw pistachios (Pistacia vera L.) during the storage[J]. LWT-Food Science and Technology,2016, 65: 457-463. DOI:10.1016/j.lwt.2015.08.046.