如今,快节奏的工作生活环境使机体极易处于氧化应激状态。在正常条件下,机体的酶防御体系发挥着非常重要的作用,超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)等通过清除多余的自由基来减缓氧化损伤[1]。当活性氧自由基大量产生,其在体内的聚集程度超过机体抗氧化系统自身的清除能力时,则会诱发脂质过氧化反应、DNA损伤以及蛋白质表达异常。因此,氧化应激被认为是衰老的早期阶段[2-5]。近年来,人们不断寻求具有防护氧化应激损伤作用的天然活性成分。
灵芝(Ganoderma lucidum)在中国有悠久的使用历史,素有“仙草”的美名[6]。在《本草纲目》中有“补中益气,增智慧,好颜色,久食轻身不老,延年神仙”的描述[7]。灵芝多糖(Ganoderma lucidum polysaccharide,GLP)是灵芝的重要活性成分之一,已有研究发现GLP在抗氧化功效方面具有出色的表现[8-12]。以往GLP的提取来源多为子实体,因其木质化严重、提取率较低。而从灵芝菌丝体中提取多糖的研究,因其较短的周期以及较高的提取效率越来越引起人们的重视[13-15]。与此同时,GLP常因其来源不同而在单糖组成上存在明显差异[16]。通常高生物活性的GLP大多拥有主链长、侧链变异频率高、分子质量较大等特点。一般认为,分子质量高于10 kDa的GLP具有较高生物活性,小于此值则活性很低[17]。因此,高活性GLP的筛选及其机制研究则显得尤为重要。
除了机体自身抗氧化酶系统发挥防护氧化应激的作用机制外,Kelch样环氧氯丙烷相关蛋白-1(Kelch-like ECH-associated protein-1,Keap1)-核因子-E2相关因子(nuclear factor-erythroid 2-related factor 2,Nrf2)/抗氧化反应元件(antioxidant response element,ARE)信号通路被认为是机体最重要的内源性抗氧化信号通路。Keap1-Nrf2/ARE途径表达的蛋白质分子为机体提供了重要的防御作用,是对抗环境有害物质损伤和内源性应激的有力武器[18-23]。分析该信号通路中重要活性分子的表达水平变化,对于深入分析物质发挥防护氧化应激损伤的内在机制具有非常重要的意义。
鉴于此,本研究以实验室保存灵芝菌种G055为研究对象,采用常规热水浸提法[24]对GLP进行工艺条件的优化,并进一步初步纯化及分析。同时以H2O2诱导的人皮肤成纤维细胞(human skin fibroblasts,HSF)损伤模型为研究载体,分析GLP及其组分对细胞内活性氧(reactive oxygen species,ROS)、丙二醛(malondialdehyde,MDA)及相关抗氧化酶的作用效果,评价GLP对H2O2诱导的HSF氧化应激的保护及修复功效;最后,以Keap1-Nrf2/ARE信号通路上下游关键调控因子为重要考察对象,探究其在mRNA水平的变化。
1 材料与方法
1.1 材料及试剂
灵芝菌种G055来自于实验室保藏菌种;HSF 中国医学科学院基础医学研究所细胞资源中心;抗坏血酸(纯度≥99.7%)国药集团化学试剂有限公司;0.25%(含乙二胺四乙酸)胰蛋白酶、DMEM培养基、FM培养基、新生牛血清、PBS、1×105 U/L青霉素、100 mg/L链霉素美国Gibco生命技术公司;EasyScript® One-Step gDNA Removal and cDNA Synthesis SuperMix反转录试剂盒、TransStart® Top Green qPCR SuperMix试剂盒 北京全式金生物技术有限公司;GSH-Px、MDA、SOD、CAT、ROS检测试剂盒 碧云天生物技术有限公司。
1.2 仪器与设备
WJ-80A-II型CO2恒温培养箱 上海圣科仪器设备有限公司;荧光倒置显微镜 日本Olympus公司;Infinite M200 PRO荧光酶标仪、Sunrise酶标仪 瑞士TECAN公司;SPx-250BF-2生化培养箱 上海福玛实验设备有限公司;Anke 3-30K台式高速冷冻离心机 德国Sigma公司;1200高效液相色谱仪 美国安捷伦有限公司;DEAE-52阴离子交换层析柱 北京英莱克科技发展有限公司;DHL-A电脑恒流泵 上海沪西分析仪器厂有限公司。
1.3 方法
1.3.1 GLP提取工艺的确定
将经过活化的G055灵芝液体菌种以体积比1∶10的接种量接种于土豆培养基培养中,置于28 ℃ 180 r/min培养箱中培养7 d。将所得灵芝菌丝体水洗2 遍,冷冻干燥得到灵芝菌丝体冻干粉。取1 g样品粉末,并按表1条件进行单因素试验,每组重复3 组,5 000 r/min离心10 min,按照苯酚-硫酸法[25]测定提取液中的多糖含量。根据单因素试验结果,设计三因素三水平正交试验(表2),通过正交试验得到最优提取条件。
表1 单因素试验条件
Table 1 Independent variables and their levels used in one-factor-at-a-time design
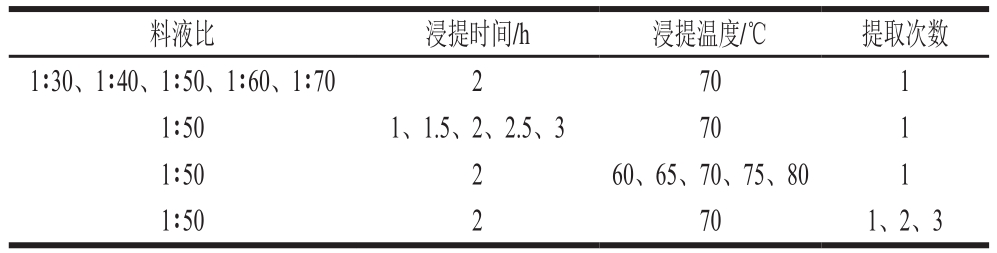
料液比 浸提时间/h 浸提温度/℃ 提取次数1∶30、1∶40、1∶50、1∶60、1∶70 2 70 1 1∶50 1、1.5、2、2.5、3 70 1 1∶50 2 60、65、70、75、80 1 1∶50 2 70 1、2、3
表2 三因素三水平正交试验
Table 2 Independent variables and their levels used in orthogonal array design
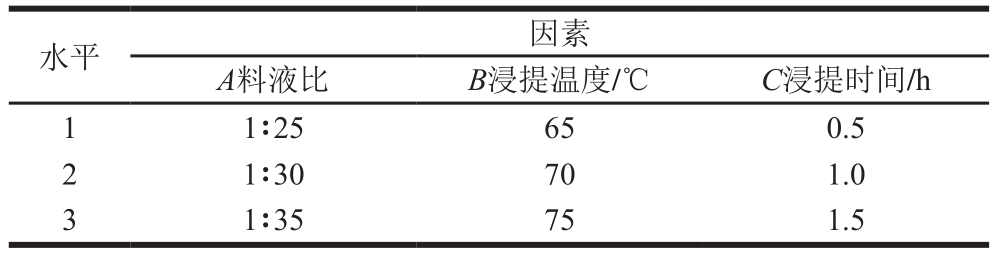
水平 因素A料液比 B浸提温度/℃ C浸提时间/h 1 1∶25 65 0.5 2 1∶30 70 1.0 3 1∶35 75 1.5
1.3.2 GLP的初步纯化及鉴定
采用Sevag法[26]将热水浸提后的粗多糖溶液进行脱蛋白处理,具体操作如下:10 g/L的粗多糖溶液以体积比1∶5加入Sevag试剂(氯仿-正丁醇体积比5∶1)中,电磁搅拌30 min后,转移至分液漏斗中静置10 min,除去两相交界处的变性蛋白质。水层取样测蛋白质量浓度和多糖质量浓度[25],分别按照公式(1)、(2)计算多糖损失率及蛋白去除率。
采用DEAE-52离子交换柱对脱蛋白后的粗多糖进行初步分离[26],具体操作如下:取脱蛋白后的GLP配制成10 g/L的多糖溶液,上样量20 mL。上样前过0.22 µm孔径聚醚砜滤膜,除去不溶物。分别用去离子水和0.1、0.3、0.5 mol/L NaCl以1.0 mL/min的流速分步洗脱,每种洗脱液收集30 管,每管10 mL。用苯酚-硫酸法检测OD值,作洗脱曲线。合并相同峰组分。透析过夜后在-80 ℃ 0.03 mbar条件下冷冻干燥成粉末。对所得各组分进行纯度测定。
采用气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)对各组分进行单糖组成分析测定,具体方法为:称取2 mg纯化后的多糖,加入2 mol/L三氟乙酸5 mL,充氮气排除空气,然后120 ℃水解反应4 h,加入无水甲醇,反复旋蒸除去有机溶剂,最后溶于2 mL去离子水中,混匀,取100 µL于新的离心管中,加入氘标记的琥珀酸(10 µL、1.5 g/L)真空冷冻干燥。在冻干样品中加入20 g/L的甲氧基铵盐酸盐/吡啶溶液50 μL,40 ℃水浴反应80 min,反应结束后加入80 μL N-甲基-N-三甲基硅基三氟乙酰胺,于40 ℃水浴在反应80 min,然后12 000 r/min离心5 min,取上清液放入进样瓶,室温放置2 h后,进行GC-MS分析[27]。GC-MS条件:采用HP-5 GC柱(30 m×0.32 mm,0.25 μm);进样量1 μL;分流比为10∶1;进样口温度250 ℃;检测温度240 ℃;载气N2,流速1 mL/min;升温程序为初始温度110 ℃,保持2 min,8 ℃/min升到160 ℃,再以2 ℃/min升到230 ℃,最后5 ℃/min升到250 ℃,保持2 min。
1.3.3 GLP对HSF细胞抗氧化相关指标的影响
细胞模型的建立:将HSF细胞以孔1×104 个/孔接种于96 孔板中,在细胞培养箱中培养过夜,弃去培养基,分别添加100 μL含不同浓度H2O2(1、25、50、100、250、500、1 000 μmol/L)的培养基,各组均设5 个平行,对照组不添加H2O2。刺激1、2、3、4 h后,采用四甲基偶氮唑盐法[28],于490 nm波长处测定各孔OD值。得出HSF细胞存活率,选择细胞存活率为50%的H2O2溶液浓度作为建模浓度,最终确定的建模条件为100 μmol/L H2O2处理细胞2 h。
GLP及其各组分、阳性对照VC处理浓度的确定:将HSF细胞以1×104 个/孔接种于96 孔板中,在细胞培养箱中培养过夜。采用四甲基偶氮唑盐微量酶反应比色法[28],探讨不同浓度GLP及其各组分、阳性对照VC对细胞活力的影响(条件参照细胞模型的建立方法,即用100 μL不同浓度样品替代H2O2,其他条件不变)。选择细胞存活率为80%以上的样品浓度作为下一步实验浓度,结果发现GLP、GLP I、GLP II的质量浓度均为1.25 g/L时,其活力均在80%以上(数据未展示);阳性对照VC的IC80为86 mg/L(数据未展示)。
GLP及其组分对HSF细胞氧化应激模型的保护和修复:修复组为先加入H2O2刺激2 h后,每孔加入100 μL样品培养24 h;用无血清DMEM代替样品处理细胞作为修复作用中的模型组(Model组)。保护组为先加入100 μL样品培养24 h后,再以H2O2刺激2 h;用无血清DMEM来代替样品处理细胞作为保护作用中的模型组(Model组)。以无样品、无H2O2刺激、无血清DMEM处理的细胞为空白组(Control组)。处理结束参照各项指标的试剂盒说明书完成GSH-Px、MDA、SOD、CAT以及ROS水平的测定。
1.3.4 GLP对H2O2诱导的氧化应激模型Keap1-Nrf2/ARE信号通路的影响
根据NCBI中发布的基因序列,通过Primer Express软件设计引物,以管家基因β-actin作为内参基因,共5 个基因的特异性引物序列见表3。
表3 实时荧光定量聚合酶链式反应引物序列
Table 3 Primer sequences used for real-time polymerase chain reaction
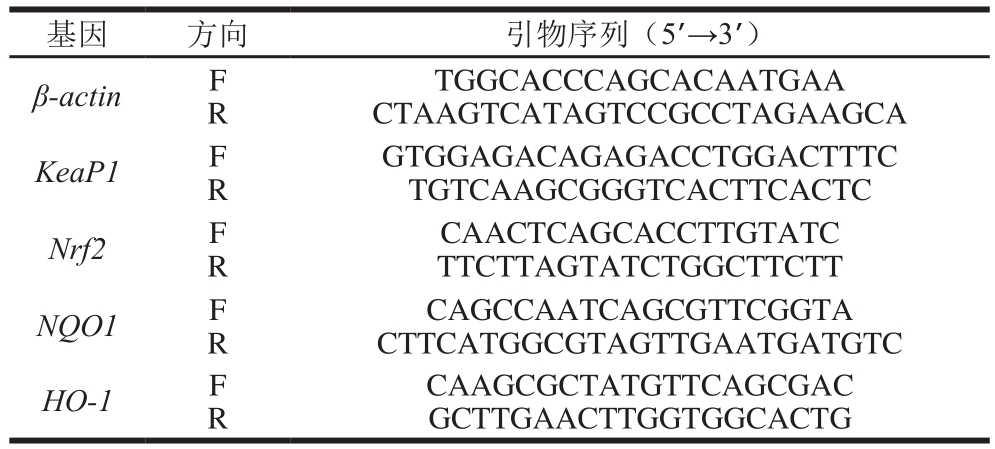
基因 方向 引物序列(5’→3’)β-actin F R TGGCACCCAGCACAATGAA CTAAGTCATAGTCCGCCTAGAAGCA KeaP1 F R CAACTCAGCACCTTGTATC TTCTTAGTATCTGGCTTCTT NQO1 F R GTGGAGACAGAGACCTGGACTTTC TGTCAAGCGGGTCACTTCACTC Nrf2 F R CAGCCAATCAGCGTTCGGTA CTTCATGGCGTAGTTGAATGATGTC HO-1 F R CAAGCGCTATGTTCAGCGAC GCTTGAACTTGGTGGCACTG
1.4 数据统计分析
实验数据利用SPSS 19.0数据处理软件进行统计学处理,组间比较采用单因素方差分析,两两比较采用t检验,以P<0.05为差异有统计学意义,所得结果以±s表示。
2 结果与分析
2.1 GLP的提取及纯化工艺
2.1.1 GLP的提取工艺优化
固定料液比为1∶50(m/V),浸提温度为70 ℃,浸提1 次,考察浸提时间对多糖提取率的影响。从图1A可知,提取时间为1 h时,GLP提取率最高;提取时间在1.5~2.5 h范围内,提取率无显著性差异(P>0.05);当提取时间延长至3 h时,GLP提取率最低。因此,从节约角度出发,选择1 h作为最优提取时间。
固定料液比为1∶50(m/V),浸提时间为2 h,浸提1 次,考察浸提温度对GLP提取率的影响,实验结果见图1B。可以看出,70 ℃时多糖提取率达到最大,且与其他条件相比差异显著(P<0.05),故确定最佳浸提温度为70 ℃。
固定浸提时间为2 h,浸提温度为70 ℃,浸提1 次,考察料液比对GLP提取率的影响,实验结果见图1C。当料液比为1∶30和1∶60(m/V)时,多糖提取率最高,两者之间无显著性差异(P>0.05),但与其他条件相比显著提高了GLP提取率(P<0.05)。考虑原料成本因素,在该条件下的最优单因素提取条件确定为料液比1∶30(m/V)。
固定料液比为1∶50(m/V),浸提时间为2 h,浸提温度为70 ℃,考察浸提次数对多糖提取率的影响,实验结果见图1D。随提取次数的增加,多糖提取率大幅下降,第二次提取率仅为(8.05±1.34)%,综合考虑,选择浸提次数为1 次。
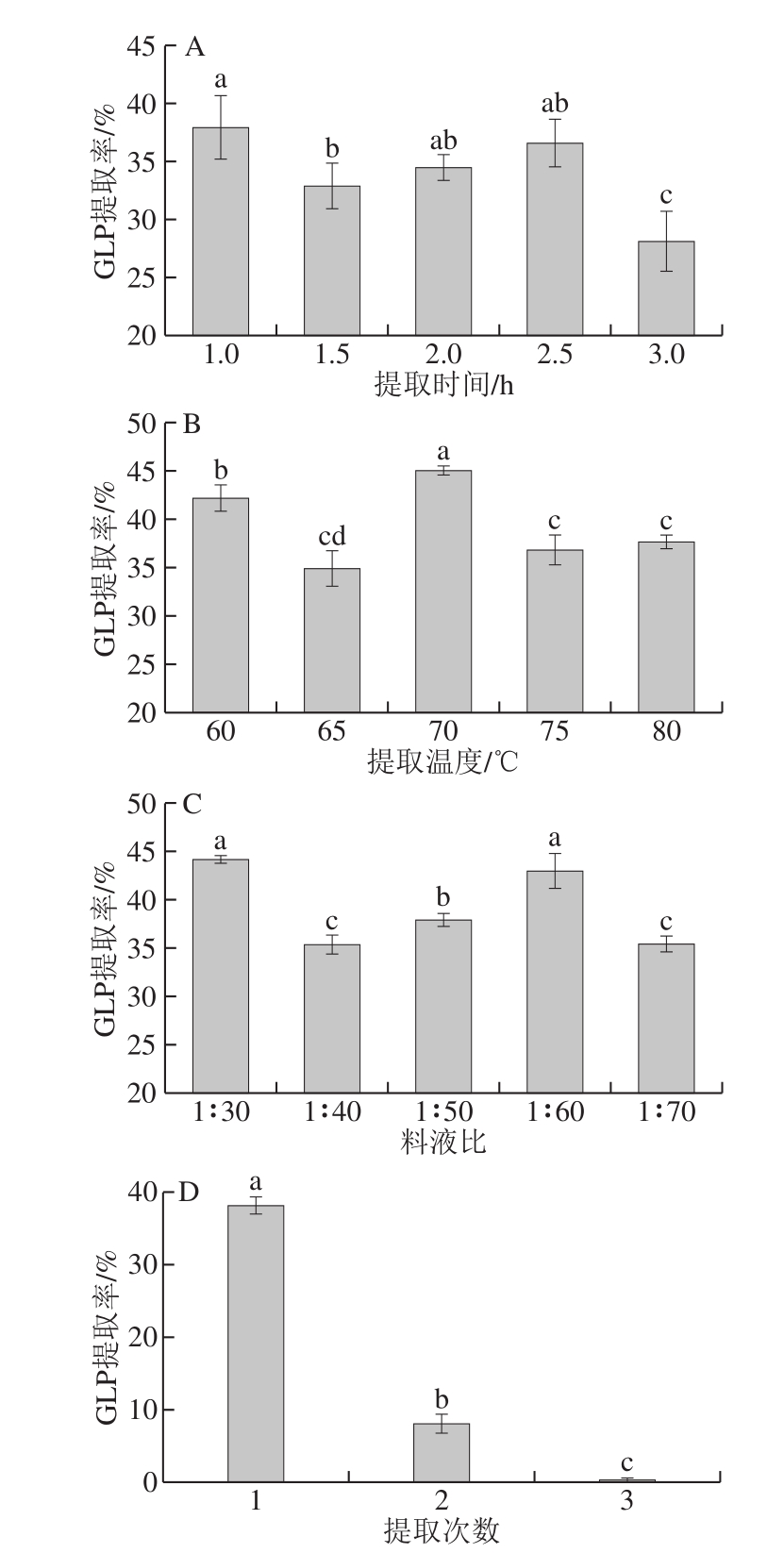
图1 不同提取条件对GLP提取率的影响(n=3)
Fig. 1 Effects of different extraction conditions on the extraction yield of GLPs (n = 3)
A.提取时间的影响;B.提取温度的影响;C.料液比的影响;D.提取次数的影响。不同字母表示差异显著(P<0.05)。
参照单因素试验结果,以浸提时间、浸提温度、料液比为考察因素,以GLP提取率为考察指标,按照表2中的因素设计并进行正交试验,结果见表4、5。
表4 正交试验结果分析
Table 4 Orthogonal array design with analysis of experimental results
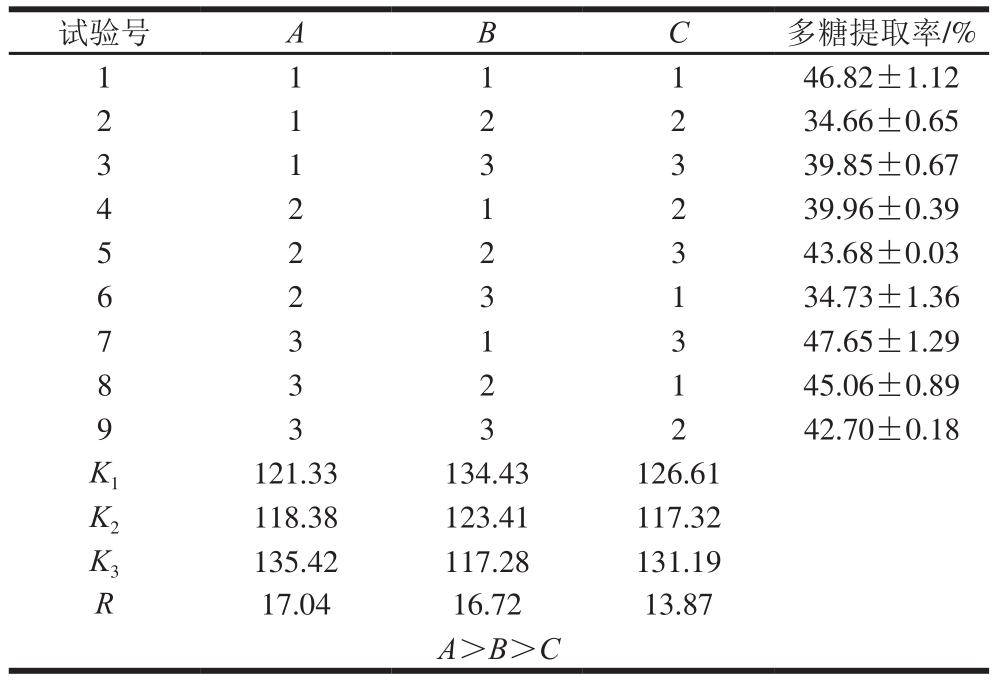
试验号 A B C 多糖提取率/%1 1 1 1 46.82±1.12 2 2 34.66±0.65 3 1 3 3 39.85±0.67 1 2 4 2 39.96±0.39 5 2 2 3 43.68±0.03 2 1 6 1 34.73±1.36 7 3 1 3 47.65±1.29 2 3 8 1 45.06±0.89 9 3 3 2 42.70±0.18 3 2 K1 121.33 134.43 126.61 K2 118.38 123.41 117.32 K3 135.42 117.28 131.19 R 17.04 16.72 13.87 A>B>C
表5 正交试验方差分析
Table 5 Analysis of variance for the effect of various extraction conditions on the extraction yield of GLPs
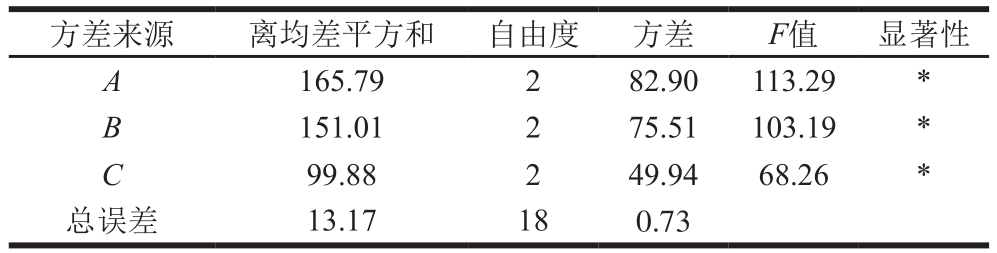
注:*.该因素有显著性差异。
方差来源 离均差平方和 自由度 方差 F值 显著性A 165.79 2 82.90 113.29 *B 151.01 2 75.51 103.19 *C 99.88 2 49.94 68.26 *总误差 13.17 18 0.73
由表4可知,这3 个因素的最佳组合为A3B1C3。由表5可知,FA=113.29、FB=103.19、FC=68.26,依照影响强度由大到小的顺序排列,得到三因素对GLP提取率的影响强弱顺序(由强到弱)为A>B>C。在最优提取工艺条件(料液比1∶35,m/V),浸提温度65 ℃,浸提时间1.5 h下进行验证,得到GLP提取率为(47.70±0.50)%,相对标准偏差为1.04%,再现性良好。利用该方法提取灵芝菌丝体多糖,其提取率远高于灵芝子实体[29]。这是由于灵芝菌丝体易于破壁,胞内多糖可快速溶出,且灵芝入土生长成为子实体期间自身代谢会消耗多糖,造成多糖总含量的降低[30]。
2.1.2 GLP的纯化工艺
通过溶剂提取法所获的粗多糖通常蛋白质含量较多。用于除去蛋白的传统方法包括三氯乙酸法、单宁酸法和Sevag法[31-32]。采用三氯乙酸法去除蛋白质的效率很高,但不可避免的是三氯乙酸容易引起多糖的糖苷键断裂,增大多糖损失率。单宁酸法在去除蛋白质过程中多糖的损失率低,可能源于单宁酸与蛋白质间可发生特异性反应,不会破坏到多糖,但其去除蛋白能力不强。Sevag法去除蛋白质的效率最高,也是当前最受欢迎的一种除蛋白的方法[32]。
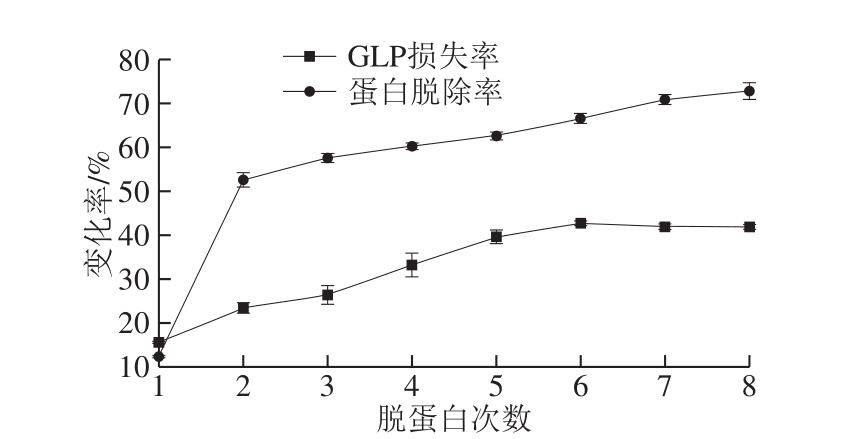
图2 Sevag法除蛋白质效果
Fig. 2 Removal efficiency of proteins by Sevag regent
本实验对GLP进行了8 次去蛋白处理,结果如图2所示。蛋白的脱除率与处理次数呈正相关,首次处理后脱除率仅为(12.31±0.24)%,第8次可达(72.87±1.90)%。当用Sevag处理6 次后,蛋白质的脱除率变化不明显。考虑到多糖成分与有机试剂长时间接触可能会影响其生物活性,因此共进行6 次处理,此时蛋白的脱除率可达(66.68±1.13)%。
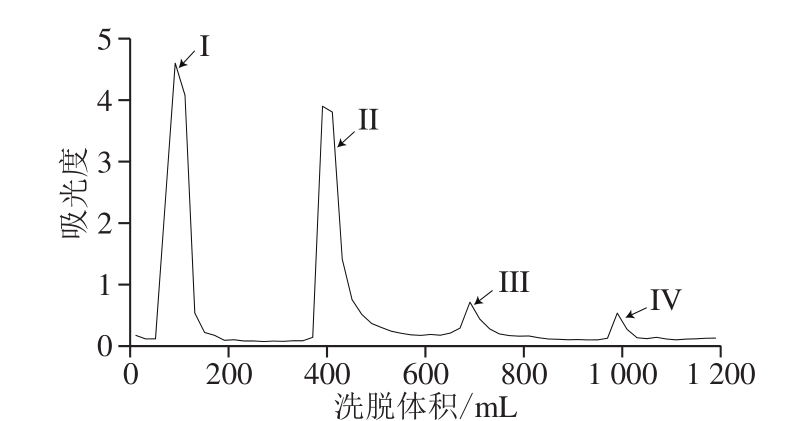
图3 GLP柱层析洗脱曲线
Fig. 3 Elution curve of GLPs by DEAE-52 column chromatography
用DEAE-52离子交换树脂对脱蛋白后的GLP进行初步分离纯化,得到洗脱曲线。由图3可知,共4 个洗脱峰(I~IV)分别出现在90、390、690、990 mL处,收集合并各组分。考虑到GLP III和GLP IV吸光度较低,故仅选用第一组分(GLP I)和第二组分(GLP II)进行后续实验。将收集的组分透析后冷冻干燥,得到GLP I、II。
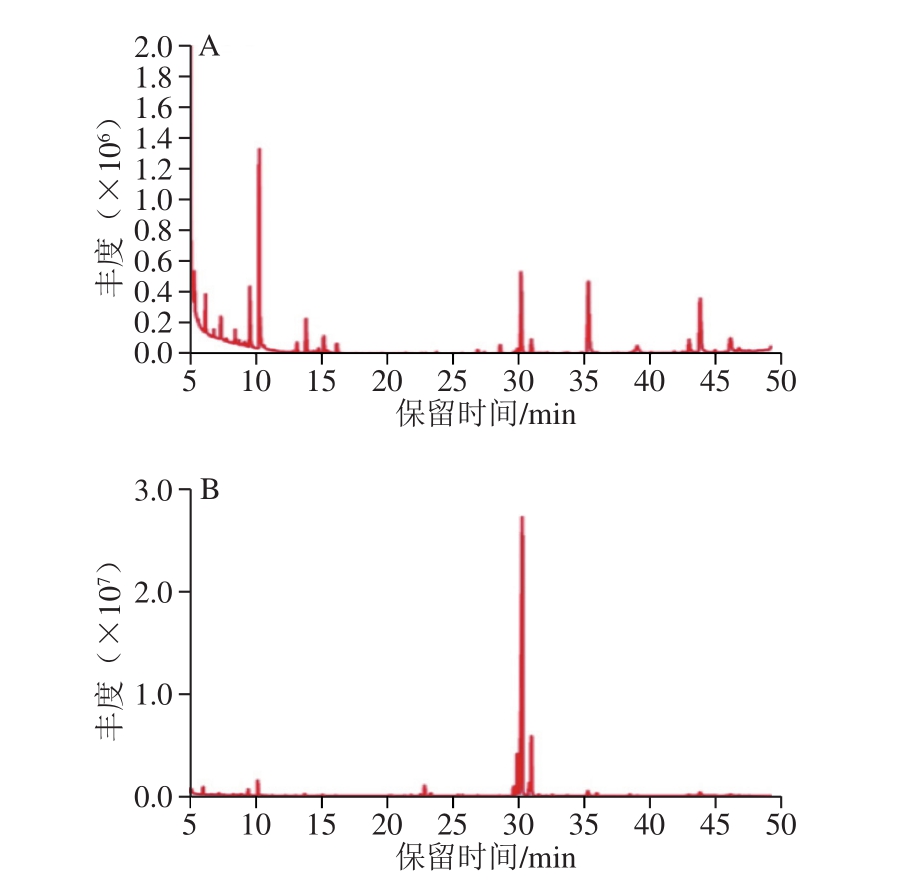
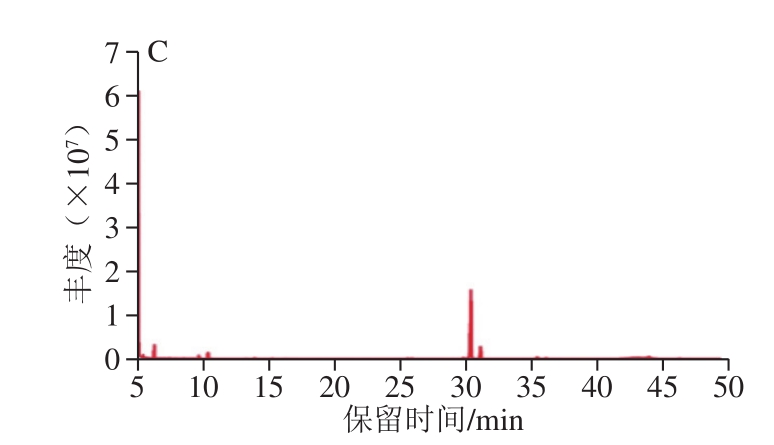
图4 GLP(A)、GLP I(B)、GLP II(C)的GC图谱
Fig. 4 GC spectrum of GLPs (A), GLP I (B), and GLP II (C)
表6 单糖相对分子质量及标准曲线
Table 6 Monosaccharide molecular masses and standard curves
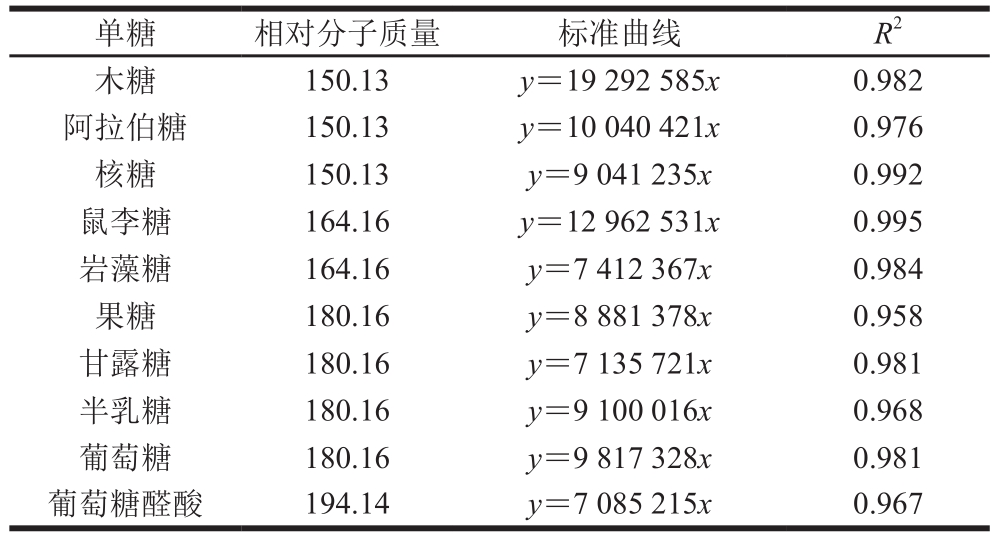
单糖 相对分子质量 标准曲线 R2木糖 150.13 y=19 292 585x 0.982阿拉伯糖 150.13 y=10 040 421x 0.976核糖 150.13 y=9 041 235x 0.992鼠李糖 164.16 y=12 962 531x 0.995岩藻糖 164.16 y=7 412 367x 0.984果糖 180.16 y=8 881 378x 0.958甘露糖 180.16 y=7 135 721x 0.981半乳糖 180.16 y=9 100 016x 0.968葡萄糖 180.16 y=9 817 328x 0.981葡萄糖醛酸 194.14 y=7 085 215x 0.967
表7 GLP样品单糖组成及物质的量比例
Table 7 Monosaccharide composition and molar ratio in GLP samples
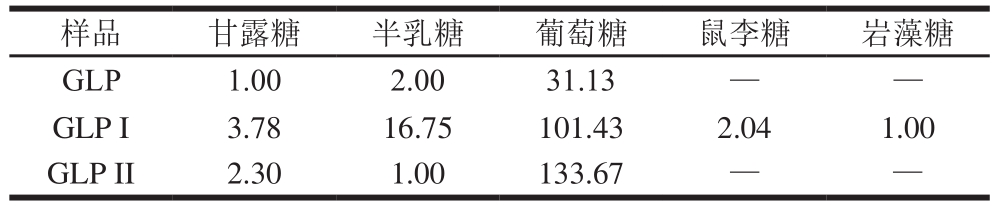
注:—.未检测到该单糖。
样品 甘露糖 半乳糖 葡萄糖 鼠李糖 岩藻糖GLP1.002.0031.13— —GLP I 3.78 16.75 101.43 2.04 1.00 GLP II2.301.00133.67— —
对GLP及其组分GLP I、GLP II进行衍生反应,利用GC-MS测定单糖组成。图4为GLP(A)、GLP I(B)、GLP II(C)的GC图谱。经过与标准品相对分子质量及标准曲线(表6)对比,GLP及其组分的单糖组成及物质的量比例如表7所示。其中GLP I较GLP、GLP II多出鼠李糖和岩藻糖两种单糖,考虑为纯化后的富集作用所引起的。
2.2 GLP对H2O2诱导的氧化应激模型的保护和修复作用
2.2.1 GLP对氧化损伤细胞脂质过氧化产物积累情况的影响
MDA是脂质过氧化的最典型的终产物。MDA含量增加是过氧化作用加剧、细胞脂膜受到损伤的重要表现,其含量越高表明脂质过氧化作用越强[33-34]。图5A、B分别为保护和修复作用下GLP、GLP I、GLP II与VC对HSF细胞内MDA含量影响的结果。结果表明,100 μmol/L H2O2处理细胞2 h处理后Model组能够极显著提高细胞内MDA含量(P<0.01)。与Model组相比,GLP、GLP I、GLP II、VC均能极显著减少HSF细胞内MDA的积累(P<0.01)。在本实验所考察作用浓度下,各保护作用处理方式中,样品减少MDA积累的能力由高到低依次为GLP II>VC>GLP>GLP I,修复作用中,样品降低MDA积累的能力由高到低依次为VC>GLP II>GLP>GLP I,两种作用中VC与GLP II均不具有显著性差异(P>0.05)。
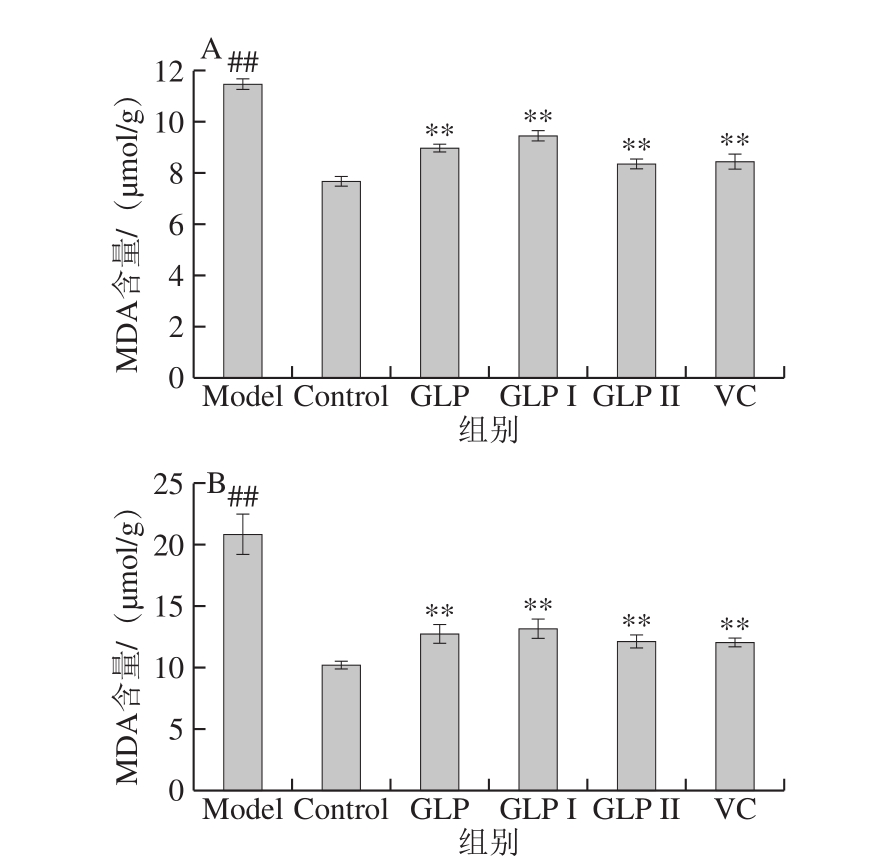
图5 GLP对HSF细胞内MDA含量的影响
Fig. 5 Effect of GLPs on MDA content in HSF cells
A. GLP在保护作用下对MDA积累情况的影响;B. GLP在修复作用下对MDA积累情况的影响。与Control组相比,##.差异极显著(P<0.01);与Model组相比,**.差异极显著(P<0.01),下同。
2.2.2 GLP对HSF细胞内ROS水平的影响
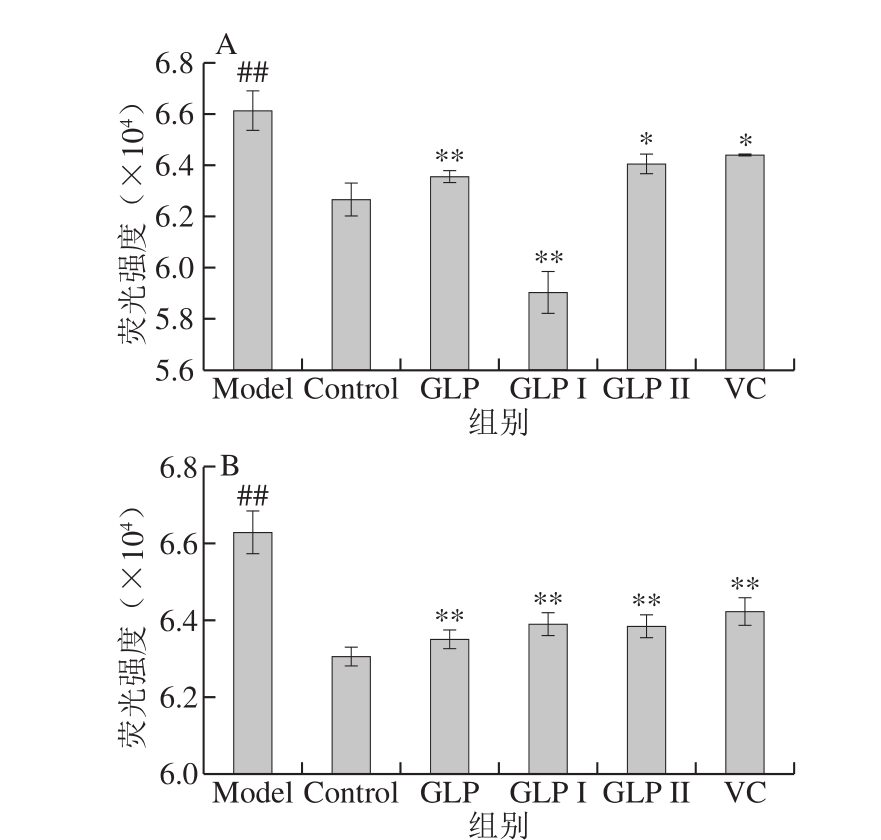
图6 GLP对HSF细胞内ROS和MDA积累情况的影响
Fig. 6 Effect of GLPs on the levels of MDA and ROS in HSF cells
A. GLP在保护作用下对ROS水平的影响;B. GLP在修复作用下对ROS水平的影响。与Model组相比,*.差异显著(P<0.05),下同。
保护与修复两种处理方式下GLP及其组分(GLP I和GLP II)与VC对细胞活性氧水平的影响结果如图6A、B所示。与Control组相比,H2O2处理后极显著提高了细胞内ROS水平(P<0.01)。总体上看,两种作用方式下,GLP、GLP I和GLP II均能极显著降低HSF细胞内ROS的含量(P<0.01),与阳性对照VC相比,GLP I在保护作用方面具有更为优异的表现。
2.2.3 GLP对氧化损伤细胞抗氧化酶水平的影响
SOD是机体内重要的O2-·清除剂,它可以把有害的O2-·转化为H2O2,CAT可将H2O2分解为分子氧和水,与SOD具有协同作用,能够清除体内过剩自由基清除。而GSH-Px是机体内广泛存在的一种重要的过氧化物分解酶,三者共同构成了体内的主要抗氧化酶体系,维持机体内部自由基的相对稳定,起到抗氧化的作用。
图7A1、A2分别为保护和修复两种方式下,GLP、GLP I、GLP II与VC对HSF细胞内CAT活性影响的结果。与Model组相比,两种作用方式处理下,GLP、GLP I、GLP II、VC均能极显著提高HSF细胞内CAT的活力(P<0.01);在本实验所考察作用浓度下,在保护作用处理方式中,各样品提高CAT的能力由高到低依次为:GLP I>VC>GLP>GLP II,修复作用处理方式中为:GLP I>GLP II>VC>GLP。
图7B1、B2分别为保护和修复两种方式下,GLP、GLP I、GLP II与VC对HSF细胞内GSH-Px活力影响的结果。结果表明,两种作用方式处理下,GLP、GLP I、GLP II与VC均能显著提高HSF细胞内的GSH-Px活力。在保护作用处理方式下,1.25 g/L GLP I处理HSF细胞24 h再进行H2O2损伤处理,其最终的GSH-Px活力达到(12.19±0.61)U/g,比Model组提高了36.84%;在修复作用处理方式下,GLP I组GSH-Px活力为Model组的7.56 倍,且3 种灵芝多糖处理后的GSH-Px水平均高于阳性对照VC。
图7C1、C2分别为保护和修复两种方式下,GLP、GLP I、GLP II与VC对HSF细胞内SOD活力影响的结果。与Control组相比,Model组细胞内SOD活力显著降低(P<0.05)。与Model组相比,GLP、GLP I、GLP II和VC均能极显著提高HSF细胞内SOD活力(P<0.01);并且GLP及其两组分的促进能力均高于阳性对照VC;GLP I的保护和修复能力最高,保护处理方式下,GLP I组SOD活力为Model组的2.39 倍;修复处理方式下,GLP I组的SOD水平为Model的2.92 倍,具有较好的提高SOD活力的能力。
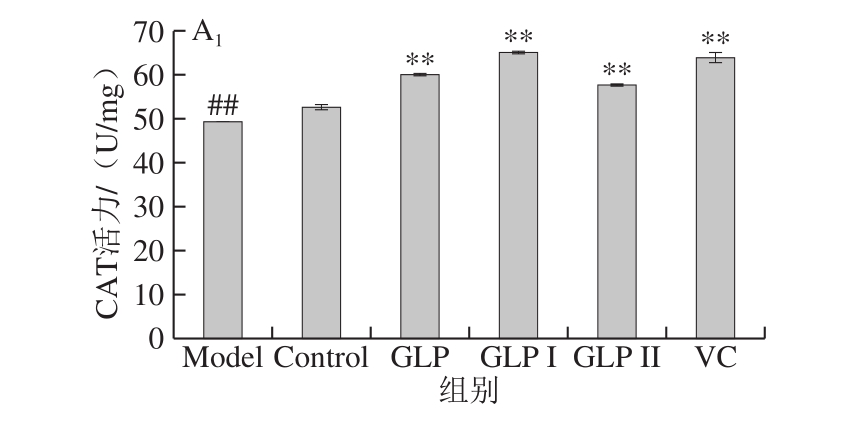
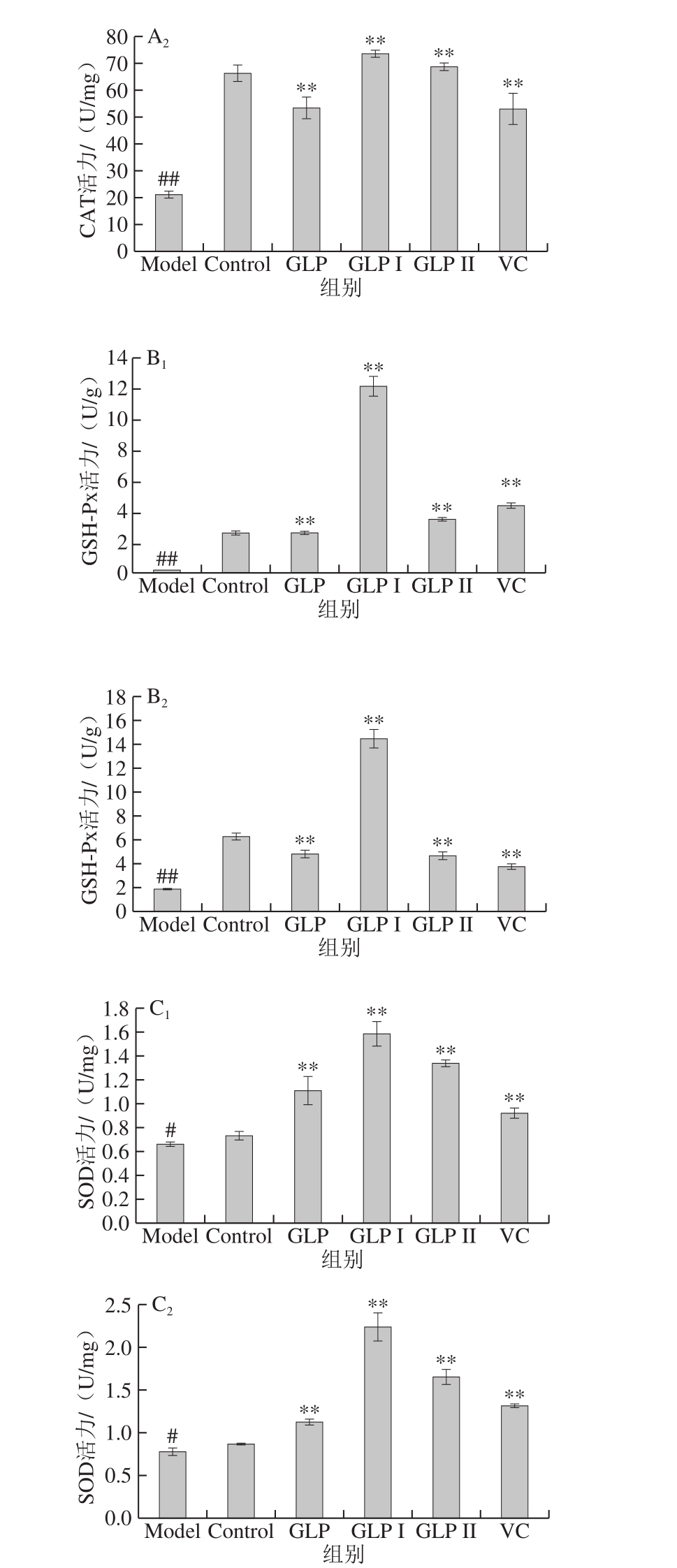
图7 GLP对HSF细胞内SOD活力的影响
Fig. 7 Effects of GLP on SOD activity in HSF cells
A1、B1、C1.样品对HSF的保护作用中酶活力(依次为CAT、GSH-Px、SOD)的影响;A2、B2、C2为样品对HSF的修复作用中酶活力(依次为CAT、GSH-Px、SOD)的影响。与Control组相比,#.差异显著(P<0.05),下同。
2.3 GLP对H2O2诱导的氧化应激模型Keap1-Nrf2/ARE信号通路的影响
Nrf2是细胞抗氧化应激体系中的关键信号因子,在细胞质中受到抑制性结合蛋白Keap1控制。Nrf2与Keap1的解离是Nrf2-ARE途径发挥活性的关键步骤。当细胞受到ROS刺激后,Nrf2与Keap1发生解离,活化的Nrf2进入细胞核,在Maf蛋白作用下与抗氧化原件ARE结合,激活靶基因表达,调控下游基因转录活性,从而发挥抗氧化损伤作用[35-37]。血红素氧合酶1(heme oxygenase-1,HO-1)和醌氧化还原酶-1(NAD(P)H: quinone oxidoreductase 1,NQO1)是该信号通路的下游效应基因编码的蛋白,HO-1在清除ROS,抵御过氧化物、过氧亚硝酸盐、羟基和超氧化物自由基方面发挥着重要作用[38]。NQO1可以催化醌还原成氢醌,以促进醌的排泄,阻断醌参与ROS的产生,减少对DNA的氧化损伤程度。
由前期实验可知,GLP、GLP I、GLP II的质量浓度均为1.25 g/L时,其活力均在80%以上,因此设定低(0.5 g/L)、中(1.5 g/L)和高(2.5 g/L)3 个剂量来探究GLP对Keap1-Nrf2/ARE信号通路各因子表达水平的影响。
图8为保护作用处理方式下,不同样品对Keap1-Nrf2/ARE信号通路关键信号分子的表达情况影响。由图8A可知,各灵芝多糖(GLP、GLP I和GLP II)处理后,Nrf2 mRNA表达量均极显著高于Model组(P<0.01),并且显著高于阳性对照VC组。由图8B可知,与Model组相比,负调控因子Keap1的相对表达量变化趋势并不一致,在GLP低剂量组、GLP中剂量组、GLP I中剂量组、GLP II组高剂量组、GLP II组低剂量组中,Keap1表达受到极显著抑制(P<0.01),而在其他组中显著高于Model组;阳性对照VC组的Keap1 mRNA相对表达量与Model组相比差异不显著(P>0.05)。可能是存在其他基因和信号通路在发挥抗氧化作用。
在保护作用研究中,除GLP I中剂量组极显著降低了下游抗氧化因子HO-1的表达量,其他样品均能极显著提高HO-1的表达量(P<0.01)(图8C)。GLP中剂量组、高剂量组的NQO1表达提高,且与Model组相比差异极显著(P<0.01),GLP I、GLP II组在中剂量组显著表达(P<0.05,P<0.01)(图8D)。
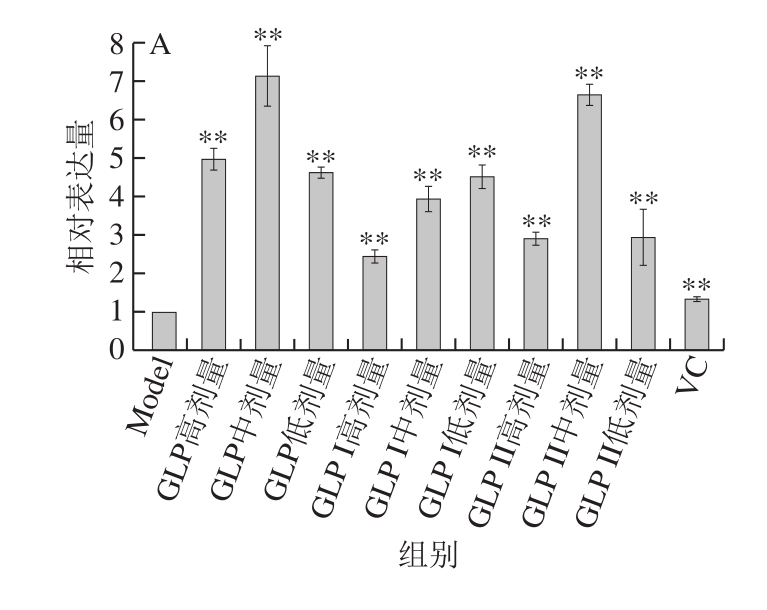
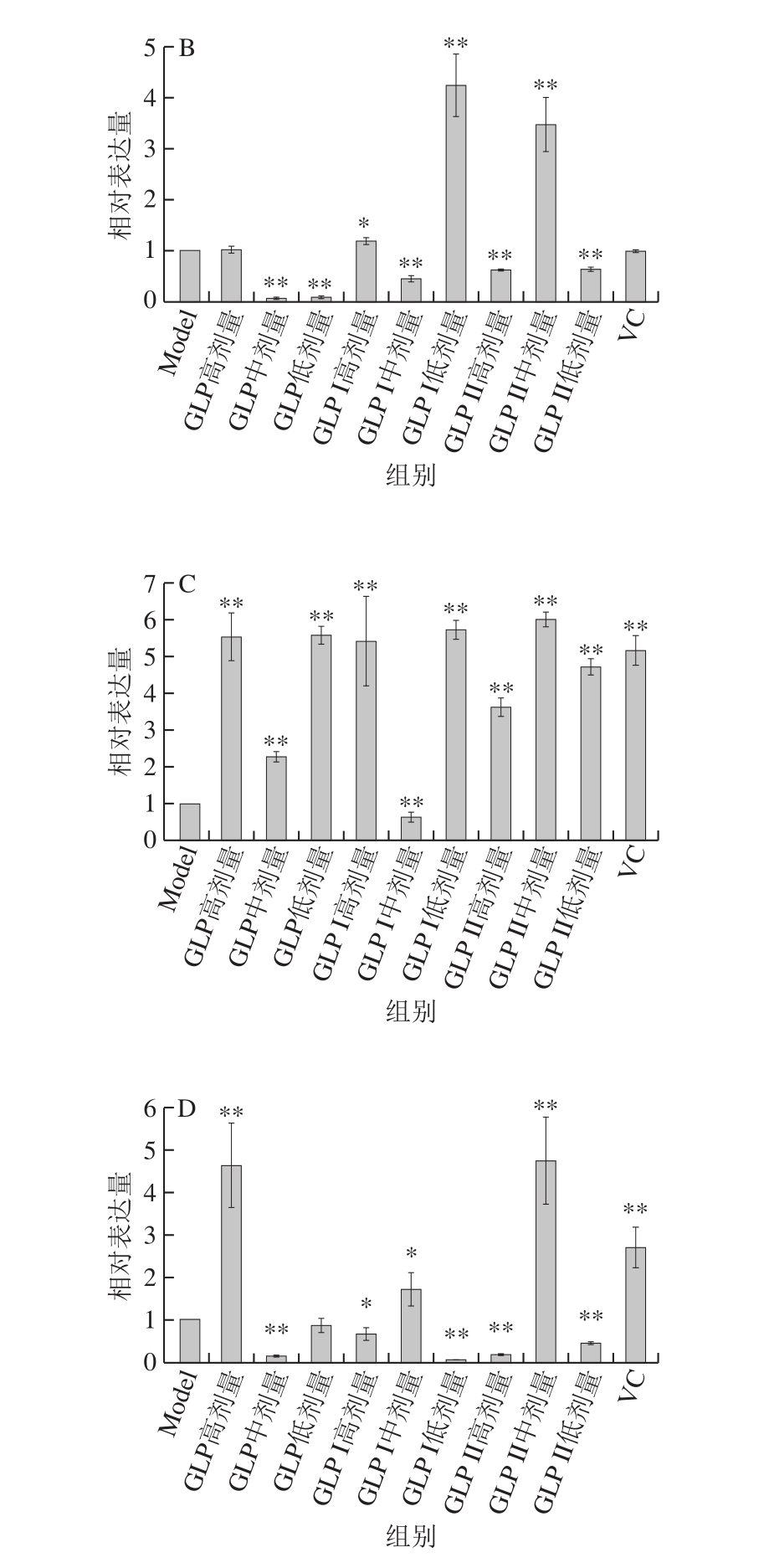
图8 保护作用下GLP对Keap1-Nrf2/ARE信号通路关键基因相对表达量的影响
Fig. 8 Relative gene expression of key genes in the Keap1-Nrf2/ARE signaling pathway in cells protected from oxidative stress damage by GLPs
A. Nrf2基因;B. Keap1基因;C. HO-1基因;D. NQO1基因。图9同。
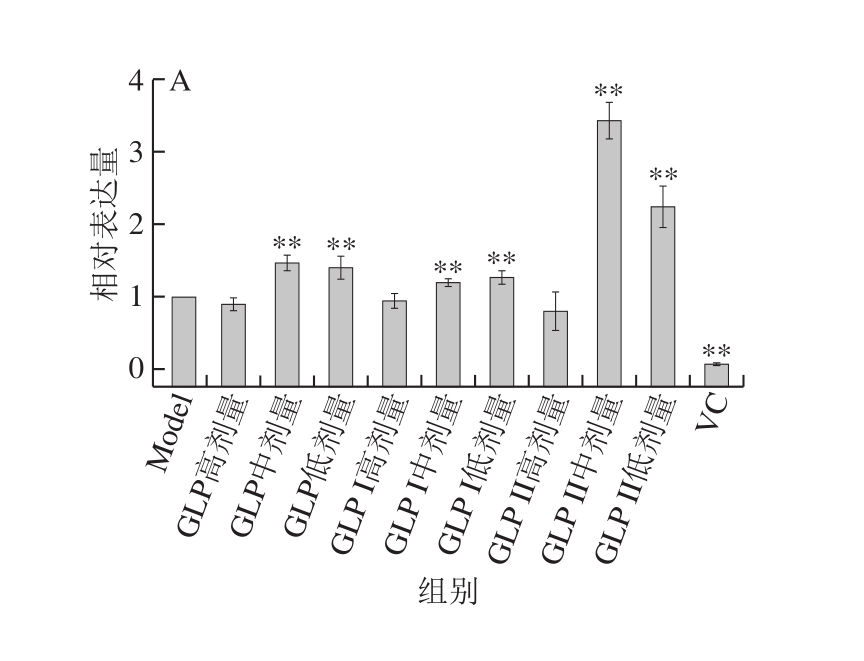
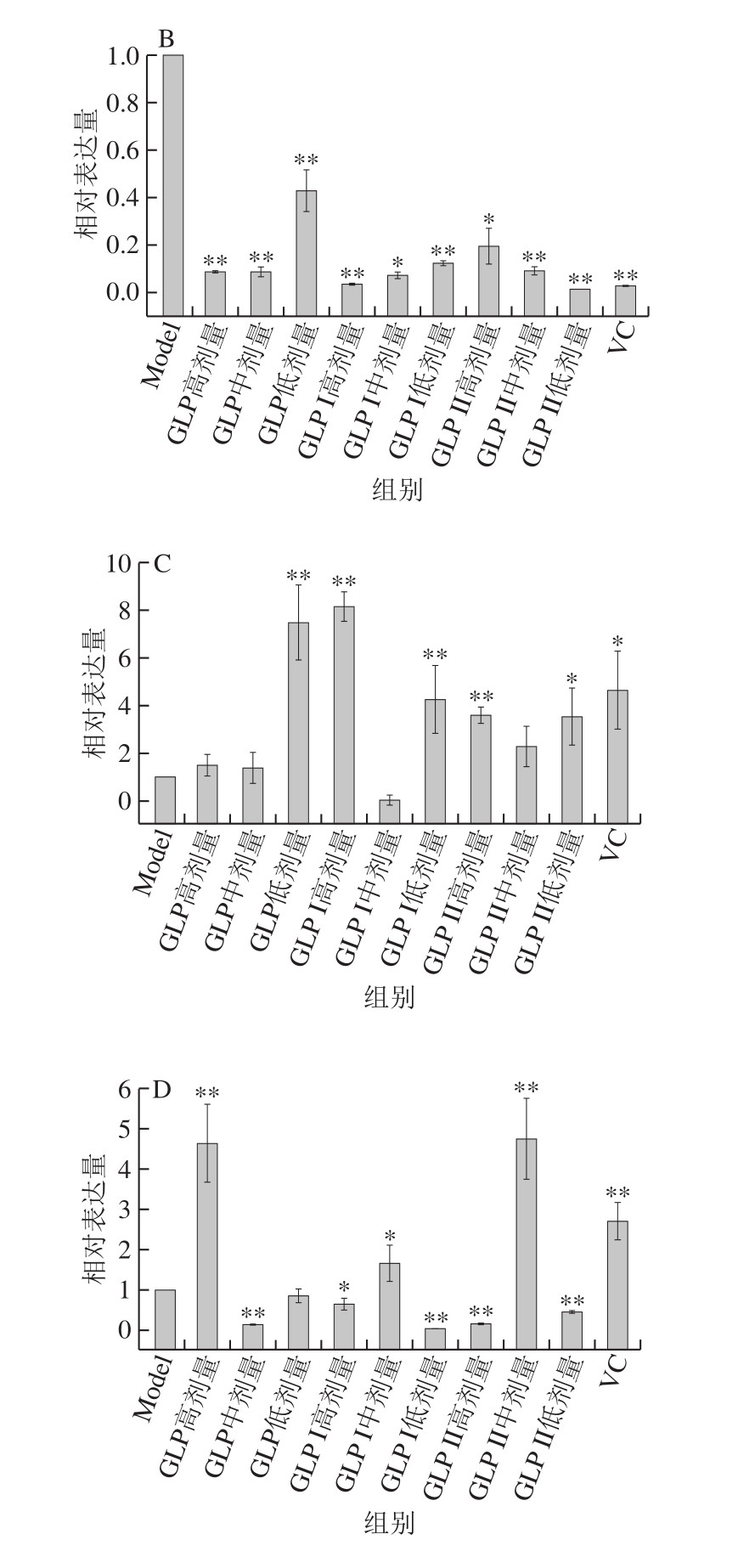
图9 修复作用下GLP对Keap1-Nrf2/ARE信号通路关键基因相对表达量的影响
Fig. 9 Relative gene expression of key genes in the Keap1-Nrf2/ARE signaling pathway in cells repaired by GLPs against oxidative stress damage
图9 为修复作用处理方式下,不同样品对Keap1-Nrf2/ARE信号通路关键信号分子的表达情况影响。由图9A可知,在修复作用中,各灵芝多糖组除高剂量组外,Nrf2的表达量均极显著提高(P<0.01);阳性对照VC修复后,并没有提高Nrf2的相对表达量,可能原因是细胞受损严重,VC的修复作用没有激活Nrf2的表达。由图9B可知,负调控因子Keap1在各灵芝多糖处理组中均极显著低于Model组(P<0.01)。由图9C可知,GLP I、GLP II组中HO-1的表达量随质量浓度的增加先降低后升高,而HO-1仅在GLP低剂量组中极显著表达(P<0.01)。由图9D可知,GLP高剂量组,GLP I、GLP II中剂量组的NQO1极显著表达(P<0.01)。
3 讨 论
20世纪90年代,有研究者提出了“氧化应激”的概念。当机体处于不利环境时,ROS大量产生,超过人体自身的清除速度,氧化系统和抗氧化系统不平衡,大量的ROS进入细胞参与生化反应,诱发氧化应激。通过破坏DNA,生物体失去了细胞基本生理活动所涉及的基因,导致细胞衰老和组织损伤[4-5]。机体内众多信号通路在氧化应激过程中起着调节作用。其中,Keap1-Nrf2/ARE信号通路被认为是机体最重要的内源性抗氧化信号通路。Nrf2-ARE途径表达的蛋白质分子,为机体提供了重要的防御作用,是对抗环境有害物质损伤和内源性应激的有力武器[19-23]。
许多天然活性成分通过参与调节Keap1-Nrf2/ARE信号通路从而达到防护氧化应激损伤的作用效果。白藜芦醇是一种Nrf2的激活剂,可以通过激活Nrf2-HO-1-NOQ-1和SIRT1-AMPK-PGC-1alpha通路发挥抗炎、对抗氧化应激的作用[39]。Patwardhan等发现秋葵黄酮通过Nrf2-ARE-HO-1防护UVB诱导的人皮肤成纤维细胞的DNA损伤[40]。多糖类成分也被报道具有激活Nrf2因子的作用。从大型褐藻羊栖菜中提取得到的多糖可以通过JNK1-β2-NRF2的相互作用激活Nrf2/ARE信号通路,并启动Nrf2下游相关抗氧化和解毒酶基因的表达,进而提高机体整体的抗氧化能力,最终延缓小鼠的衰老进程[41]。此外,有文献也报道了在防护氧化应激损伤方面具有显著效果的其他植物多糖,如杏鲍菇多糖[42]、胶秋藻多糖[43]、枸杞多糖[44]、银耳多糖[44]等。灵芝作为一种名贵中草药,在中国已有了2 000多年的应用历史。灵芝多糖作为灵芝的一种重要活性成分,在抗氧化、抗衰老方面的研究已深入开展。邱玉芳等[46]报道了灵芝多糖可以上调血清中SOD水平。此外,周婕[47]和陈玉胜[48]等研究发现灵芝多糖除了可以清除羟自由基、1,1-二苯基-2-三硝基苯肼自由基、超氧阴离子自由基以及过氧化氢外,还可以通过减轻脂质过氧化从而保护因辐照所造成的肝损伤。在本研究中,来源于菌种wG055的灵芝多糖GLP及其组分GLP I和GLP II同样具有显著的防护氧化应激损伤的功效。在保护和修复两种处理方式上,GLP及其组分显著降低了HSF损伤细胞MDA的积累和ROS水平,与文献[47]报道相符;并且,GLP可以显著提高细胞抗氧化酶的水平,对Keap1-Nrf2/ARE关键信号因子具有显著的调节作用,进一步解释了其发挥防护氧化应激方面的作用机制。
本实验为GLP在食品、药品领域的应用提供了一定的理论参考。但是,在机制研究方面可能还不全面,尽管Keap1-Nrf2/ARE信号通路是一条重要的内源性抗氧化信号通路,但是机体的内在平衡是多因子、多信号通路复杂调控的结果。后期可以借助组学技术对GLP的深层机制进行更系统、更全面的分析,阐明GLP发挥作用的深层机制。
[1] GETOFF N. Anti-aging and aging factors in life. the role of free radicals[J]. Radiation Physics and Chemistry, 2007, 76(10): 1577-1586. DOI:10.1016/j.radphyschem.2007.01.002.
[2] LEPHART E D. Skin aging and oxidative stress: equol’s antiaging effects via biochemical and molecular mechanisms[J]. Ageing Research Reviews, 2016, 31: 36-54. DOI:10.1016/j.arr.2016.08.001.
[3] LARA J, SHERRATT M J, REES M. Aging and anti-aging[J].Maturitas, 2016, 93: 1-3. DOI:10.1016/j.maturitas.2016.08.020.
[4] RECZEK C R, CHANDEL N S. ROS-dependent signal transduction[J]. Current Opinion in Cell Biology, 2015, 33: 8-13.DOI:10.1016/j.ceb.2014.09.010.
[5] POPRAC P, JOMOVA K, SIMUNKOVA M, et al. Targeting free radicals in oxidative stress-related human diseases[J]. Trends in Pharmacological Sciences, 2017, 38(7): 592-607. DOI:10.1016/j.tips.2017.04.005.
[6] 李晔, 肖志勇, 毛景华, 等. 灵芝孢子油对化学性肝损伤保护作用的研究[J]. 广西中医药, 2006(3): 50-51. DOI:10.3969/j.issn.1003-0719.2006.03.032.
[7] 王倩, 张佳婵, 王昌涛, 等. 灵芝美容护肤作用机制及其在化妆品行业中的发展现状[J]. 日用化学工业, 2019, 49(2): 118-125.DOI:10.3969/j.issn.1001-1803.2019.02.011.
[8] 张志军, 李淑芳, 魏雪生, 等. 灵芝多糖体外抗氧化活性的研究[J]. 化学与生物工程, 2011, 28(3): 63-65. DOI:10.3969/j.issn.1672-5425.2011.03.018.
[9] 林晓, 潘文嘉. 灵芝多糖抗皮肤衰老作用研究[J]. 辽宁中医药大学学报, 2009, 11(9): 174-175. DOI:10.13194/j.jlunivtcm.2009.09.176.linx.096.
[10] XIE B, HE H, SUN J. Novel antioxidant peptides from fermented mushroom Ganoderma lucidum[J]. Journal of Agricultural and Food Chemistry, 2004, 52(21): 6646-6652. DOI:10.1021/jf0495136.
[11] 李响. 灵芝多糖延缓皮肤衰老的实验研究[D]. 湛江: 广东医学院,2009: 37-42. DOI:10.7666/d.y2013290.
[12] 谢韶琼, 廖万清. 灵芝多糖抗角质形成细胞衰老相关基因表达的研究[C]// 2006中国中西医结合皮肤性病学术会议论文汇编. 北京:中国中西医结合学会, 2006: 86-93.
[13] 陈敬华, 张俐娜, 余登寿, 等. 灵芝菌丝体多糖的化学组成和溶液性质[J]. 高等学校化学学报, 2000(6): 961-964. DOI:10.3321/j.issn:0251-0790.2000.06.022.
[14] 王海燕, 戴军, 陈尚卫. 灵芝菌丝体多糖的分离纯化及其单糖组成分析与分子量测定[J]. 食品与机械, 2015, 31(5): 201-205.DOI:10.13652/j.issn.1003-5788.2015.05.052.
[15] 于华峥, 刘艳芳, 周帅, 等. 灵芝子实体、菌丝体及孢子粉中多糖成分差异比较研究[J]. 菌物学报, 2016, 35(2): 170-177. DOI:10.13346/j.mycosystema.140242.
[16] 高小荣, 刘培勋. 多糖构效关系研究进展[J]. 中草药, 2004, 35(2):229-231. DOI:10.3321/j.issn:0253-2670.2004.02.044.
[17] ADACHI Y, OHNO N, OHSAWA M, et al. Physicochemical properties and anti-tumor activities of chemically modified derivaties of antitumor glucan “grifolan LE” from Grifola frondosa[J]. Chemical Pharmacal Bullution, 1989, 37: 1838-1841. DOI:10.1248/cpb.37.1838.
[18] VAISERMAN A M, LUSHCHAK O V, KOLIADA A K. Anti-aging pharmacology: Promises and pitfalls[J]. Ageing Research Reviews,2016, 31: 9-35. DOI:10.1016/j.arr.2016.08.004.
[19] PANDEY P, SINGH A K, SINGH M, et al. The see-saw of Keap1-Nrf2 pathway in cancer[J]. Critical Reviews in Oncology/Hematology,2017, 116: 89-98. DOI:10.1016/j.critrevonc.2017.02.006.
[20] DAVID J A, RIFKIN W J, RABBANI P S, et al.The Nrf2/Keap1/ARE pathway and oxidative stress as a therapeutic target in type II diabetes mellitus[J]. Journal of Diabetes Research, 2017, 2017(11): 1-15.DOI:10.1155/2017/4826724.
[21] TAGUCHI K, MOTOHASHI H, YAMAMOTO M. Molecular mechanisms of the Keap1-Nrf2 pathway, in stress response and cancer evolution[J]. Genes to Cells, 2011, 16(2): 123-140. DOI:10.1111/j.1365-2443.2010.01473.x.
[22] CHARTOUMPEKIS D V, WAKABAYASHI N, KENSLER T W.Keap1/Nrf2 pathway in the frontiers of cancer and non-cancer cell metabolism[J]. Biochemical Society Transactions, 2015, 43(4): 639-644. DOI:10.1042/BST20150049.
[23] LU M, JI J, JIANG Z, et al. The Keap1-Nrf2-ARE pathway as a potential preventive and therapeutic target: an update[J]. Medicinal Research Reviews, 2016, 36(5): 924-963. DOI:10.1002/med.21396.
[24] 韩勇. 微生物胞外多糖提取纯化研究进展[J]. 黑龙江农业科学,2019(5): 159-161. DOI:10.11942/j.issn1002-2767.2019.09.05.0159.
[25] 王倩, 张佳婵, 王昌涛, 等. 碳氮比对真菌发酵桑枝-燕麦麸皮的活性成分和抗氧化能力的影响[J]. 食品工业科技, 2019, 40(2): 93-99;106. DOI:10.13386/j.issn1002-0306.2019.02.017.
[26] 刘良琴. 灵芝多糖的提取纯化、结构表征及灵芝茶的质量控制研究[D]. 贵阳: 贵州师范大学, 2017: 33-47.
[27] 董洲, 李惠娴, 张猛猛, 等. 野葛根酸性多糖的结构鉴定及免疫活性[J]. 现代食品科技, 2018, 34(7): 68-75. DOI:10.13982/J.MFST.1673-9078.2018.7.011.
[28] ZHANG J C, WANG C T, WANG C T, et al. Understanding the role of extracts from sea buckthorn seed residues in anti-melanogenesis properties on B16F10 melanoma cells[J]. Food & Function, 2018, 9:5401-5416. DOI:10.1039/C8FO01427B.
[29] 于华峥, 刘艳芳, 周帅, 等. 灵芝子实体、菌丝体及孢子粉中多糖成分差异比较研究[J]. 菌物学报, 2016, 35(2): 170-177. DOI:10.13346/j.mycosystema.140242.
[30] 黄生权. 赤灵芝多糖的提取分离、结构分析与生物活性研究[D]. 广州: 华南理工大学, 2010: 35-37.
[31] 韩勇. 微生物胞外多糖提取纯化研究进展[J]. 黑龙江农业科学,2019(5): 159-161. DOI:10.11942/j.issn1002-2767.2019.05.0159.
[32] 刘子健, 岳玲. Sevage法纯化紫菜粗多糖的工艺研究[J]. 吉林农业,2018(11): 60-61. DOI:10.14025/j.cnki.jlny.2018.11.019.
[33] 孙守家, 赵兰勇, 仇兰芬, 等. 平阴玫瑰鲜花花蕾采后衰老生理机制研究[J]. 林业科学, 2004, 40(5): 79-83. DOI:10.11707/j.1001-7488.20040512.
[34] 姜秀梅, 徐小磊, 殷一民, 等. 金针菇多糖对衰老小鼠脾脏抗氧化能力的影响[J]. 北华大学学报(自然科学版), 2016, 17(4): 488-491.DOI:10.11713/j.issn.1009-4822.2016.04.013.
[35] 陈宗泽, 廉姜芳. 沉默信息调节因子2相关酶类1/核因子E2相关因子2信号通路在高血压病中的抗氧化应激作用[J]. 中国循环杂志,2018, 33(10): 1035-1037. DOI:10.3969/j.issn.1000-3614.2018.10.022.
[36] KOBAYASHI M, YAMAMOTO M. Molecular mechanisms activating the Nrf2-Keap1 pathway of antioxidant gene regulation[J]. Antioxidants &Redox Signaling, 2005, 7(3/4): 385-394. DOI:10.1089/ars.2005.7.385.
[37] BAIRD L, DINKOVA-KOSTOVA A. The cytoprotective role of the Keap1-Nrf2 pathway[J]. Archives of Toxicology, 2011, 85(4):241-272. DOI:10.1007/s00204-011-0674-5.
[38] 李慧, 杨林. Nrf2抗氧化的分子调控机制[J]. 生物信息学, 2018,16(1): 1-6. DOI:10.3969/j.issn.1672-5565.201708001.
[39] KIM E N, LIM J H, KIM M Y, et al. Resveratrol, an Nrf2 activator,ameliorates aging-related progressive renal injury[J]. Aging, 2018,10(1): 83-99. DOI:10.18632/agibg.101361.
[40] PATWARDHAN J, BHATT P. Flavonoids derived from abelmoschus esculentus attenuates UV-B induced cell damage in human dermal fibroblasts through Nrf2-ARE pathway[J]. Pharmacogn Magazine,2016, 12(46): S129-S138. DOI:10.4103/0973-1296.182175.
[41] 赵子慧. 羊栖菜多糖SFPS激活JNK/NRF2/ARE信号通路并发挥抗氧化和抗衰老作用[D]. 温州: 温州大学, 2018: 35-38.
[42] 张晨. 杏鲍菇菌丝体多糖的分离纯化及抗衰老、抗糖尿病活性分析[D]. 泰安: 山东农业大学, 2018: 41-62.
[43] 魏丹. 胶球藻多糖对不同饮食条件下自然衰老小鼠模型的抗衰老作用及其机制[D]. 北京: 中国医科大学, 2018: 19-23.
[44] TANG R, CHEN X, DANG T, et al. Lycium barbarum polysaccharides extend the mean lifespan of Drosophila melanogaster[J]. Food &Function, 2019, 10(7): 4231-4241. DOI:10.1039/c8fo01751d.
[45] YANG D, LIU Y, ZHANG L. Tremella polysaccharide: the molecular mechanisms of its drug action[J]. Glycans and Glycosaminoglycans as Clinical Biomarkers and Therapeutics-Part B, 2019, 163: 383-421.DOI:10.1016/bs.pmbts.2019.03.002.
[46] 邱玉芳, 邢东升, 邓文, 等. 灵芝多糖口服液对小鼠免疫功能影响的研究[J]. 泰山医学院学报, 2004(6): 586-588. DOI:10.3969/j.issn.1004-7115.2004.06.008.
[47] 周婕, 周宏星, 陈玉胜. 灵芝多糖对D-氨基半乳糖所致小鼠急性肝损伤的保护作用[J]. 中药药理与临床, 2014, 30(5): 84-86.
[48] 陈玉胜, 陈全战. 灵芝多糖对CCl4诱导的急性肝损伤小鼠的抗炎和保肝活性[J]. 食品科学, 2017, 38(17): 210-215. DOI:10.7506/spkx1002-6630-201717034.