马铃薯(Solanum tuberosum L.)为一年生草本块茎植物,不仅是重要的蔬菜作物,也是仅次于小麦、水稻和玉米的全球第四大粮食作物,富含膳食纤维、微量元素、氨基酸、蛋白质、维生素和优质淀粉等营养物质,具有减肥、维持机体平衡、防癌和抗氧化等功效[1]。近年来,随着快餐和方便食品业的兴起,马铃薯的消耗量逐年增大,由此带动了鲜切马铃薯产业的快速发展[2]。鲜切马铃薯在实现马铃薯主粮化战略、改善和丰富居民膳食营养结构中扮演了越来越重要的角色[3]。目前有关维持鲜切马铃薯品质的方法较多,包括抗氧化化合物(亚硫酸盐、L-半胱氨酸、抗坏血酸)处理、气调包装、植物提取物的使用[4-5]等,但这些方法存在成本高、效率低、潜在健康危害及安全隐患等问题。因此,探究一种简单、安全、有效抑制鲜切马铃薯品质下降的方法,对其产业发展意义重大。
真空包装是一种静态的低压贮藏形式,其成本低、安全性高,主要通过减少产品的氧化反应、抑制鲜活产品自身代谢及病原菌的繁殖,从而延缓果蔬的成熟和衰老,达到保鲜的目的[6-7]。然而与完整果蔬相比,果蔬鲜切后生命活动并未减慢,反而会进行更旺盛的呼吸和蒸腾作用;因此,真空包装更易引发鲜切果蔬的无氧呼吸,从而加速腐败变质,这是真空包装在采后果蔬尤其是鲜切果蔬保鲜中应用甚少的主要原因。但马铃薯与之不同,其组织结构致密,具有休眠的特性,休眠期内呼吸速率和新陈代谢降到最低[8],因此真空包装有望实现鲜切马铃薯短期贮藏品质的维持。已经有研究证明,真空包装可抑制鲜切马铃薯的微生物生长[9],并且对其物理品质有较好的保持作用[10]。
光作为一种重要的信号分子,能调节作物的生理节律,对果实品质具有重要的调控作用[11]。已有研究发现避光包装可抑制加工产品(番茄酱、龙眼干等)的褐变[12-13],但其在鲜切果蔬上的应用鲜有报道。因此本研究采用真空包装结合避光处理鲜切马铃薯,旨在探究其保鲜机理,为鲜切马铃薯的贮藏保鲜提供科学的理论依据。
1 材料与方法
1.1 材料与试剂
马铃薯(‘荷兰七号’)于2018年7月采收于大连市瓦房店市的农场,随后贮藏于4 ℃下,选取大小、形状一致,不发芽、不变绿、无机械损伤和病虫害的休眠期马铃薯作为实验材料。
定向聚丙烯(oriented polypropylene,OPP)+流延聚丙烯(cast polypropylene,CPP)、热塑性聚酯(polythylene terephthalate,PET)+聚乙烯(polyethylene,PE)、PET+CPP、尼龙(polyamide,PA)+CPP、PE+PA 5 种包装袋购于河北省雄县路腾塑料制品有限公司。
H2O2含量测定试剂盒 苏州科铭生物技术有限公司;Trition X-100、30% H2O2、甲醇、盐酸、聚乙烯吡咯烷酮、邻苯二酚、愈创木酚、磷酸氢二钠、磷酸二氢钠等天津市科密欧化学试剂有限公司。
1.2 仪器与设备
TA. XT plus型质构仪 英国Stable Micro Systems公司;酶标仪 美国Thermo Scientific公司;UV-9200紫外-可见分光光度计 北京瑞利分析仪器有限公司;CR400/CR410色差计 日本Konica Minolta公司;TGL-20M高速台式冷冻离心机 湖南湘仪离心机仪器有限公司;AL240电子精密天平 瑞士Mettler-Toledo公司;D-37520冷冻离心机 德国Sigma有限公司;F-940便携式气体分析仪 美国Felix公司;青叶ZK-600智能真空包装机 东莞市益健包装机械有限公司。
1.3 方法
1.3.1 样品处理
将实验涉及的菜刀菜板和塑料托盘等工具在体积分数为1%的次氯酸钠溶液中浸泡10 min,取出后用蒸馏水冲洗2~3 次,沥干。供试马铃薯于20 ℃下回温10 h后用自来水清洗,随后在1%的次氯酸钠溶液中杀菌10 min,去皮切片(厚度约为3 mm),用去离子水清洗切片30 s,以去除表面淀粉,采用鼓风的方式吹干切片表面水分。将获得的切片随机均分为6 组,分别放入OPP+CPP、PET+PE、PET+CPP、PA+CPP和PE+PA包装袋中抽真空(真空时间30 s、封口时间2 s、冷却时间3 s),然后分别进行避光(黑暗环境下)和不避光(无特殊处理,室内正常光环境)贮藏(温度(20±1)℃、相对湿度60%~70%)。通过对贮藏3 d时6 组不同包装处理的马铃薯切片进行拍照观察,选取保鲜效果最佳的包装袋进行正式实验。
正式实验马铃薯切片的获取方法、抽真空条件及贮藏条件与预实验相同。将切片随机分为两组,一组放入效果最佳的包装袋(厚度为8 μm)中抽真空;另外一组放入塑料托盘中,用保鲜膜(PE,厚度为0.01 mm)覆盖,作为对照组,每组随机分为两小组,每个处理16 袋(盘),每袋(盘)内装有15 片马铃薯,在第0、1、2、3、4天时测定相关指标,每次取3 袋,实验重复3 次。
1.3.2 色泽、硬度、呼吸强度和质量损失率的测定
使用色差计测定马铃薯切片的L值、a值和b值,每个处理重复测定9 片,每片测定3 个值。褐变指数参照Plaou等[14]的方法测定,并按照公式(1)、(2)进行计算。
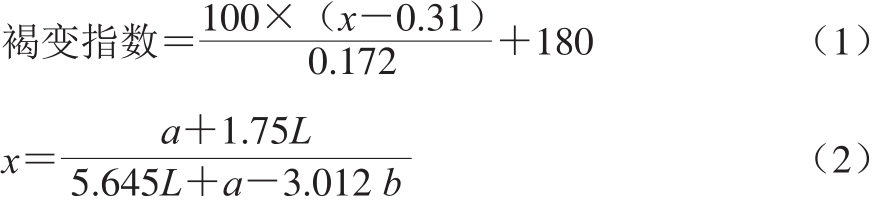
使用配有直径为5 mm圆柱形探头的TA. XT plus型质构仪,以1 mm/s的下压速率测定鲜切马铃薯的硬度,单位为g。
将鲜切马铃薯放置于500 mL带有胶塞的密闭容器中30 min,随后使用F-940便携式气体分析仪测定其呼吸强度,每个样品重复测定3 次。
鲜切马铃薯的质量损失率采用称质量法,按照公式(3)进行计算。
式中:m0代表切片的初始质量/g;m代表取样时切片的质量/g。
1.3.3 霉菌和酵母菌总数的测定
霉菌和酵母菌总数的检测方法参考GB 4789.15—2016《食品安全国家标准 食品微生物学检验 霉菌和酵母计数》[15]。
1.3.4 抗坏血酸、可溶性蛋白质、总酚、类黄酮和H2O2含量的测定
抗坏血酸含量采用Wang Qing等[16]的方法进行测定。称取1.0 g样品,加入5 mL 0.05 mol/L草酸-乙二胺四乙酸溶液提取上清液,测定反应液(2 mL上清液、3 mL 0.05 mol/L草酸-乙二胺四乙酸、0.5 mL体积分数4%偏磷酸-乙酸、1 mL体积分数5%硫酸溶液和2 mL 5 g/100 mL钼酸铵)760 nm波长处的吸光度,单位为mg/g。
可溶性蛋白质含量根据庞坤等[17]的方法进行测定,即采用Bradford牛血清白蛋白比色法。
总酚含量采用Fan Linlin等[18]的福林-酚法进行测定,测定在760 nm波长处的吸光度。以没食子酸质量浓度为x/(mg/L)、吸光度为y制作标准曲线,得到线性回归方程y=0.017x+0.077(R2=0.996),总酚含量单位为mg/g。
类黄酮含量的测定参考Valcarcel等[19]的方法。称取1.0 g样品,加入10 mL 0.5%(体积分数,下同)乙酸与70%丙酮提取上清液。测定反应溶液(3.5 mL上清液、0.25 mL 10 g/100 mL AlCl3·6H2O、0.25 mL 5 g/100 mL NaNO2和1 mL 1mol/L NaOH)在510 nm波长处的吸光度。以儿茶素质量浓度为x/(mg/L)、吸光度为y制作标准曲线,得到线性回归方程为y=0.001x+0.043(R2=0.998),单位为mg/g。
H2O2含量使用试剂盒测定,其测定原理为H2O2与硫酸钛生成黄色的过氧化钛复合物在415 nm波长处有特征吸收。
1.3.5 相关酶活力的测定
多酚氧化酶(polyphenol oxidase,PPO)、过氧化物酶(peroxidase,POD)及过氧化氢酶(catalase,CAT)活力的测定参考Fan Linlin等[18]的方法,以每克鲜质量样品在410 nm波长处每分钟吸光度变化0.01表示1 个PPO活力单位(U),以每克鲜质量样品在470 nm波长处每分钟吸光度变化1表示1 个POD活力单位(U),以每克鲜质量样品在240 nm波长处每分钟吸光度变化0.01表示1 个CAT活力单位(U)。
抗坏血酸过氧化物酶(ascorbate peroxidase,APX)活力根据Wang Qing等[16]的方法进行测定,以每克鲜质量样品在290 nm波长处每分钟吸光度变化1表示1 个APX活力单位(U)。
苯丙氨酸解氨酶(phenylalanine ammonialyase,PAL)活力的测定参照姜爱丽等[20]的方法,以每克鲜质量样品在290 nm波长处每分钟吸光度变化0.01表示1 个PAL活力单位(U)。
1.4 数据统计分析
利用SPSS 17.0软件对数据进行统计分析,对数据进行最小差异显著性(least significant difference,LSD)分析,参数间的相关性利用皮尔森积差相关法进行分析,利用Origin软件作图。
2 结果与分析
2.1 不同真空包装材料对鲜切马铃薯外观品质的影响及其筛选
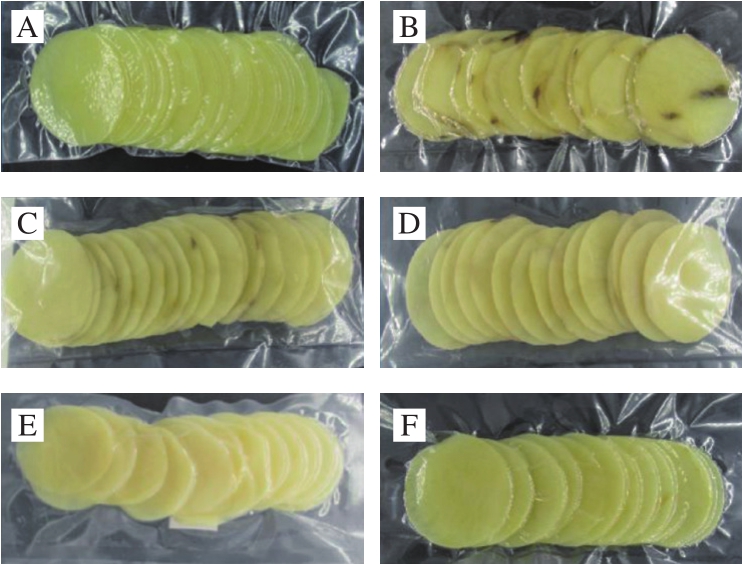
图1 不同真空包装材料对鲜切马铃薯外观品质的影响
Fig. 1 Effects of vacuum packaging materials on appearance of fresh-cut potatoes
A.初始样品;B. OPP+CPP(3 d);C. PET+CPP(3 d);D. PET+PE(3 d);E. PA+CPP(3 d);F. PE+PA(3 d)。
真空包装对鲜切马铃薯品质有较好保持作用的主要原因是其具有隔绝空气和保水的作用,若真空包装材料选取不适,则会引起鲜切马铃薯品质下降,初始现象为包装袋内出现水浸现象,随后由于微生物产气积累造成胀袋;此外,褐变也是包装袋选取不当的表现之一。由图1可知,贮藏3 d时,不同包装材料真空处理的鲜切马铃薯外观品质及胀袋情况差异较大,其中OPP+CPP真空包装的鲜切马铃薯褐变最为严重,且包装袋内出现水浸现象;PET+PE真空包装的鲜切马铃薯胀袋明显,且包装袋内出现小水珠;PET+CPP和PA+CPP真空包装的鲜切马铃薯褐变较轻,但袋内出现水浸现象;PE+PA真空包装的鲜切马铃薯品质最好,且未出现胀袋现象。因此本研究选用PE+PA作为鲜切马铃薯的真空包装材料进行正式实验。
2.2 不同处理对鲜切马铃薯外观品质的影响
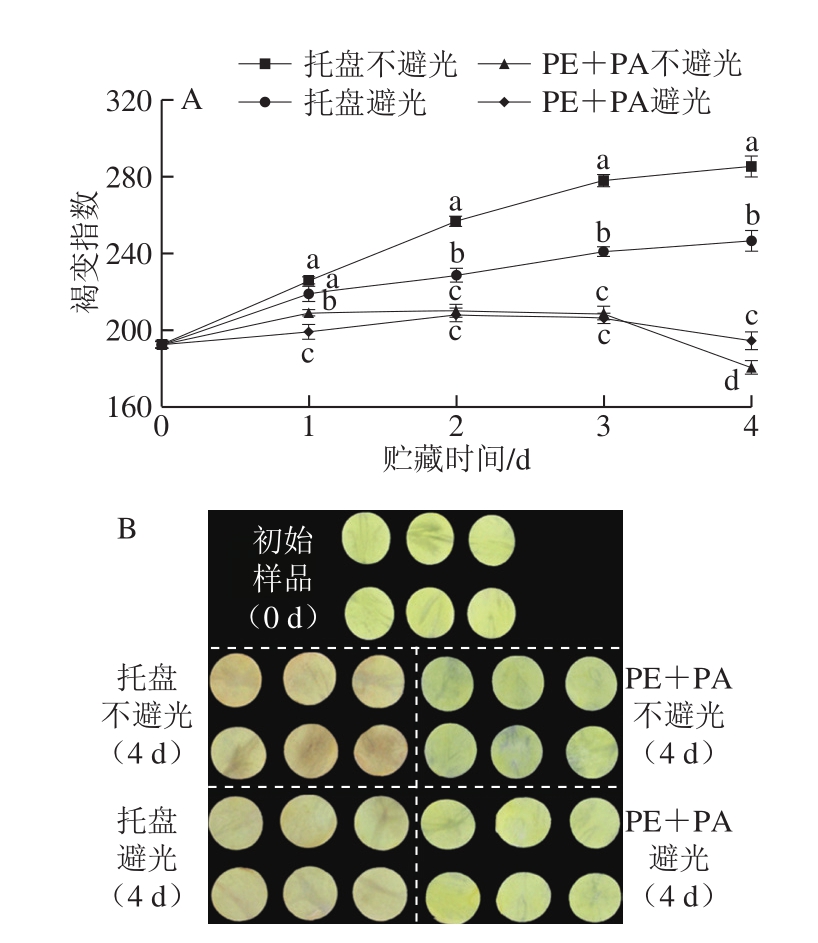
图2 不同处理对鲜切马铃薯褐变指数(A)和外观(B)的影响
Fig. 2 Effects of different treatments on browning index (A) and appearance (B) of fresh-cut potatoes
图A中,相同贮藏时间、不同处理组小写字母不同表示差异显著(P<0.05)。下同。
褐变指数能够反映果实的褐变程度。托盘组马铃薯切片的褐变指数随贮藏时间的延长呈上升趋势(图2A),而真空包装组马铃薯褐变指数值在前3 d稍有上升,随后下降。通过不同处理组鲜切马铃薯贮藏4 d时的对比结果(图2B)可知,托盘组马铃薯切片褐变程度较真空包装组严重。两种托盘避光处理中以不避光组马铃薯切片褐变较为严重。真空处理中,不避光条件下的马铃薯切片在贮藏3 d后颜色变浅,可能是光照条件加速其衰老腐烂所致。由此表明,真空包装结合避光贮藏可最大程度地保持鲜切马铃薯外观品质。
2.3 不同处理对鲜切马铃薯质量损失率、硬度、呼吸强度及微生物指标的影响
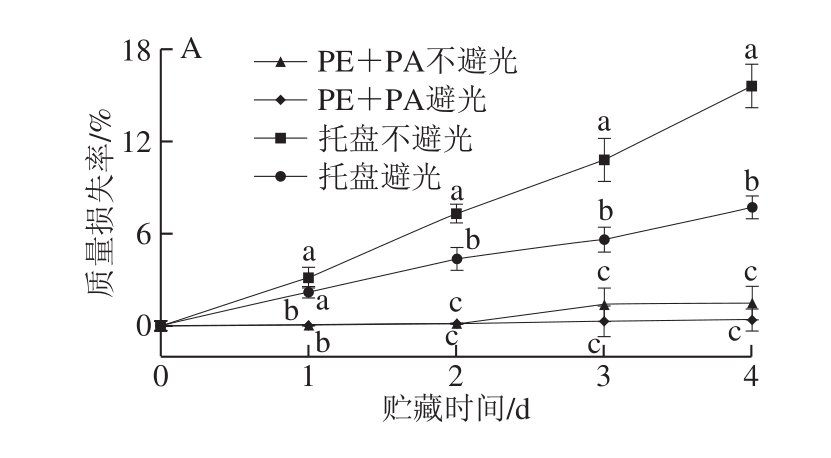
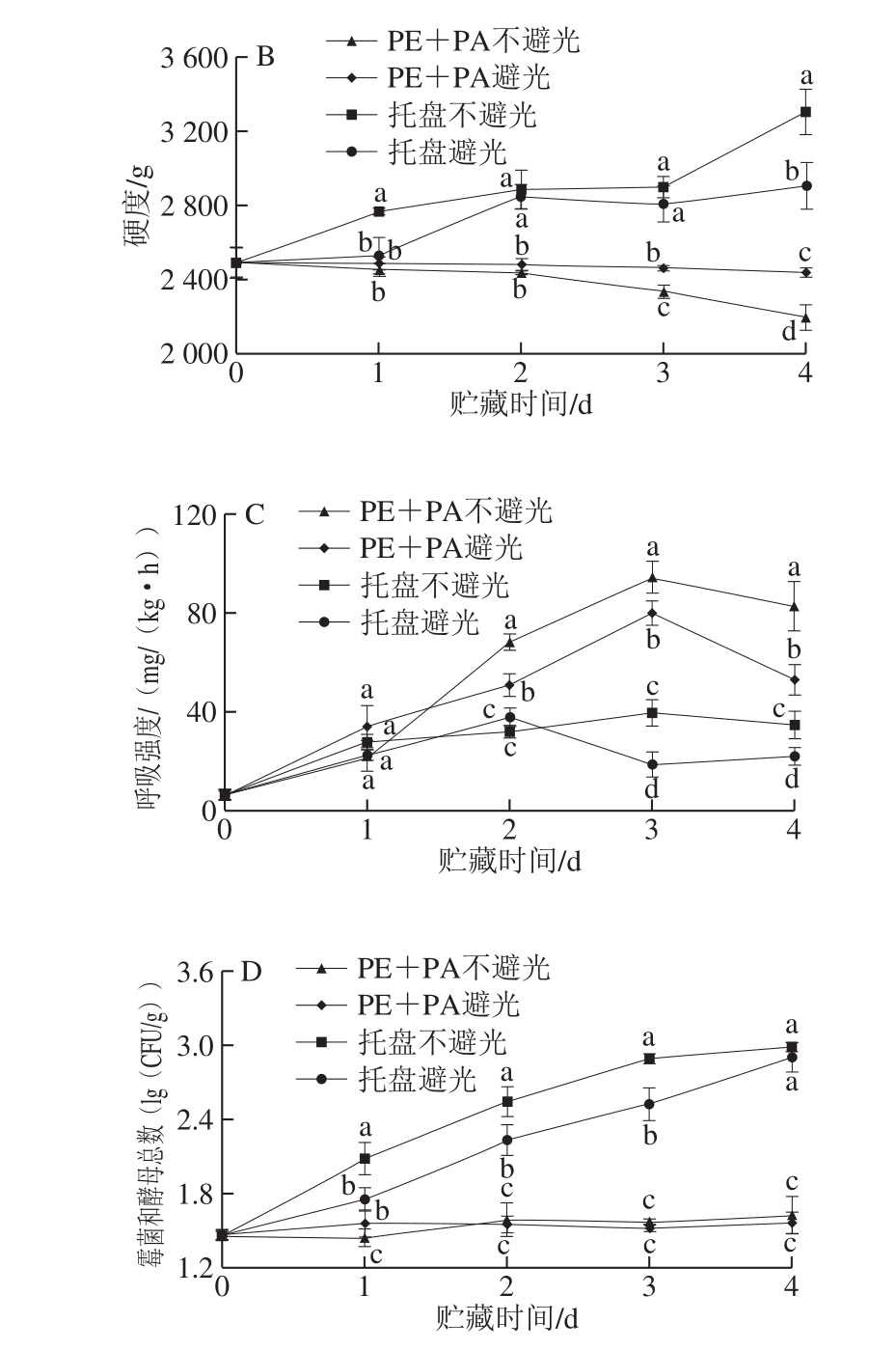
图3 不同处理对鲜切马铃薯质量损失率(A)、硬度(B)、呼吸强度(C)、霉菌和酵母总数(D)的影响
Fig. 3 Effects of different treatments on mass loss rate (A),hardness (B), respiration intensity (C) and total number of molds and yeasts (D) of fresh-cut potatoes
质量损失率是衡量鲜切马铃薯水分蒸发量的重要指标[21]。马铃薯经切分后,由于失去表皮保护层,且失水面积增加,质量损失率随贮藏时间的延长呈上升趋势(图3A),但托盘组马铃薯切片的质量损失率始终显著高于真空组(P<0.05)。就两种托盘处理而言,避光贮藏较不避光贮藏能明显延缓切片质量损失率的上升,但真空条件下避光与不避光处理组间的质量损失率无显著差异(P>0.05)。贮藏4 d时,托盘不避光、托盘避光、真空不避光和真空避光组鲜切马铃薯的质量损失率分别为15.55%、7.70%、1.45%和0.36%,说明真空包装能有效抑制鲜切马铃薯的蒸腾失水,维持其品质,且结合避光贮藏的效果更好。
硬度是衡量鲜切马铃薯品质的重要指标。鲜切果蔬贮藏过程中因衰老导致硬度下降,而马铃薯经切分后,切割表面快速形成愈伤组织,致密的表层导致表面硬化,硬度上升,大幅降低鲜切马铃薯品质[22]。由图3B可知,整个贮藏期间,托盘组马铃薯切片的硬度总体呈上升趋势,而真空组切片硬度稍有下降。贮藏结束时(4 d),托盘不避光和避光组鲜切马铃薯硬度分别比初始样品增加了32.37%和16.38%,这是由于托盘组马铃薯切片水分蒸发迅速,且愈伤组织形成较快,而真空包装不避光和避光组切片硬度分别下降了11.75%和2.08%,说明真空包装结合避光处理能有效抑制鲜切马铃薯愈伤组织的形成速度,并维持其硬度。
呼吸是鲜切马铃薯生命活动的重要体现。由图3C可知,不同处理组马铃薯切片的呼吸强度呈先上升后下降趋势,真空包装组鲜切马铃薯的呼吸强度在贮藏的2~4 d高于托盘组,且差异显著(P<0.05),贮藏2~3 d时,真空包装组马铃薯呼吸强度增加最为明显,随后下降,这一结果主要是鲜切马铃薯呼吸强度是去掉真空包装后测定所致。此外,两种处理中,不避光贮藏组的呼吸强度均高于避光组,说明避光贮藏对鲜切马铃薯的呼吸有抑制作用。
马铃薯经切分后,表皮失去保护,为微生物侵染创造了条件。如图3D所示,托盘组马铃薯切片贮藏期间霉菌和酵母总数不断增加,而真空组变化较小,在贮藏的第4天,托盘不避光、避光和PE+PA不避光、避光组鲜切马铃薯的霉菌和酵母总数分别为初始样品的2.05、1.99 倍和1.12、1.07 倍,说明真空包装能有效抑制需氧菌的生长,延缓鲜切马铃薯腐烂变质。
2.4 不同处理对鲜切马铃薯生理品质的影响
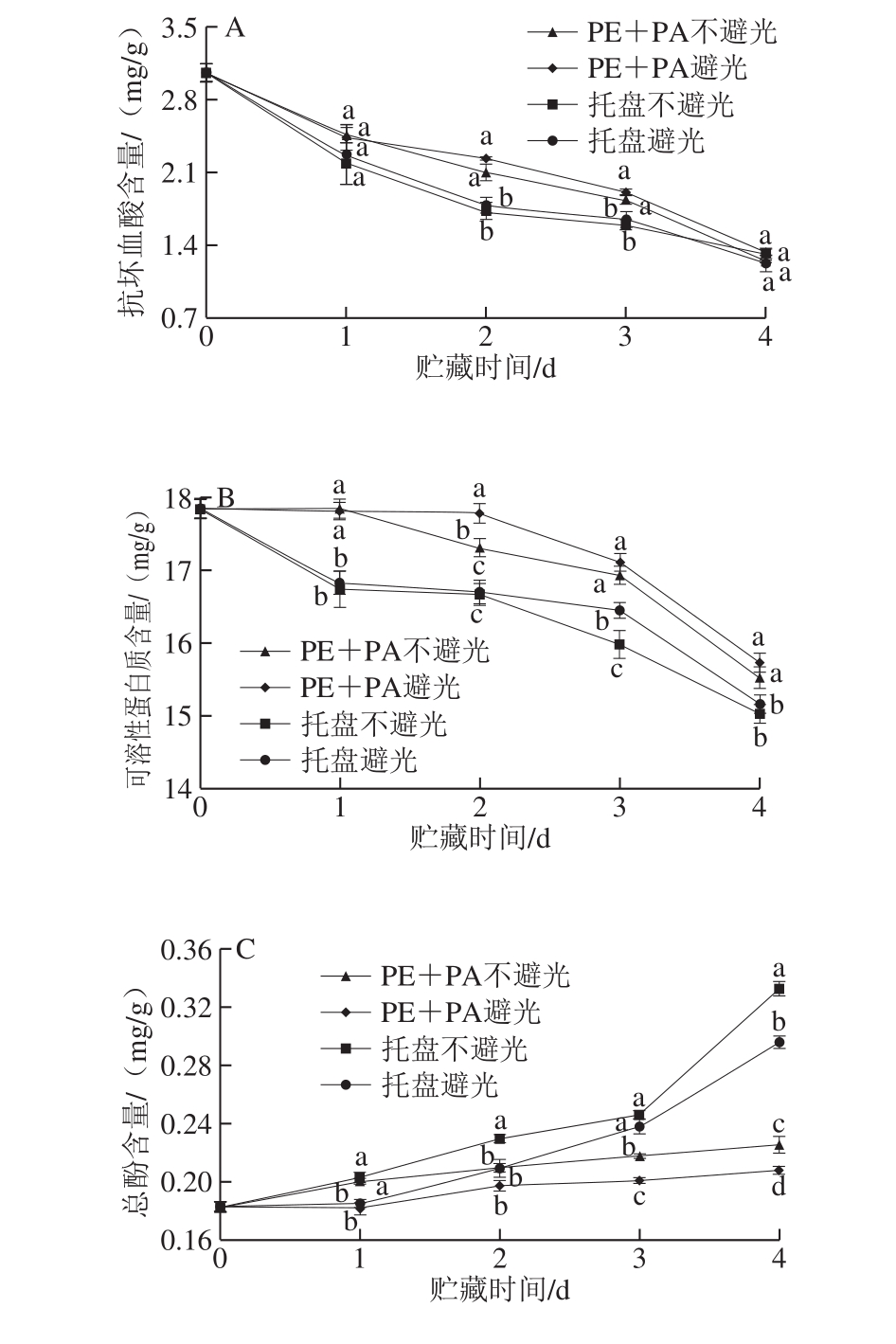
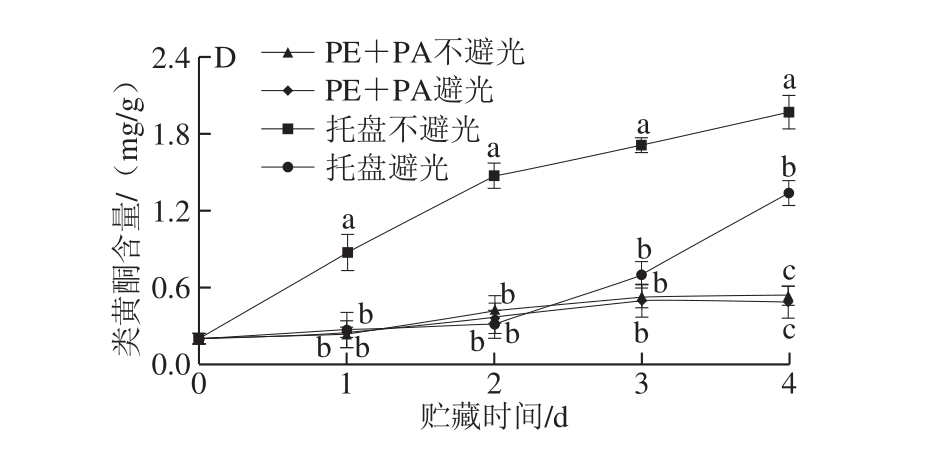
图4 不同处理对鲜切马铃薯抗坏血酸(A)、可溶性蛋白质(B)、总酚(C)、类黄酮(D)含量的影响
Fig. 4 Effects of different treatments on vitamin C (A), soluble protein (B),total phenol (C), and flavonoid (D) contents of fresh-cut potatoes
抗坏血酸是果蔬体内重要的非酶抗氧化物质,其含量可作为其营养品质与贮藏效果的评价指标之一。由图4A可知,贮藏过程中鲜切马铃薯的抗坏血酸含量不断下降,真空组马铃薯切片的抗坏血酸含量始终高于托盘组,且在第2~3天差异显著(P<0.05),避光条件下各组马铃薯的抗坏血酸含量均稍高于不避光贮藏。由此表明,真空包装在避光条件下可有效降低鲜切马铃薯代谢活动,抑制马铃薯切片贮藏期间抗坏血酸流失,保持较高的抗氧化能力。
可溶性蛋白质含量是评价果蔬品质的重要营养指标。如图4B所示,鲜切马铃薯的可溶性蛋白质含量随贮藏时间的延长呈下降趋势。真空包装组鲜切马铃薯的可溶性蛋白质含量显著高于托盘组(P<0.05),且避光贮藏更有利于可溶性蛋白质含量的维持,表明真空包装结合避光处理可能通过抑制马铃薯切片生理代谢以减少对可溶性蛋白质的消耗。
酚类物质与果蔬愈伤形成及酶促褐变密切相关[23-24]。如图4C所示,不同处理组马铃薯切片的总酚含量呈上升趋势,托盘组上升速度更快,贮藏末期(4 d),托盘不避光马铃薯切片的总酚含量是真空不避光组的1.43 倍,托盘避光组马铃薯切片的总酚含量是真空避光组的1.42 倍,且避光条件下的马铃薯切片总酚含量始终维持在较低水平。说明真空包装结合避光处理能有效抑制酚类物质的积累,减缓鲜切马铃薯愈伤形成及褐变速度。
黄酮类化合物的快速积累可加速愈伤组织形成[24]。如图4D所示,鲜切马铃薯贮藏期间类黄酮含量呈逐渐上升的趋势,托盘不避光组类黄酮含量始终显著高于其他处理组(P<0.05),托盘不避光、避光和真空不避光、避光组鲜切马铃薯贮藏结束时(4 d)的类黄酮含量分别为1.97、1.34、0.54 mg/g和0.49 mg/g,表明真空包装结合避光贮藏对鲜切马铃薯愈伤组织形成有较好的抑制作用。
2.5 不同处理对鲜切马铃薯H2O2含量的影响
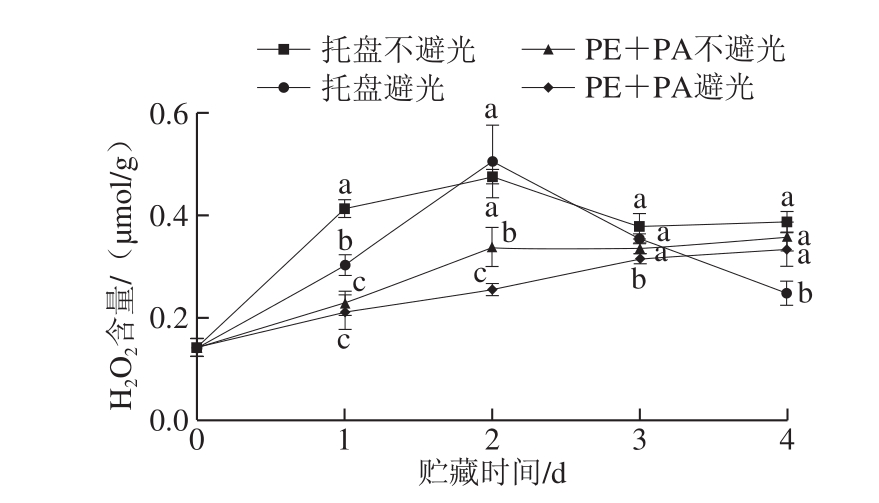
图5 不同处理对鲜切马铃薯H2O2含量的影响
Fig. 5 Effects of different treatments on H2O2 content of fresh-cut potatoes
切割伤害诱导鲜切产品组织内大量活性氧(reactive oxygen species,ROS)产生,破坏自由基代谢平衡,加剧膜质过氧化,降低产品品质,H2O2是ROS的主要形式,是调节植物生理过程的重要信号分子[25]。如图5所示,托盘组马铃薯切片的H2O2含量呈先上升后下降趋势,贮藏第2天时达到峰值;真空包装处理组的H2O2含量随着贮藏时间的延长总体呈上升趋势,且在贮藏前期(0~2 d)显著低于托盘组(P<0.05)。马铃薯切片在不避光条件下的H2O2含量总体高于避光条件,上述结果说明真空包装结合避光贮藏能有效抑制鲜切马铃薯ROS的产生,减少其膜脂损伤。
2.6 不同处理对鲜切马铃薯酶活力的影响
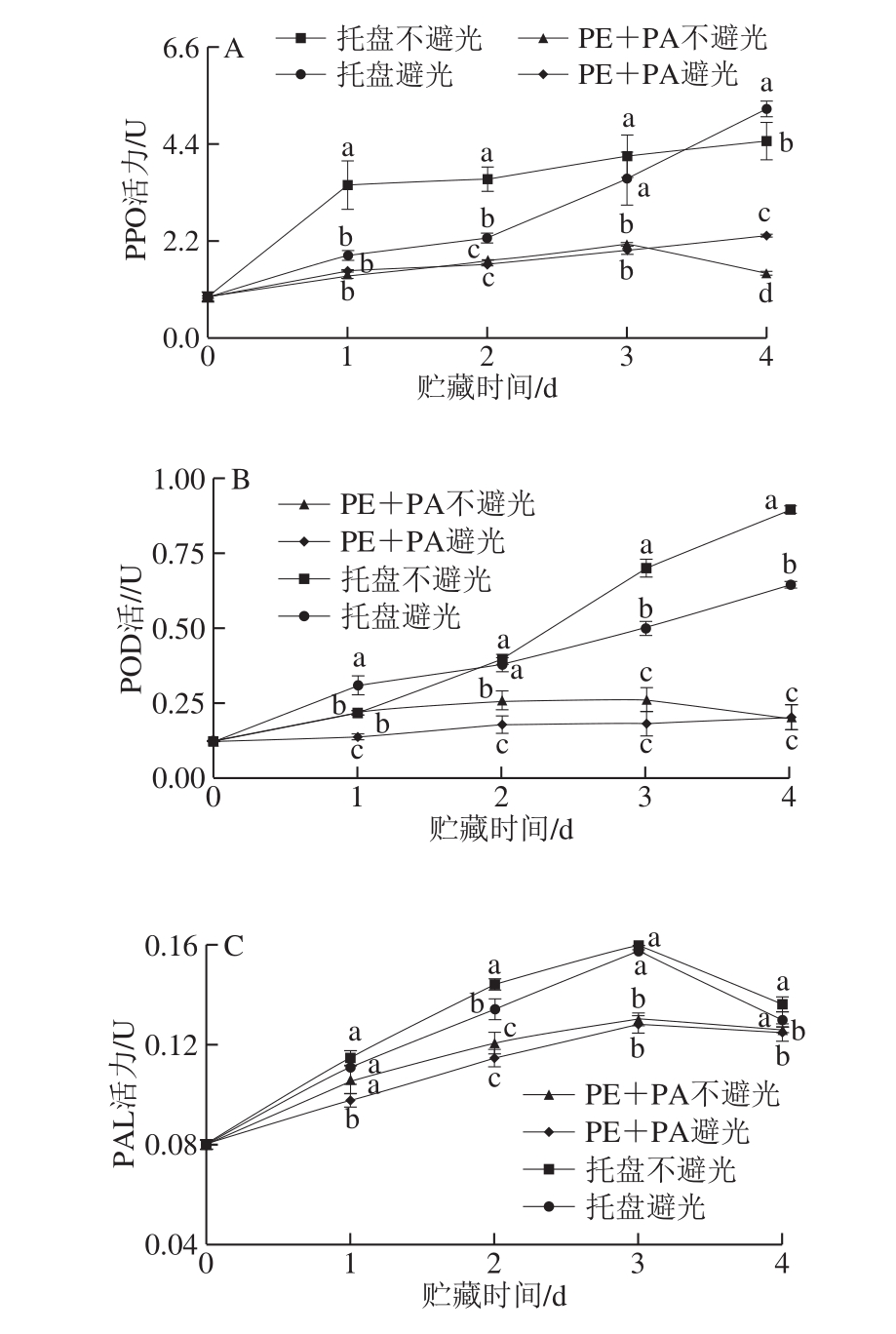
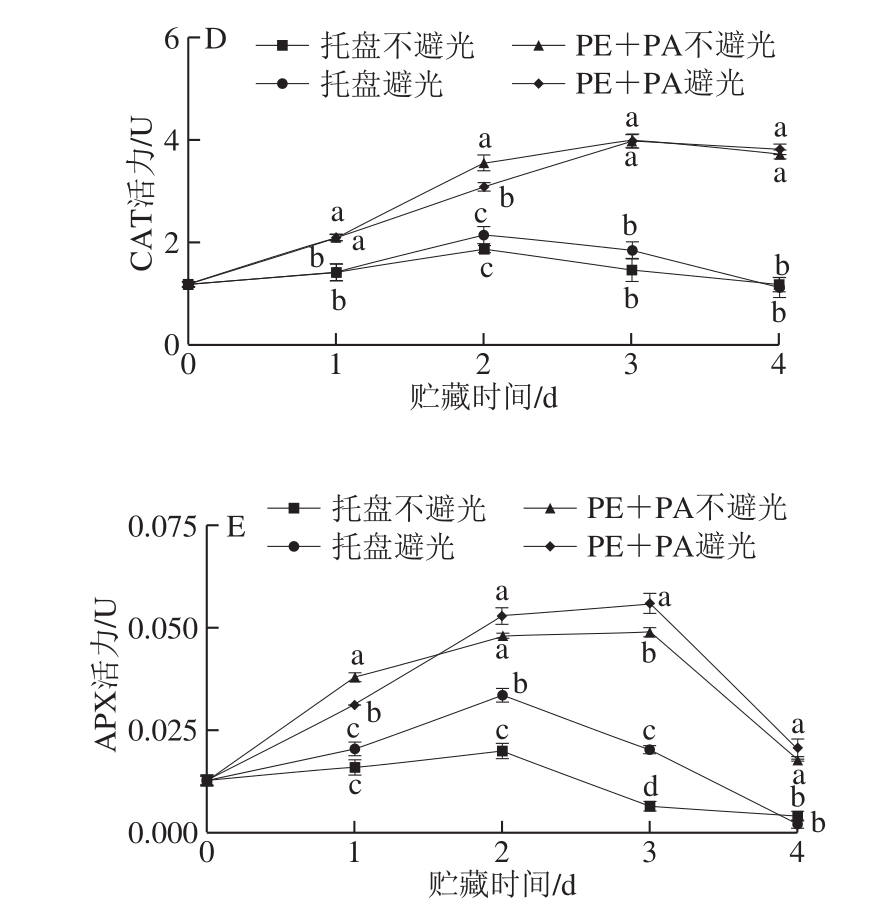
图6 不同处理对鲜切马铃薯PPO(A)、POD(B)、PAL(C)、CAT(D)、APX(E)活力的影响
Fig. 6 Effects of different treatments on PPO (A), POD (B), PAL (C),CAT (D) and APX (E) activities of fresh-cut potatoes
PPO是促使果蔬在处理、贮藏和加工过程中发生酶促褐变反应的重要酶[26]。由图6A可知,整个贮藏期间,各处理鲜切马铃薯PPO活力总体呈逐渐上升的趋势,托盘组PPO活力在贮藏的2~4 d显著高于真空包装组(P<0.05)。托盘不避光组PPO较避光组活力高,而光条件对真空组PPO活力影响不大。由此说明,真空包装能有效抑制PPO活力,从而延缓马铃薯切片褐变。
POD是促进鲜切果蔬愈伤组织形成及酶促褐变的关键酶[27-28]。如图6B所示,不同处理组马铃薯切片贮藏期间的POD活力总体呈上升趋势,托盘组POD活力高于真空组,避光贮藏条件下的POD活力更低。贮藏4 d时,托盘不避光和避光、真空不避光和避光组鲜切马铃薯的POD活力分别比初始样品增加了0.770、0.520、0.080、0.079 U,表明真空包装结合避光贮藏可抑制鲜切马铃薯的POD活力的增加,延缓愈伤组织形成及氧化褐变。
PAL是苯丙烷代谢途径的第一个酶,参与总酚、类黄酮的生成[24]。如图6C所示,鲜切马铃薯的PAL活力呈先上升后下降趋势,贮藏3 d时达到峰值,托盘组PAL活力始终高于真空组,且避光处理组PAL活力较低。由此表明,真空包装结合避光贮藏可降低PAL活力,调节苯丙烷途径从而抑制愈伤组织形成及褐变发生。
ROS的产生会扰乱正常的细胞代谢,但机体会自动启动相应的防御系统,减轻切割后的氧化损伤[25]。CAT作为清除自由基最重要的酶之一,可通过分解H2O2来抑制其对组织造成的氧化损伤。由图6D可知,CAT活力呈先上升后下降趋势,光条件对两组CAT活力影响不大,托盘组CAT活力始终维持较低水平。A
PX可对ROS信号进行精细调节,通过参与抗坏血酸-谷胱甘肽循环以达到清除ROS的目的[29]。如图6E所示,马铃薯切片的APX活力呈先上升后下降的趋势,托盘组和真空组APX活力分别在第2、3天时达到最大值。整个贮藏期间,托盘组APX活力均低于真空组,不避光组APX活力整体低于避光组。由此表明,真空包装结合避光处理能增强抗氧化酶活性,有利于清除有氧代谢积累的有毒副产物,减少膜脂损伤,从而保持鲜切马铃薯品质。
2.7 不同处理组鲜切马铃薯各项生理指标的Pearson相关性分析结果
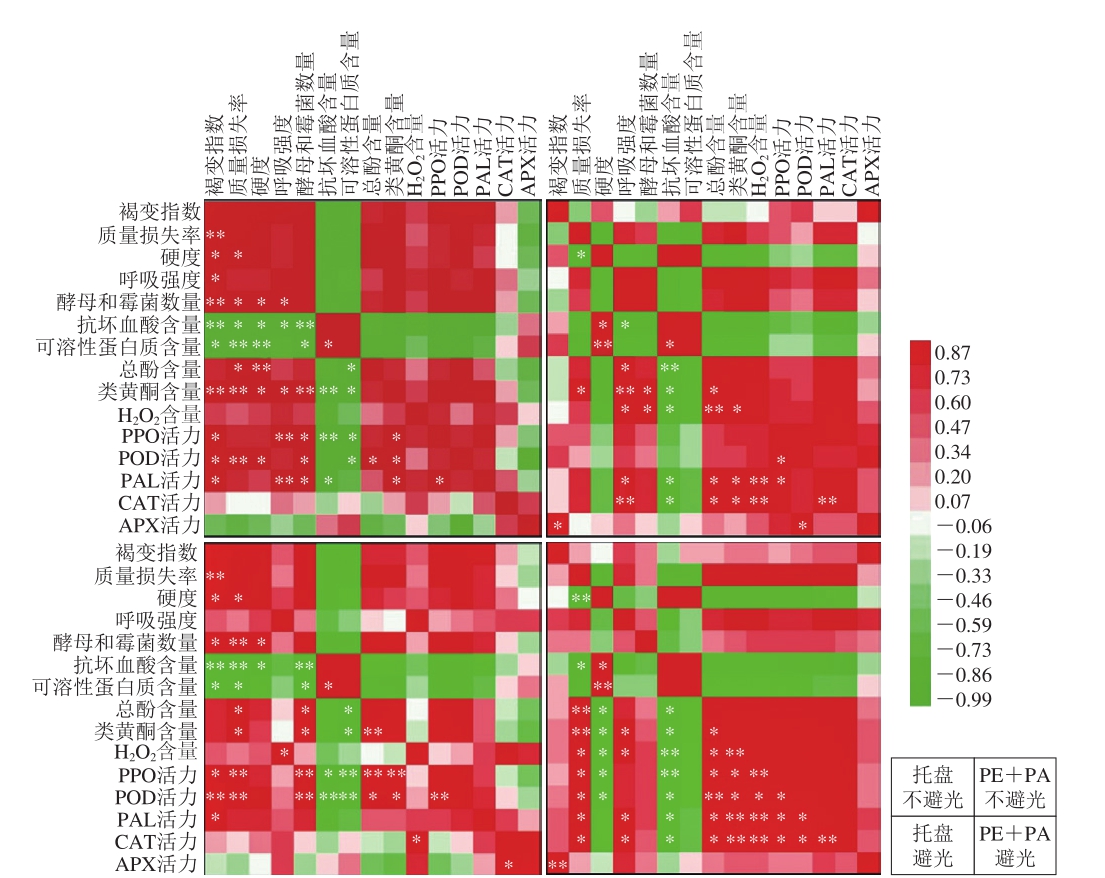
图7 各指标皮尔森相关性矩阵
Fig. 7 Pearson correlation matrix of all indicators investigated
*.显著相关(P<0.05);**.极显著相关(P<0.01)。
通过图7中各组鲜切马铃薯所有指标的相关性分析发现,不同处理组鲜切马铃薯的感官品质、营养物质含量及酶活力之间有较高的相关性;托盘和真空组、真空不避光和避光组的各项指标相关性差异较大。其中托盘组的褐变指数与抗坏血酸含量呈极显著负相关(P<0.01),与可溶性蛋白质含量呈显著负相关(P<0.05),与质量损失率呈极显著正相关(P<0.01),与硬度、PPO、POD、PAL活力呈显著正相关(P<0.05);而真空组的褐变指数仅与APX活力呈显著(P<0.05)或极显著(P<0.01)正相关,说明PPO、POD、PAL活力的上升是托盘组鲜切马铃薯褐变严重的主要原因,而APX活力的提高是真空处理抑制鲜切马铃薯褐变的关键。此外,真空包装避光组马铃薯切片的总酚和类黄酮含量与H2O2含量、PPO、POD、PAL、CAT活力之间存在显著(P<0.05)或极显著(P<0.01)正相关关系,与硬度呈显著负相关(P<0.05)。这表明真空包装结合避光处理可以抑制鲜切马铃薯酶促褐变及愈伤组织形成相关酶活力及物质积累,保持较高的抗氧化能力,从而减轻膜脂损伤,延缓褐变发生及愈伤组织形成,维持其品质。
3 讨 论
果蔬切割过程致使呼吸速率增加,氧化应激爆发,从而加速组织衰老[30]。有研究表明,真空包装材料可以通过隔绝空气、阻止水分散失、抑制有氧微生物侵染延缓果蔬衰老变质[10];避光贮藏可保持马铃薯块茎的膜脂质稳定性[31]。本研究选用真空处理鲜切马铃薯并贮藏于黑暗条件下,结果发现真空避光处理可通过抑制鲜切马铃薯呼吸速率、保持营养物质含量、降低褐变和愈伤组织相关酶活力及物质积累,提升抗氧化酶活力来延缓其衰老并维持品质。
鲜切过程引起的机械损伤使马铃薯切片呼吸作用和代谢反应急剧活化,导致其衰老进程加快;此外,鲜切后马铃薯切片表面失去保护层,组织内的营养汁液外流,给微生物的生长与繁殖提供良好条件,致使产品腐烂。真空包装处理使鲜切马铃薯隔绝空气,一方面可以降低产品呼吸速率和代谢反应;另一方面还可减少水分流失,有效控制微生物污染造成的腐败。这一结果与方宗壮等[32]的研究结果一致。
马铃薯经切分后,表皮伤口快速形成愈伤组织以减少水分蒸发和抵抗病原物侵染,同时在多种酶和底物的作用下加速鲜切表面褐变发生[33-35],由此引起的表面硬化和颜色变化,会严重影响产品的口感和外观品质。伤诱导的苯丙烷代谢在鲜切马铃薯愈伤组织形成过程中起重要作用,其中PAL是此途径的第一限速酶[36]。由此途径调控生成的总酚、类黄酮等物质也可加速伤口愈合,促进愈伤组织的形成[36-37]。POD参与伤口愈合过程中闭合层的形成,能介导相关的耦合过程交联细胞壁上的酚类物质,从而强化细胞壁的结构[28]。此外,切割会引起细胞膜损伤,使酚类化合物与氧化酶(PPO和POD)发生反应,造成褐变[38]。本研究结果显示马铃薯经切割后,总酚、类黄酮含量及PAL、PPO、POD活力快速上升,且在托盘组中,PAL、PPO、POD活力与褐变指数呈显著正相关,表明切割损伤会诱导鲜切马铃薯次生代谢水平,从而促进愈伤组织快速形成及褐变发生;而真空包装结合避光处理可通过保持低氧和高压环境来抑制这些酶活力及物质合成,从而延缓鲜切马铃薯愈伤组织形成及褐变发生,进而保持较好的鲜切品质。Teoh等[39]也发现PAL、PPO、POD是影响鲜切马铃薯品质的重要酶,而真空包装能使鲜切马铃薯维持较低的褐变水平[9]。
果蔬经切割引起的ROS爆发导致细胞膜损伤,从而加快酶促反应和愈伤组织形成[36,38]。然而果蔬体内拥有复杂的抗氧化系统,可通过清除过多的ROS自由基来维持膜的稳定性和完整性。史君彦等[40]研究发现真空包装能有效提高平菇的抗氧化酶活力,降低H2O2对组织的损伤。本研究发现,切割处理诱导了H2O2含量和抗氧化酶(CAT和APX)活力的增加,真空包装结合避光贮藏能有效降低H2O2含量,增加抗氧化酶活力,并维持非酶抗氧化物质(抗坏血酸)含量,这说明,机械损伤可诱导机体内抗氧化系统对伤胁迫做出响应,真空包装结合避光贮藏通过提高抗氧化系统来加速清除组织内的H2O2,减少膜损伤,进而延缓褐变发生及愈伤生成,维持鲜切品质。这一结论与张心怡[41]的研究结果一致。
4 结 论
PE+PA真空包装在避光条件下能有效抑制鲜切马铃薯片的褐变程度,维持较好的外观和营养品质,其机制可能是真空包装处理显著抑制马铃薯切片的呼吸强度、总酚、类黄酮和H2O2的积累,PPO、POD和PAL活力的上升及抗氧化能力的下降,并且通过隔绝空气抑制酵母和霉菌的生长及氧化褐变。因此,PE+PA抽真空结合避光贮藏可作为安全高效的保鲜技术用于鲜切马铃薯的贮藏保鲜。
[1] 曹裕, 张兵兵, 牛玉洁, 等. 品种和切割方式对鲜切马铃薯品质的影响[J]. 食品与发酵科技, 2014, 50(2): 43-47; 56. DOI:10.3969/ji ssn.1674-506X.2014.02-011.
[2] DASTMALCHI K, WANG I, STARK R E. Potato wound-healing tissues: a rich source of natural antioxidant molecules with potential for food preservation[J]. Food Chemistry, 2016, 210: 473-480.DOI:10.1016/j.foodchem.2016.04.123.
[3] 卢肖平. 马铃薯主粮化战略的意义: 瓶颈与政策建议[J]. 华中农业大学学报(社会科学版), 2015(3): 1-7. DOI:10.13300/j.cnki.hnwkxb.2015.03.001.
[4] 李全宏, 赵雅松, 蔡同一, 等. 鲜切马铃薯褐变抑制效果研究[J]. 食品科学, 2005, 26(9): 92-95. DOI:10.3321/j.issn:1002-6630.2005.09.016.
[5] OMS-OLIU G, ROJAS-GRAÜ M A, GONZÁLEZ L A, et al. Recent approaches using chemical treatments to preserve quality of fresh-cut fruit: a review[J]. Postharvest Biology & Technology, 2010, 57(3):139-148. DOI:10.1016/j.postharvbio.2010.04.001.
[6] MANJU S, JOSE L, GOPAL T K S, et al. Effects of sodium acetate dip treatment and vacuum-packaging on chemical, microbiological,textural and sensory changes of Pearlspot (Etroplus suratensis) during chill storage[J]. Food Chemistry, 2007, 102 (1): 27-35. DOI:10.1016/j.foodchem.2006.04.037.
[7] 尤艳莉, 苏新国, 蒋跃明, 等. 真空包装对采后龙眼果实特性的影响[J]. 食品科学, 2004, 25(10): 327-331. DOI:10.3321/j.issn:1002-6630.2004.10.082.
[8] 颉敏华, 李梅, 冯毓琴. 马铃薯贮藏保鲜原理与技术[J]. 农产品加工(学刊), 2007(8): 47-50. DOI:10.3969/j.issn.1671-9646-B.2007.08.014.
[9] BELTRÁN D B, SELMA M V, TUDELA J A, et al. Effect of different sanitizers on microbial and sensory quality of freshcut potato strips stored under modified atmosphere or vacuum packaging[J]. Postharvest Biology and Technology, 2005, 37(1): 37-46. DOI:10.1016/j.postharvbio.2005.02.010.
[10] ROCHA A M C N, COULON E C, MORAIS A M M B. Effects of vacuum packaging on the physical quality of minimally processed potatoes[J]. Food Service Technology, 2003, 3(2): 81-88.DOI:10.1046/j.1471-5740.2003.00068.x.
[11] 程建徽, 魏灵珠, 雷鸣, 等. 不同滤光膜袋对‘红地球’葡萄果实品质的影响[J]. 果树学报, 2015, 32(1): 87-93. DOI:10.13925/j.cnki.gsxb.20140270.
[12] 陈龙, 秦婕, 谢晓霞, 等. 光照对番茄酱储藏中与褐变相关因素的影响[J].食品科技, 2014, 39(6): 66-70. DOI:10.13684/j.cnki.spkj.2014.06.015.
[13] 贺心妍, 滕建文, 韦保耀, 等. 龙眼干贮藏过程的褐变研究[J].现代食品科技, 2017, 33(6): 166-172. DOI:10.13982/j.mfst.1673-9078.2017.6.024.
[14] PALOU E, LÓPEZ-MALO A, BARBOSA-CÁNOVAS G V, et al.Polyphenoloxidase activity and color of blanched and high hydrostatic pressure treated banana puree[J]. Journal of Food Science, 1999,64(1): 42-45. DOI:10.1111/j.1365-2621.1999.tb09857.x.
[15] 国家卫生和计划生育委员会. 食品安全国家标准 食品微生物学检验 霉菌和酵母计数: GB 4789.15—2016[S]. 北京: 中国标准出版社,2016: 3-7.
[16] WANG Qing, DING Tian, ZUO Jinhua, et al. Amelioration of postharvest chilling injury in sweet pepper by glycine betaine[J].Postharvest Biology and Technology, 2016, 112: 114-120.DOI:10.1016/j.postharvbio.2015.07.024.
[17] 庞坤, 胡文忠, 王艳颖, 等. 切割伤害对苹果营养成分及褐变相关酶活性变化的影响[J]. 食品科技, 2008, 33(4): 37-41. DOI:10.3969/j.issn.1005-9989.2008.04.010.
[18] FAN Linlin, SHI, Junyan, ZUO Jinhua, et al. Methyl jasmonate delays postharvest ripening and senescence in the non-climacteric eggplant(Solanum melongena L.) fruit[J]. Postharvest Biology and Technology,2016, 120: 76-83. DOI:10.1016/j.postharvbio.2016.05.010.
[19] VALCARCEL J, REILLY K, GAFFNEY M. Antioxidant activity,total phenolic and total flavonoid content in sixty varieties of potato(Solanum tuberosum L.) grown in Ireland[J]. Potato Research, 2015,58(3): 221-244. DOI:10.1007/s11540-015-9299-z.
[20] 姜爱丽, 胡文忠, 孟宪军, 等. 外源水杨酸处理对采后蓝莓果实苯丙烷代谢的影响[J]. 食品工业科技, 2013, 34(6): 334-337; 341.
[21] 刘战丽, 张龙, 王相友, 等. 热水处理对鲜切马铃薯生理和品质的影响[J]. 食品工业, 2012, 33(8): 52-55.
[22] THYBO A K, CHRISTIANSEN J, KAACK K, et al. Effect of cultivars, wound healing and storage on sensory quality and chemical components in pre-peeled potatoes[J]. LWT-Food Science and Technology, 2006, 39(2): 166-176. DOI:10.1016/j.lwt.2004.11.010.
[23] CABEZAS-SERRANO A B, AMODIO M L, CORNACCHIA R,et al. Suitability of five different potato cultivars (Solanum tuberosum L.) to be processed as fresh-cut products[J]. Postharvest Biology and Technology, 2009, 53(3): 138-144. DOI:10.1016/j.postharvbio.2009.03.009.
[24] 姜红, 王毅, 王斌, 等.马铃薯‘青薯168’茎浅层和深层损伤愈伤能力的比较[J]. 园艺学报, 2018, 45(5): 908-918. DOI:10.16420/j.issn.0513-353x.2017-0602.
[25] 马杰, 胡文忠, 毕阳, 等. 鲜切果蔬活性氧产生和抗氧化体系代谢的研究进展[J]. 食品科学, 2013, 34(7): 316-320.
[26] LEE M K, PARK I. Inhibition of potato polyphenol oxidase by maillard reaction product[J]. Food Chemistry, 2005, 91(1): 57-61.DOI:10.1016/j.foodchem.2004.05.046.
[27] CIOU J Y, LIN H H, CHIANG P Y, et al. The role of polyphenol oxidase and peroxidase in the browning of water caltrop pericarp during heat treatment[J]. Food Chemistry, 2011, 127(2): 523-527.DOI:10.1016/j.foodchem.2011.01.034.
[28] 李昌健, 王毅, 姜红, 等. 采后水杨酸处理对马铃薯块茎愈伤的促进及部分机理研究[J]. 食品与发酵科技, 2018, 54(2): 8-14.DOI:10.3969/j.issn.1674-506X.2018.02-003.
[29] MITTLER R. Oxidative stress, antioxidants and stress tolerance[J].Trends in Plant Science, 2002, 7(9): 405-410. DOI:10.1016/S1360-1385(02)02312-9.
[30] COCETTA G, BALDASSARRE V, SPINARDI A, et al. Effect of cutting on ascorbic acid oxidation and recycling in fresh-cut baby spinach (Spinacia oleracea L.) leaves[J]. Postharvest Biology and Technology, 2014, 88: 8-16. DOI:10.1016/j.postharvbio.2013.09.001.
[31] LILJENBERG C, SANDELIUS A S, SELSTAM E. Effect of storage in darkness and in light on the content of membrane lipids of potato tubers[J]. Physiologia Plantarum, 2010, 43(2): 154-159. DOI:10.1111/j.1399-3054.1978.tb01584.x.
[32] 方宗壮, 段宙位, 窦志浩, 等. 真空包装结合低温处理对鲜切菠萝贮藏品质的影响[J]. 食品工业科技, 2018, 39(6): 259-264.DOI:10.13386/j.issn1002-0306.2018.06.048.
[33] CANTOS E, TUDELA J A, GIL M I, et al. Phenolic compounds and related enzymes are not rate-limiting in browning development of fresh-cut potatoes[J]. Journal of Agricultural and Food Chemistry,2002, 50(10): 3015-3023. DOI:10.1021/jf0116350.
[34] BERNARDS M A. Demystifying suberin[J]. Canadian Journal of Botany, 2002, 80(3): 227-240. DOI:10.1016/j.canlet.2009.01.019.
[35] VISHWANATH S J, DELUDE C, DOMERGUE F, et al. Suberin:biosynthesis, regulation, and polymer assembly of a protective extracellular barrier[J]. Plant Cell Reports, 2015, 34(4): 573-586.DOI:10.1007/s00299-014-1727-z.
[36] 姜红, 毕阳, 李昌健, 等. 马铃薯品种“青薯168”和“陇薯3号”块茎愈伤能力的比较[J]. 中国农业科学, 2017, 50(4): 774-782.DOI:10.3864/j.issn.0578-1752.2017.04.017.
[37] PENDHARKAR M B, NAIR P M. A comparative study of phenylpropanoid metabolism in gamma irradiated and unirradiated potato tubers[J]. Potato Research, 1995, 38(2): 187-198. DOI:10.1007/BF02357932.
[38] 陈晨, 胡文忠, 姜爱丽, 等. 半胱氨酸控制鲜切苹果褐变的生理机制[J].食品科学, 2018, 39(3): 282-288. DOI:10.7506/spkx1002-6630-201803042.
[39] TEOH L S, LASEKAN O, ADZAHAN N M, et al. The effect of ultraviolet treatment on enzymatic activity and total phenolic content of minimally processed potato slices[J]. Journal of Food Science and Technology, 2016, 53(7): 3035-3042. DOI:10.1007/s13197-016-2275-z.
[40] 史君彦, 王清, 高丽朴, 等. 真空包装贮藏对平菇生理变化的影响[J].食品研究与开发, 2017, 38(15): 185-189. DOI:10.3969/j.issn.1005-6521.2017.15.038.
[41] 张心怡. 真空对鲜切莲藕褐变抑制的效果及即食藕片产品的开发研究[D]. 南京: 南京农业大学, 2016: 21-31.