静电纺丝是一种利用高压静电场,将高聚物溶液或者熔融高聚物牵伸为纳米纤维的技术。随着静电纺丝技术的发展,上百种合成高聚物和天然高聚物被成功静电纺丝,其中研究较为广泛的天然高聚物有胶原蛋白、壳聚糖、纤维素等。静电纺丝的过程受多种因素的影响,如分子质量、黏度、电导率、溶剂种类等溶液性质以及电压、流速、接收距离等静电纺丝过程参数。针对静电纺丝技术的研究在组织工程、空气过滤以及纺织行业较多,并且已有一定程度的商业化应用。静电纺丝技术在食品领域的研究近些年才逐渐兴起,在食品行业的应用也还处于初步探究的阶段。静电纺丝技术应用于食品领域主要有以下几方面优点:1)装置简单、纺丝成本低;2)生物活性物质易被包埋于纳米纤维中;3)纳米纤维膜比表面积大;4)静电纺丝的过程是非热加工的过程,有利于保持生物活性物质的功能性。本文将从以下几个方面进行静电纺丝技术在食品行业应用的综述:1)通过静电纺丝技术包埋生物活性物质于纳米纤维中,起到保护及缓释的作用;2)利用纳米纤维所包埋或者结合的具有抑菌或者/及抗氧化功能的生物活性物质,制备具有抑菌抗氧化功能的食品活性包装;3)通过将益生菌包埋于纳米纤维中提高其储存稳定性以及利用纳米纤维膜作为菌载体进行生物发酵;4)利用多种结构的纳米纤维,如核壳结构,包埋多不饱和脂肪酸/脂肪起到抑制其氧化的作用;5)将纳米纤维膜作为固定化酶的载体,提高酶的活力以及重复利用率。
1 静电纺丝技术概述
静电纺丝技术,最早由Formhals[1]于1934年提出,是指利用静电作用力将高分子聚合物转变成微纳米级超细纤维的一种技术。如图1所示,当高聚物溶液以一定流速被挤出注射器针头于直流高压静电场下时,针尖液滴会向最近的低电势点方向伸展,从而形成泰勒锥结构。当电场产生的静电作用力克服泰勒锥尖端液滴的表面张力时,就会喷射出一股带电高聚物的细流。受静电作用力、库伦斥力、表面张力、流体黏弹力等影响,带电射流进一步加速拉伸并呈螺旋摆动,使得溶剂快速挥发,高分子聚合物从而形成连续超细纤维形态,被收集于接收端上。直到1990年左右纳米科技的兴起才让大家关注到静电纺丝在工业上的应用。静电纺丝得到的纤维尺度在纳米级到微米级之间,多尺度的纤维能够赋予其所制备材料很多特殊的性质。纳米纤维形成所用时间极短,整个过程原理涉及多个交叉学科,有流变学、流体力学、空气动力学、静电学等。经过几十年的发展,目前静电纺丝技术制备的纳米纤维广泛应用于生物材料制备及组织工程应用、药物载运、生物活性物质包埋、酶固定化、高效过滤、油-水分离、生物传感器、电池、电容器和膜等领域[2]。根据Scopus数据库统计(图2),从2010年以来有关静电纺丝(Title: electrospinning or electrospun or nanofiber or nanofibrous)的研究性论文共计30 000多篇,来自于中国的文献占36.3%,居于首位。由此可见,静电纺丝技术吸引着越来越多的研究团队进行深入探究。
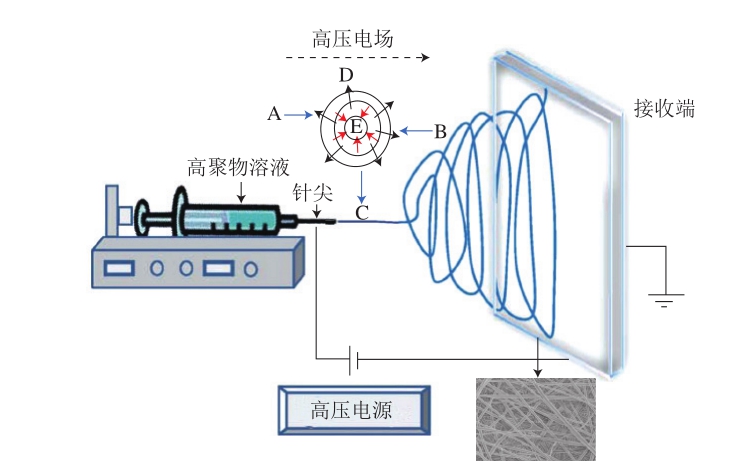
图1 静电纺丝的基本原理示意图[3]
Fig. 1 Schematic diagram of the principle of electrospinning[3]
A.静电作用力;B.空气阻力;C.重力;D.库伦斥力;E.表面张力和黏弹力。
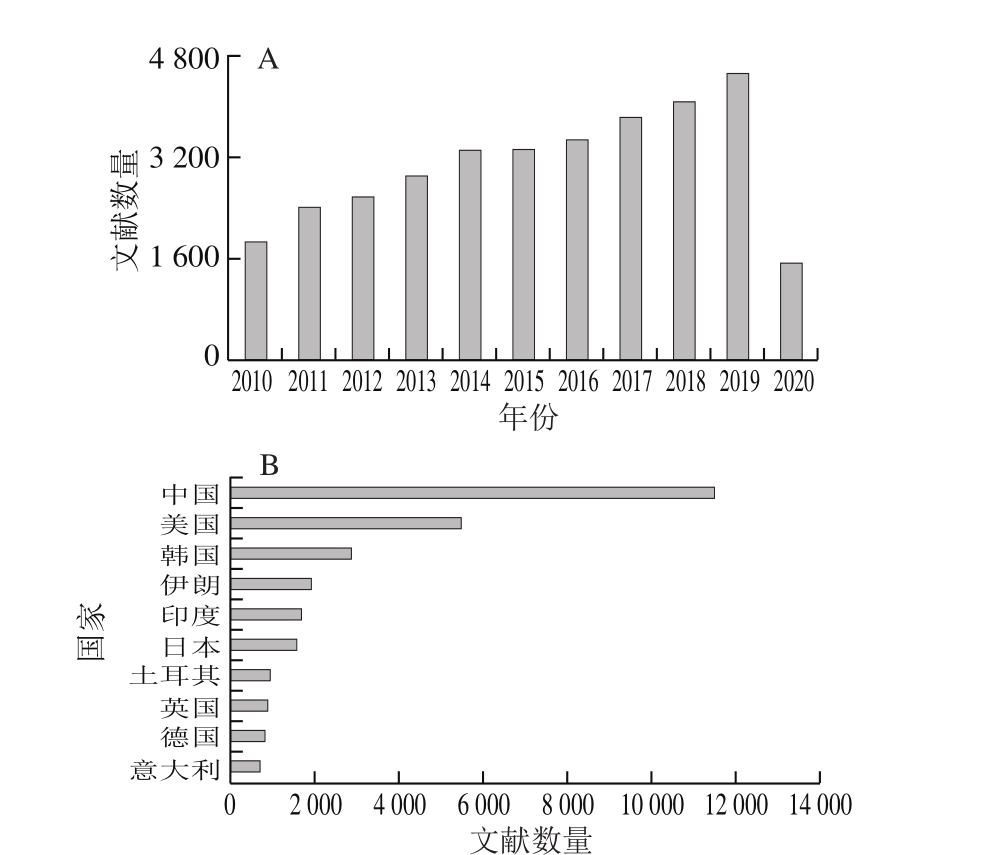
图2 静电纺丝研究论文统计(2010—2020年)
Fig. 2 Number of published papers about electrospinning from 2010 to 2020
A.按年份排序;B.按来源国家排序。
1.1 静电纺丝溶液参数
1.1.1 相对分子质量
高分子的相对分子质量可反映高分子链段在溶液中的缠结状态,相对分子质量高的分子链比相对分子质量低的分子链更容易发生缠结,由此影响溶液的黏度。一般相对分子质量高的高分子聚合物更适合于静电纺丝,因为它们能够提供适当的黏度利于纤维形成[4]。相对分子质量较低的聚合物溶液一般只能得到微球,而相对分子质量过高的聚合物溶液获得的纤维直径一般较大。
1.1.2 高分子浓度及黏度
静电纺丝过程中射流的牵伸受溶液浓度及黏度的影响。如果高分子聚合物溶液浓度低,则在电场力和表面张力的作用下,纤维在还未到达接收端就会被牵伸成片段状,从而形成单独的微球或者串珠状结构(图3)。当高分子聚合物溶液浓度增加,超过临界值后,分子间的缠联程度增加,溶液张力松弛的时间比较长。缠结的高分子在电场力作用下,被牵伸取向而在微球间形成纤维,抑制了静电纺丝过程中溶液射流的断裂,由此可得连续的纤维。如果溶液黏度进一步提高又会很难得到连续的纤维,因为高黏度溶液很难从喷丝口喷出形成连续的射流[5]。
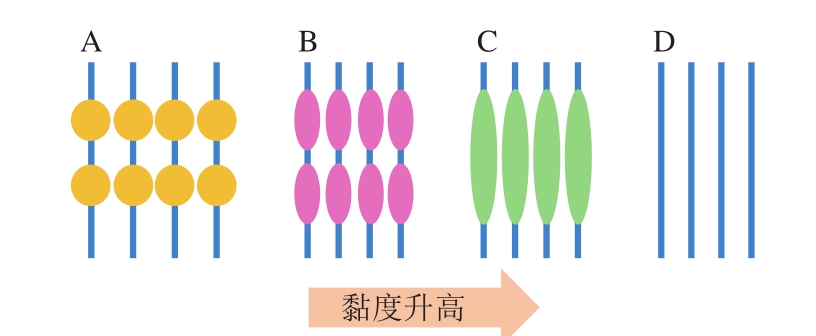
图3 纳米纤维形态随黏度变化的示意图[5]
Fig. 3 Illustration of changes in nanofiber morphology with viscosity of polymer[5]
A.球形串珠;B.椭球形串珠;C.纺锤形串珠;D.纳米纤维。
1.1.3 溶液导电能力
改变溶液的电导率对静电纺丝的影响是两方面的:一方面是改变了库仑力,另一方面改变了静电作用力。可以通过添加盐的形式改变溶液的导电能力,盐的加入也以两种方式影响静电纺丝过程:1)增加了高分子溶液中的离子数量,因此增加了射流中表面电荷的密度和电场中的静电作用力;2)同时也导致射流表面切向电场减弱[5]。许多研究表明通过添加盐使得纳米纤维的形态得到改善,而且纤维直径也有所降低[6-7]。
1.1.4 溶剂种类
不同溶剂的组合能够改变聚合物分子链溶胀和缠结状态,从而对纳米纤维形貌产生影响。在良溶剂中,聚合物分子链溶胀充分,流体力学体积较大,因此发生分子链缠结的浓度要低于用不良溶剂配制的聚合物溶液,故在不同溶剂中聚合物适合于静电纺丝的浓度范围是不同的。高分子聚合物也可以通过无溶剂体系进行静电纺丝,如熔融静电纺丝、热交联静电纺丝、紫外交联静电纺丝、超临界二氧化碳静电纺丝等[8]。近年也有研究者利用低共融溶剂进行静电纺丝[9-10]。
1.2 静电纺丝工艺参数
1.2.1 电压
通常针对某一特定高分子溶液,随着施加电压的增加,针尖的液体会逐渐从球形液滴转变成泰勒锥,将转变为泰勒锥的电压称为临界电压。通常随着电压的增加,纤维直径会由于电荷斥力的增加而降低。但是过高的电压会导致泰勒锥减小,射流不稳定,从而导致串珠的形成[11]。也有报道随着电压升高,纤维直径增加的研究,可能是由于电压升高,射流长度增加,从而引起纤维直径的增加[12]。
1.2.2 流速
静电纺丝过程中,高分子溶液超过某个特定的流速时,能够形成泰勒锥,此时的流速为临界流速。Taylor早在1969年就指出,溶液在针管中流速太小,不足以补偿射流喷出所带走的量时,是无法维持泰勒锥形状的,会导致射流不稳定,得不到理想的纤维形貌[13]。多数研究表明随着流速的增加,纤维的直径增加[14]。但是流速过高会引起串珠的形成。当流速过小时,容易形成内置射流(图4A),也就是在针尖外部观察不到泰勒锥,在针尖内部由于流速较低,溶液补充的速率小于纳米纤维形成的速率,因此不断有新的射流形成。此时射流是不稳定的,容易形成直径分布宽的纳米纤维[14]。当流速过大时,在针尖能够观察到由于液滴的重力作用导致液滴从针尖分离开,此时在接收到的纳米纤维中也能观察到大的聚集体(图4B、C)。
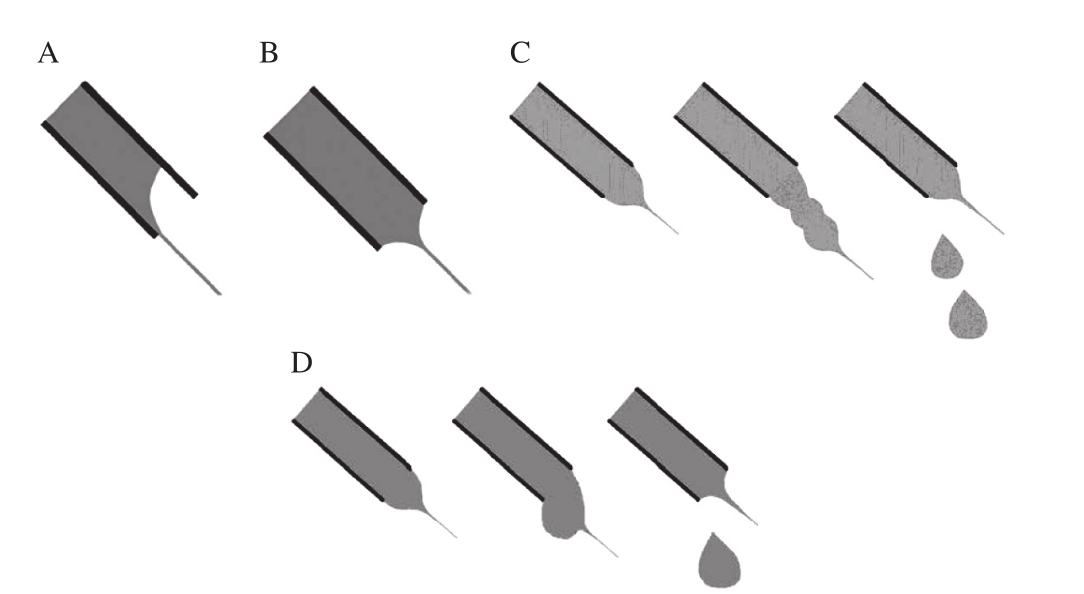
图4 尼龙6静电纺丝过程中不同流速时针尖液滴形状示意图[14]
Fig. 4 Schematic illustration of charged jet modes of nylon 6 nanofibers with different flow rates[14]
A. 0.1 mL/h;B. 0.5 mL/h;C. 1 mL/h;D. 1.5 mL/h。
1.2.3 喷丝头与接收端距离
喷丝头与接收端的距离对于静电纺丝稳定性的调节也是十分重要的。喷丝头与接收端距离减小,电压不变的情况下,单位电场强度增加,但同时溶剂挥发的距离减小,射流不能充分干燥和牵伸,容易导致串珠的形成。喷丝头与接收端距离太远会引起接收端纤维沉降面积增加,而且纤维会寻找更近的低电势点沉降。
1.2.4 温度和湿度
温度的升高对静电纺丝过程最直接的影响是降低了高分子溶液的黏度,加速分子的运动,有利于降低纳米纤维的直径,这一点对于实现天然高分子水溶液的静电纺丝十分有利。越来越多的研究发现湿度对于控制纳米纤维形成也十分重要。Pelipenko等[15]研究了相对湿度对聚乙烯醇(polyvinyl alcohol,PVA)、聚氧乙烯(polyethylene oxide,PEO)以及PVA/透明质酸,PEO/壳聚糖纳米纤维直径的影响,发现相对湿度从4%提高到60%后,PVA的直径从667 nm降低到161 nm,而PEO的直径从252 nm降低到75 nm。Bak等[16]比较了30%和60%相对湿度下静电纺丝得到的胶原蛋白纳米纤维,发现湿度更高的条件下纤维直径更低。
2 静电纺丝在食品领域的应用
2.1 活性包装
包装作为食品加工的下游工作,对食品的保护起到了至关重要的作用。活性包装是指在传统包装中添加抗氧化剂、抑菌剂、指示剂等,使得包装具有抑菌抗氧化、吸湿、缓释香气、吸收异味等功能特性。静电纺丝是一种极具前景的制备活性包装技术。纳米纤维能够为包装提供纳米级的反应空间,巨大的比表面积能够大幅提高感应物质的精度和速率。
2.1.1 抑菌活性包装
具有抑菌功能的静电纺丝纤维膜的制备通常分为两大类:一类是利用高分子材料本身的抑菌性能,如壳聚糖;另一类是将具有抑菌功能的生物活性物质(如银纳米粒子、金属氧化物、多酚类等)包埋于纳米纤维中。由于壳聚糖本身具有抑菌的功能,静电纺丝得到的壳聚糖纳米纤维膜可直接用作抑菌活性包装。Gudjónsdóttir等[17]研究发现,壳聚糖纳米纤维膜包装的牛肉在熟化的过程中能够抑制微生物的繁殖并且提升肉品质。很多研究者通过向壳聚糖纳米纤维膜中添加银纳米粒子来赋予纤维膜更好的抑菌功能[18-19]。通过添加氧化锌也增强了聚氨酯纳米纤维膜的抑菌性,并且具有应用于肉制品保鲜的潜力[20]。植物精油也常被包埋于纳米纤维中,Wen Peng等[21]将肉桂精油包埋于PVA/β-环状糊精纳米纤维膜中后应用于草莓保鲜,发现该法能够显著延长草莓的保质期。荨麻提取物和山竹提取物也被包埋于壳聚糖和聚己内酯纳米纤维膜中并表现出良好的抑菌效果[22-23]。通过包埋葡萄糖氧化酶、溶菌酶等也能够显著提升壳聚糖纳米纤维膜的抑菌性能[24-25]。本课题组研究发现向壳聚糖/PEO纳米纤维膜中添加月桂酰精氨酸乙酯能够显著提升壳聚糖纳米纤维膜的抑菌性能(图5)[26]。
2.1.2 抗氧化活性包装
制备具有抗氧化功能的纳米纤维膜通常通过包埋具有抗氧化功能的生物活性物质实现,可包埋天然抗氧化剂、合成抗氧化剂和具有抗氧化功能的酶。Ge Ling等[27]制备了PVA/壳聚糖/茶叶提取物/葡萄糖氧化酶复合纳米纤维膜,对奶油蛋糕的除氧效率达73%。Fabra等[28]构建了多种双层纳米纤维膜并将水溶性VE包埋于其中,发现不同结构的纳米纤维膜对水溶性VE的缓释效率不同。Aytac等[29]构建了聚乳酸/γ-环状糊精/α-生育酚纳米纤维膜并应用于猪肉保鲜,发现其能够延长猪肉的货架期。Li Linlin等[30]将丁基羟基茴香醚包埋于明胶纳米纤维中并应用于草莓保鲜,能够显著延长草莓的货架期。
2.2 生物活性物质包埋释放
2.2.1 生物活性物质保护
通常具有强抗氧化功能的生物活性物质也容易被氧化,因此如何有效地包埋并保护这类易氧化物质也是食品行业的研究热点。利用静电纺丝技术可以将生物活性物质包埋于纳米纤维中,避免氧气和光照的破坏并且起到缓释的作用。静电纺丝纳米纤维的比表面积优势能够显著提高生物活性物质的包埋效率。Fernandez等[31]将β-胡萝卜素包埋于玉米醇溶蛋白纳米纤维中,显著提高了β-胡萝卜素的紫外光稳定性。Aceituno-Medina等[32]构建了籽粒苋蛋白/普鲁兰多糖纳米纤维用于包埋叶酸,显著提高了叶酸的光稳定性。
2.2.2 多不饱和脂肪酸(脂肪)包埋

图5 壳聚糖/PEO/月桂酰精氨酸乙酯复合纳米纤维膜应用于抑菌研究[26]
Fig. 5 Applications of antimicrobial chitosan/poly(ethylene oxide)/lauric arginate nanofibrous films in antibacterial studies[26]
A.静电纺丝原料;B.静电纺丝装置;C.壳聚糖/PEO/月桂酰精氨酸乙酯复合纳米纤维膜的微观结构;D.复合纳米纤维膜的抑菌活性。
研究表明多不饱和脂肪酸能够有效预防心血管疾病,但是由于多不饱和脂肪酸易氧化,所以通常需要通过包埋的方式保护[33]。传统的包埋方式得到的颗粒通常是毫米或者微米级的,通过静电纺丝或者静电喷雾能够将多不饱和脂肪酸包埋到纳米级别颗粒,大大提高包埋效率,有效防止其氧化。Moomand等[34]研究了玉米醇溶蛋白纳米纤维中鱼油的氧化稳定性,发现鱼油均匀分散在纳米纤维中并且纳米纤维包埋能够使鱼油在14 d中保持低氧化状态。他们进而研究了溶剂和负载量对玉米醇溶蛋白/鱼油纳米纤维的影响,发现体积分数70%乙醇溶液是最佳溶剂,鱼油的负载量可达玉米醇溶蛋白质量的30%[35]。对该体系的体外消化模拟研究发现纳米纤维包埋使鱼油在消化液中得以缓释[36]。García-Moreno等[37]将乳液静电纺丝应用于鱼油包埋,选取了PVA纳米纤维,乳清分离蛋白或者鱼蛋白水解物作为乳化剂,鱼油负载率最高为11.2%。然而García-Moreno等发现PVA纤维并不能给鱼油提供氧化保护作用,反而静电纺丝得到的纳米纤维过氧化值显著高于对照组。通过对静电纺丝环境提供氮气、增加纤维直径、添加乙二胺四乙酸均无法改善,可能是有由于PVA的促氧化作用使得PVA纤维不能作为鱼油的良好载体。Yang Huan等[38]通过同轴静电纺丝的方式将鱼油包埋于聚乙烯聚吡咯烷酮(polyvinylpyrrolidone,PVP)纤维中,负载率为14.5%,相比于非同轴纤维,将鱼油包埋于纤维核中显著提高了鱼油的氧化稳定性。
2.2.3 益生菌包埋
为了使益生菌在加工、贮藏以及肠胃道中具有更高的存活率,越来越多的研究者致力于益生菌包埋的研究,通过将益生菌包埋于一定的载体中,以提高益生菌对环境压力的抵抗力。多种包埋方法(如微胶囊、乳化、交联、脂质体等)被应用于益生菌包埋。但是常规的包埋方法需要利用高温条件或者有机溶剂,从而导致菌量下降或者有毒物质残留等问题。静电纺丝技术由于不需要严苛的温度和压力,也不需要使用有毒的有机溶剂,在益生菌包埋领域越来越受到关注。由于诸多食品级的原料,如多糖、蛋白均可以用于静电纺丝,益生菌静电纺丝包埋在食品行业具有良好的应用前景。在已有研究中,利用静电纺丝技术进行益生菌包埋的文献见表1。
表1 益生菌静电纺丝包埋的研究
Table 1 Previous studies on electropinning in probiotic encapsulated nanofibers

包埋益生菌 静电纺丝原料 参考文献Bifidobacterium animalis subsp. lactis Bb12 PVA [39]Lactobacillus plantarum 423 PEO [42]Lactobacillus acidophilus 可溶性膳食纤维(提取自豆渣、棕榈树干和复叶) [43]Bifidobacterium animalis subsp. lactis Bb12 乳清浓缩蛋白或直链淀粉 [44]Lactobacillus gasseri PVA [40]T4噬菌体 壳:PEO/CDA;核:T4噬菌体缓冲液 [41]Lactobacillus plantarum PVA [45]
López-Rubio等[39]首次将双歧杆菌利用静电纺丝技术包埋于聚乙烯醇中,并且采用了同轴静电纺丝技术,将双歧杆菌包埋于内芯之中。其研究发现静电纺丝包埋后的益生菌在室温和冷冻条件下的存活率相比于未包埋的均有明显提高。Amna等[40]首次将静电纺丝包埋后的加氏乳杆菌用于动物实验,将包埋后的加氏乳杆菌定植于无菌鼠中发现,定植后的小鼠比对照组明显增重。Korehei等[41]通过同轴静电纺丝得到T4噬菌体核壳包埋结构,并研究了静电纺丝对T4噬菌体的释放的影响,发现PEO分子质量越大,释放速率越慢,而且壳结构中加入二乙酸纤维素有利于控制噬菌体的释放,达到缓释的效果。
2.3 酶固定化
食品工业需要大量应用固定化酶进行催化反应,而酶的催化效率以及重复使用率很大程度依赖于固定化酶的载体。越来越多的纳米结构材料用于酶固定化,相比于其他纳米结构(如纳米颗粒),纳米纤维具有易制备、比表面积高、连续性好的优点[46]。静电纺丝固定化酶主要有共纺包埋式固定、物理吸附式固定以及共价键结合固定的方式(图6)。近几年静电纺丝固定化酶相关的研究见表2。
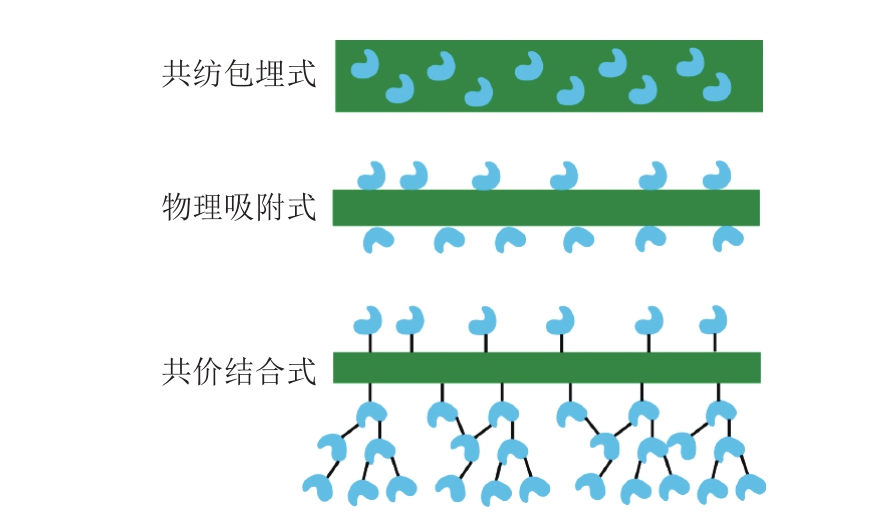
图6 纳米纤维酶固定化方式示意图
Fig. 6 Schematic diagram of enzyme immobilization methods by nanofibers
表2 常见固定化酶及相应载体、固定化方式
Table 2 List of immobilized enzymes, electrospining materials, and immobilization methods
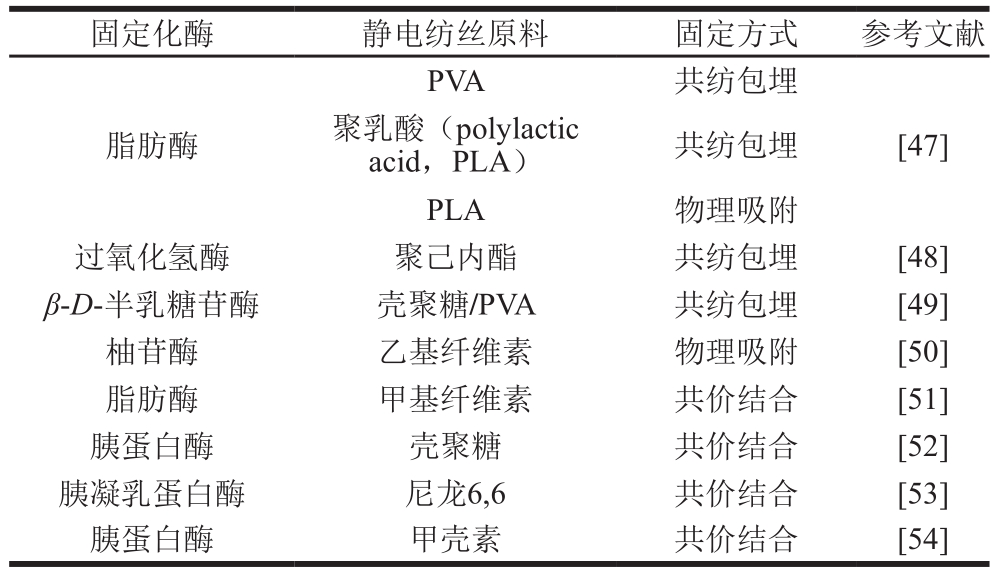
固定化酶 静电纺丝原料 固定方式 参考文献PVA 共纺包埋脂肪酶 聚乳酸(polylactic acid,PLA) 共纺包埋[47]PLA 物理吸附过氧化氢酶 聚己内酯 共纺包埋 [48]β-D-半乳糖苷酶 壳聚糖/PVA 共纺包埋 [49]柚苷酶 乙基纤维素 物理吸附 [50]脂肪酶 甲基纤维素 共价结合 [51]胰蛋白酶 壳聚糖 共价结合 [52]胰凝乳蛋白酶 尼龙6,6 共价结合 [53]胰蛋白酶 甲壳素 共价结合 [54]
2.3.1 共纺包埋式固定
通过将高分子和酶共混后静电纺丝能够将酶直接包埋固定于纳米纤维中。由于大多数酶只能溶于水中,所以要求静电纺丝的高分子是水溶性的。常见的有PVA、PEO、PVP等。共纺得到的固定化酶具有较高的负载率(高达纤维质量的50%),并且静电纺丝得到的膜能够直接应用于电极上用作生物传感器。虽然使用这种方法固定化酶简单高效,但是也有一些缺点:1)酶不仅被包埋在纤维内部,同样也分布在纤维表面。在催化的过程中,表面的酶分子会不断地被洗脱,从而大幅降低固定化酶的回收率;2)由于大部分的酶分子被限制在纤维内部,无法与反应体系中的底物充分接触,其催化能力也大大受限;3)该方法对材料和酶的要求较高,需要所选高分子与酶能够形成均相的体系,即使二者能够混合均匀也还是可能形成串珠状结构;4)大部分一步法得到的纳米纤维膜都需要交联来改善其机械性能以及溶剂稳定性,但是这些交联对于酶的催化效率可能有负面作用。交联通常也会降低纤维膜的孔隙率,从而影响反应效率。
2.3.2 物理吸附式固定
为了克服静电纺丝溶剂限制的问题,最简单的方式就是利用酶的氨基残端与多聚物形成的氢键或者极性相互作用进行物理吸附的结合。Huang Weijuan等[50]以乙基纤维素纳米纤维膜为支撑材料,以物理吸附的方式将柚苷酶吸附于纤维膜上,再利用静电相互作用构建乙基纤维素-柚苷酶-海藻酸钠层层叠加的结构,其酶活力也随着叠加层数的增加而增加,最后将其应用于去除葡萄汁中的苦味物质(柠檬苦素和柚苷)。
2.3.3 共价键结合式固定
为了克服物理吸附方式酶结合不稳定的缺点,可以利用多聚物的功能基团与酶进行共价键结合。这个过程需要活化纤维表面的多聚物分子,使其能够与酶发生交联反应。Huang Xiaojun等[55]将脂肪酶共价结合到了纤维素纳米纤维上。将纤维素纳米纤维膜用NaIO4进行处理,得到活化的醛基,使其与脂肪酶进行交联。Lee等[51]利用共价结合的方式将脂肪酶固定于甲基纤维素纳米纤维上,但是发现二次使用时酶的活力大幅下降,通过引入酶聚集体的方法解决了这一问题,使用7 次后酶活力仍能保持90%以上。Wong等[53]比较了尼龙6,6静电纺丝膜和涂膜对胰凝乳蛋白酶固定化的效果,发现静电纺丝膜固定化酶的热稳定性高于涂膜以及未固定化的酶。Huang Wencan等[54]将胰蛋白酶共价结合到甲壳素纳米纤维上,将酶进行交联后其负载率提高了6.3 倍,利用具有磁性的纳米颗粒不仅有利于酶的负载同时也使得酶的回收变得十分便捷。
3 结 语
静电纺丝纳米纤维膜在食品行业进行大规模应用的一大局限是如何实现纳米纤维膜的量产。虽然一些合成高分子的纳米纤维膜已经实现了量产和商用,但是由于食品领域研究的大多是天然高分子,由于其相对分子质量分布不均以及产品性质随着批次不同而不稳定的缺点难以做到稳定的量产。天然高分子尤其是多糖,由于静电纺丝临界浓度较低,限制了其生产效率,传统的针头式静电纺丝无法满足其生产效率的需求。因此进行静电纺丝技术的革新也是推动纳米纤维膜产业化应用所必需的一步。通常得到的天然高分子纳米纤维膜的机械性能以及溶剂稳定性都较差,需要通过与合成高分子进行混合静电纺丝或者化学交联等方式来进行改善。近些年针对天然高分子进行安全无毒的交联也是一大研究方向,如通过多酚、美拉德反应等进行交联。另外,研究者大多关注纳米纤维膜包装的功能特性,针对纳米纤维可食用包装的包装特性也是未来的发展方向之一,通过向纳米纤维中添加无机物等调节纳米纤维包装的透气性和透氧性。
静电纺丝技术作为一种简单、低成本的制备纳米纤维的方式吸引着越来越多的研究者投身其研究中。高比表面积、孔隙率以及可调控的纤维形态使其能够作为纳米包埋体系的优良载体。具有一定功能特性的生物活性物质包埋于纳米纤维中能够实现保护、缓释以及抑菌抗氧化等功能特性。纳米纤维作为固定化酶的载体提升酶的活力和利用率。纳米纤维在食品行业的实际应用还需要大量的理论及应用研究支持。实现静电纺丝纳米纤维膜在食品行业的广泛应用还需要各领域的研究者和技术人员通力合作。
[1] FORMHALS A. Process and apparatus for preparing artificial threads:1975504[P]. 1934-02-10[2020-03-27].
[2] KRIEGEL C, ARRECHI A, KIT K, et al. Fabrication,functionalization, and application of electrospun biopolymer nanofibers[J]. Critical Reviews in Food Science and Nutrition, 2008,48(8): 775-797. DOI:10.1080/10408390802241325.
[3] BHARDWAJ N, KUNDU S C. Electrospinning: a fascinating fiber fabrication technique[J]. Biotechnology Advances, 2010, 28(3): 325-347. DOI:10.1016/j.biotechadv.2010.01.004.
[4] 袁文婕. 表面改性静电纺丝PCU支架用于小口径血管的研究[D]. 天津: 天津大学, 2013: 5-6.
[5] HAIDER A, HAIDER S, KANG I K. A comprehensive review summarizing the effect of electrospinning parameters and potential applications of nanofibers in biomedical and biotechnology[J].Arabian Journal of Chemistry, 2018, 11(8): 1165-1188. DOI:10.1016/j.arabjc.2015.11.015.
[6] ZONG Xinhua, KIM K S, FANG Dufei, et al. Structure and process relationship of electrospun bioabsorbable nanofiber membranes[J].Polymer, 2002, 43(16): 4403-4412. DOI:10.1016/S0032-3861(02)00275-6.
[7] CHOI J S, LEE S W, JEONG L, et al. Effect of organosoluble salts on the nanofibrous structure of electrospun poly(3-hydroxybutyrate-co-3-hydroxyvalerate)[J]. International Journal of Biological Macromolecules, 2004, 34(4): 249-256. DOI:10.1016/j.ijbiomac.2004.06.001.
[8] ZHANG Bin, YAN Xu, HE H W, et al. Solvent-free electrospinning:opportunities and challenges[J]. Polymer Chemistry, 2017, 8(2): 333-352. DOI:10.1039/C6PY01898J.
[9] MANO F, AROSO I M, BARREIROS S, et al. Production of poly(vinyl alcohol) (PVA) fibers with encapsulated natural deep eutectic solvent (NADES) using electrospinning[J]. ACS Sustainable Chemistry & Engineering, 2015, 3(10): 2504-2509. DOI:10.1021/acssuschemeng.5b00613.
[10] MANO F, MARTINS M, SÁ-NOGUEIRA I, et al. Production of electrospun fast-dissolving drug delivery systems with therapeutic eutectic systems encapsulated in gelatin[J]. AAPS PharmSciTech,2017, 18(7): 2579-2585. DOI:10.1208/s12249-016-0703-z.
[11] KI C S, BAEK D H, GANG K D, et al. Characterization of gelatin nanofiber prepared from gelatin-formic acid solution[J]. Polymer,2005, 46(14): 5094-5102. DOI:10.1016/j.polymer.2005.04.040.
[12] BAUMGARTEN P K. Electrostatic spinning of acrylic microfibers[J].Journal of Colloid and Interface Science, 1971, 36(1): 71-79.DOI:10.1016/0021-9797(71)90241-4.
[13] TAYLOR G I. Instability of jets, threads, and sheets of viscous fluid[M]// HETÉNYI M. Applied mechanics. Verlag Berlin Heidelberg:Springer, 1969: 382-388.
[14] ZARGHAM S, BAZGIR S, TAVAKOLI A, et al. The effect of flow rate on morphology and deposition area of electrospun nylon 6 nanofiber[J]. Journal of Engineered Fibers and Fabrics, 2012, 7(4): 42-49. DOI:10.1177/155892501200700414.
[15] PELIPENKO J, KRISTL J, JANKOVIĆ B, et al. The impact of relative humidity during electrospinning on the morphology and mechanical properties of nanofibers[J]. International Journal of Pharmaceutics,2013, 456(1): 125-134. DOI:10.1016/j.ijpharm.2013.07.078.
[16] BAK S Y, YOON G J, LEE S W, et al. Effect of humidity and benign solvent composition on electrospinning of collagen nanofibrous sheets[J]. Materials Letters, 2016, 181: 136-139. DOI:10.1016/j.matlet.2016.06.019.
[17] GUDJÓNSDÓTTIR M, GACUTAN M D, MENDES A C, et al.Effects of electrospun chitosan wrapping for dry-ageing of beef, as studied by microbiological, physicochemical and low-field nuclear magnetic resonance analysis[J]. Food Chemistry, 2015, 184: 167-175.DOI:10.1016/j.foodchem.2015.03.088.
[18] MUNTEANU B S, AYTAC Z, PRICOPE G M, et al. Polylactic acid(PLA)/silver-NP/vitamin E bionanocomposite electrospun nanofibers with antibacterial and antioxidant activity[J]. Journal of Nanoparticle Research, 2014, 16(10): 2643. DOI:10.1007/s11051-014-2643-4.
[19] KOHSARI I, SHARIATINIA Z, POURMORTAZAVI S M.Antibacterial electrospun chitosan-polyethylene oxide nanocomposite mats containing bioactive silver nanoparticles[J]. Carbohydrate Polymers, 2016, 140: 287-298. DOI:10.1016/j.carbpol.2015.12.075.
[20] AMNA T, YANG J, RYU K S, et al. Electrospun antimicrobial hybrid mats: innovative packaging material for meat and meat-products[J].Journal of Food Science and Technology, 2015, 52(7): 4600-4606.DOI:10.1007/s13197-014-1508-2.
[21] WEN Peng, ZHU Dinghe, WU Hong, et al. Encapsulation of cinnamon essential oil in electrospun nanofibrous film for active food packaging[J]. Food Control, 2016, 59: 366-376. DOI:10.1016/j.foodcont.2015.06.005.
[22] CHARERNSRIWILAIWAT N, ROJANARATA T, NGAWHIRUNPAT T,et al. Electrospun chitosan-based nanofiber mats loaded with Garcinia mangostana extracts[J]. International Journal of Pharmaceutics, 2013,452(1/2): 333-343. DOI:10.1016/j.ijpharm.2013.05.012.
[23] ERBAY E A, DAĞTEKIN B B G, TÜRE M, et al. Quality improvement of rainbow trout fillets by whey protein isolate coatings containing electrospun poly(ε-caprolactone) nanofibers with Urtica dioica L. extract during storage[J]. LWT-Food Science and Technology, 2017, 78: 340-351. DOI:10.1016/j.lwt.2017.01.002.
[24] HUANG Weijuan, XU Huijinlan, XUE Yue, et al. Layer-by-layer immobilization of lysozyme-chitosan-organic rectorite composites on electrospun nanofibrous mats for pork preservation[J]. Food Research International, 2012, 48(2): 784-791. DOI:10.1016/j.foodres.2012.06.026.
[25] BÖSIGER P, TEGL G, RICHARD I M T, et al. Enzyme functionalized electrospun chitosan mats for antimicrobial treatment[J]. Carbohydrate Polymers, 2018, 181: 551-559. DOI:10.1016/j.carbpol.2017.12.002.
[26] DENG L L, TAXIPALATI M, ZHANG A P, et al. Electrospun chitosan/poly(ethylene oxide)/lauric arginate nanofibrous film with enhanced antimicrobial activity[J]. Journal of Agricultural and Food Chemistry, 2018, 66(24): 6219-6226. DOI:10.1021/acs.jafc.8b01493.
[27] GE Ling, ZHAO Yu Sheng, MO Ting, et al. Immobilization of glucose oxidase in electrospun nanofibrous membranes for food preservation[J]. Food Control, 2012, 26(1): 188-193. DOI:10.1016/j.foodcont.2012.01.022.
[28] FABRA M J, LÓPEZ-RUBIO A, LAGARON J M. Use of the electrohydrodynamic process to develop active/bioactive bilayer films for food packaging applications[J]. Food Hydrocolloids, 2016, 55: 11-18. DOI:10.1016/j.foodhyd.2015.10.026.
[29] AYTAC Z, KESKIN N O S, TEKINAY T, et al. Antioxidant α-tocopherol/γ-cyclodextrin-inclusion complex encapsulated poly(lactic acid) electrospun nanofibrous web for food packaging[J].Journal of Applied Polymer Science, 2017, 134(21): 44858.DOI:10.1002/app.44858.
[30] LI Linlin, WANG Hualin, CHEN Minmin, et al. Butylated hydroxyanisole encapsulated in gelatin fiber mats: volatile release kinetics, functional effectiveness and application to strawberry preservation[J]. Food Chemistry, 2018, 269: 142-149. DOI:10.1016/j.foodchem.2018.06.150.
[31] FERNANDEZ A, TORRES-GINER S, LAGARON J M. Novel route to stabilization of bioactive antioxidants by encapsulation in electrospun fibers of zein prolamine[J]. Food Hydrocolloids, 2009,23(5): 1427-1432. DOI:10.1016/j.foodhyd.2008.10.011.
[32] ACEITUNO-MEDINA M, MENDOZA S, LAGARON J M, et al.Photoprotection of folic acid upon encapsulation in food-grade amaranth (Amaranthus hypochondriacus L.) protein isolate: pullulan electrospun fibers[J]. LWT-Food Science and Technology, 2015, 62(2):970-975. DOI:10.1016/j.lwt.2015.02.025.
[33] RUSSO G L. Dietary n-6 and n-3 polyunsaturated fatty acids: from biochemistry to clinical implications in cardiovascular prevention[J].Biochemical Pharmacology, 2009, 77(6): 937-946. DOI:10.1016/j.bcp.2008.10.020.
[34] MOOMAND K, LIM L T. Oxidative stability of encapsulated fish oil in electrospun zein fibres[J]. Food Research International, 2014, 62:523-532. DOI:10.1016/j.foodres.2014.03.054.
[35] MOOMAND K, LIM L T. Effects of solvent and n-3 rich fish oil on physicochemical properties of electrospun zein fibres[J]. Food Hydrocolloids, 2015, 46: 191-200. DOI:10.1016/j.foodhyd.2014.12.014.
[36] MOOMAND K, LIM L T. Properties of encapsulated fish oil in electrospun zein fibres under simulated in vitro conditions[J]. Food and Bioprocess Technology, 2015, 8(2): 431-444. DOI:10.1007/s11947-014-1414-7.
[37] GARCÍA-MORENO P J, STEPHANSEN K, VAN DER KRUIJS J, et al.Encapsulation of fish oil in nanofibers by emulsion electrospinning:physical characterization and oxidative stability[J]. Journal of Food Engineering, 2016, 183: 39-49. DOI:10.1016/j.jfoodeng.2016.03.015.
[38] YANG Huan, WEN Peng, FENG Kun, et al. Encapsulation of fish oil in a coaxial electrospun nanofibrous mat and its properties[J]. RSC Advances, 2017, 7(24): 14939-14946. DOI:10.1039/C7RA00051K.
[39] LÓPEZ-RUBIO A, SANCHEZ E, SANZ Y, et al. Encapsulation of living bifidobacteria in ultrathin PVOH electrospun fibers[J].Biomacromolecules, 2009, 10(10): 2823-2829. DOI:10.1021/bm900660b.
[40] AMNA T, HASSAN M S, PANDEYA D R, et al. Classy nonwovens based on animate L. gasseri-inanimate poly(vinyl alcohol): upstream application in food engineering[J]. Applied Microbiology and Biotechnology,2013, 97(10): 4523-4531. DOI:10.1007/s00253-012-4666-z.
[41] KOREHEI R, KADLA J F. Encapsulation of T4 bacteriophage in electrospun poly(ethylene oxide)/cellulose diacetate fibers[J].Carbohydrate Polymers, 2014, 100: 150-157. DOI:10.1016/j.carbpol.2013.03.079.
[42] HEUNIS T D J, BOTES M, DICKS L M T. Encapsulation of Lactobacillus plantarum 423 and its bacteriocin in nanofibers[J].Probiotics and Antimicrobial Proteins, 2010, 2(1): 46-51.DOI:10.1007/s12602-009-9024-9.
[43] FUNG W Y, YUEN K H, LIONG M T. Agrowaste-based nanofibers as a probiotic encapsulant: fabrication and characterization[J]. Journal of Agricultural and Food Chemistry, 2011, 59(15): 8140-8147.DOI:10.1021/jf2009342.
[44] LÓPEZ-RUBIO A, SANCHEZ E, WILKANOWICZ S, et al.Electrospinning as a useful technique for the encapsulation of living bifidobacteria in food hydrocolloids[J]. Food Hydrocolloids, 2012,28(1): 159-167. DOI:10.1016/j.foodhyd.2011.12.008.
[45] FENG K, ZHAI M Y, ZHANG Y, et al. Improved viability and thermal stability of the probiotics encapsulated in a novel electrospun fiber mat[J]. Journal of Agricultural and Food Chemistry, 2018,66(41): 10890-10897. DOI:10.1021/acs.jafc.8b02644.
[46] ZDARTA J, MEYER A, JESIONOWSKI T, et al. A general overview of support materials for enzyme immobilization: characteristics,properties, practical utility[J]. Catalysts, 2018, 8(2): 92. DOI:10.3390/catal8020092.
[47] SÓTI P L, WEISER D, VIGH T, et al. Electrospun polylactic acid and polyvinyl alcohol fibers as efficient and stable nanomaterials for immobilization of lipases[J]. Bioprocess and Biosystems Engineering,2016, 39(3): 449-459. DOI:10.1007/s00449-015-1528-y.
[48] CANBOLAT M F, SAVAS H B, GULTEKIN F. Improved catalytic activity by catalase immobilization using γ-cyclodextrin and electrospun PCL nanofibers[J]. Journal of Applied Polymer Science,2016, 134(4): 44404. DOI:10.1002/app.44404.
[49] HAGHJU S, BARI M R, KHALED-ABAD M A. Affecting parameters on fabrication of β-D-galactosidase immobilized chitosan/poly(vinyl alcohol) electrospun nanofibers[J]. Carbohydrate Polymers, 2018, 200:137-143. DOI:10.1016/j.carbpol.2018.07.096.
[50] HUANG Weijuan, ZHAN Yingfei, SHI Xiaowen, et al. Controllable immobilization of naringinase on electrospun cellulose acetate nanofibers and their application to juice debittering[J]. International Journal of Biological Macromolecules, 2017, 98: 630-636.DOI:10.1016/j.ijbiomac.2017.02.018.
[51] LEE J Y, KWAK H W, YUN H, et al. Methyl cellulose nanofibrous mat for lipase immobilization via cross-linked enzyme aggregates[J].Macromolecular Research, 2016, 24(3): 218-225. DOI:10.1007/s13233-016-4028-2.
[52] SRBOVÁ J, SLOVÁKOVÁ M, KŘÍPALOVÁ Z, et al. Covalent biofunctionalization of chitosan nanofibers with trypsin for high enzyme stability[J]. Reactive and Functional Polymers, 2016, 104: 38-44. DOI:10.1016/j.reactfunctpolym.2016.05.009.
[53] WONG D E, SENECAL K J, GODDARD J M. Immobilization of chymotrypsin on hierarchical nylon 6,6 nanofiber improves enzyme performance[J]. Colloids and Surfaces B: Biointerfaces, 2017, 154:270-278. DOI:10.1016/j.colsurfb.2017.03.033.
[54] HUANG Wencan, WANG Wei, XUE Changhu, et al. Effective enzyme immobilization onto a magnetic chitin nanofiber composite[J].ACS Sustainable Chemistry & Engineering, 2018, 6(7): 8118-8124.DOI:10.1021/acssuschemeng.8b01150.
[55] HUANG Xiaojun, CHEN Pengcheng, HUANG Fu, et al.Immobilization of Candida rugosa lipase on electrospun cellulose nanofiber membrane[J]. Journal of Molecular Catalysis B: Enzymatic,2011, 70(3/4): 95-100. DOI:10.1016/j.molcatb.2011.02.010.