图1 席夫碱生成反应机制
Fig.1 Mechanism of the formation of schiff base
高贵贤,王稳航*
(天津科技大学 食品生物技术教育部工程研究中心,天津 300457)
摘 要:蛋白膜由于具有无毒害、可降解、绿色环保、可延长食品保质期、提供营养等优点,在可食膜研究领域具有重要地位。如何改善其相对较弱的机械强度以及某些不足的阻隔性能,是研究者长期以来一直关注并将持续关注的问题。本文首先阐述了蛋白膜的成膜机制、性能指标,接着重点对基于分子交联的蛋白膜性能改良技术,包括物理交联、化学交联、酶法交联以及物理能交联等进行综述,最后对蛋白膜交联的意义和发展趋势进行了展望。
关键词:可食膜;蛋白膜;分子交联;性能改良
蛋白膜作为可食膜的重要一员,在可降解/可食包装中发挥着重要作用。最初成功商业化的胶原蛋白肠衣就是一种代表性的蛋白膜。20世纪20年代,德国那图林公司开发研制成第一例商业化胶原蛋白肠衣,该肠衣厚度均匀、强度高、原料成本低、氨基酸种类丰富、营养价值高,是一种安全、环保、健康的食用产品,并在美国、英国等发达国家得到广泛生产和使用[1]。随后,更多的以蛋白质或其他大分子如多糖、脂质为基质的可食膜材料得到了充分的开发和利用。
近年来,随着石化产品造成的环境危害以及人们对食品安全的关注,可食膜重新又成为人们的研究热点。蛋白膜因具有良好的可食性、生物可降解性、强透明性、较高阻气性等特点,且营养、外观、口感都较理想,被广泛应用于食品包装、医药、化妆品等行业。蛋白膜的基质材料主要来自植物分离蛋白和动物分离蛋白,其中植物分离蛋白中的大豆分离蛋白(soy protein isolate,SPI)、玉米醇溶蛋白和小麦面筋蛋白,动物分离蛋白中的乳清蛋白、明胶蛋白和酪蛋白都具有较好的成膜特性[2]。但是,与石化产品相比,用天然蛋白质制备的可食用膜在某些特性上存在一定的缺陷,如阻水性较差、环境湿度大时阻氧性变差、机械性能不足等,这些缺陷制约了蛋白质可食膜在食品工业中的应用。
以往关于蛋白膜的综述主要集中在研究成膜材料、制备工艺、与其他材料复合应用等方面[2-4]。鉴于交联在蛋白膜性能改良中的重要作用,本文对近年来国内外对蛋白膜性能改良的方法手段,重点针对于蛋白分子的共价交联与弱键交联,包括物理交联、化学交联、酶法交联以及物理能交联等进行综述。本文中仅涉及以蛋白质基质膜的改良,添加其他大分子如多糖、脂类与蛋白膜形成复合膜,以达到可食膜性能提升的内容,不在此综述内容之内。
可食膜是指通过包裹、浸渍、涂布、喷洒等方法将具有一定黏度的以生物大分子为主要溶剂的溶液或胶质覆盖在食品表面或多组分食品内部界面上形成的一层保护膜。根据不同的蛋白质类型和应用,成膜方法可以分为挤压成膜、浇铸成膜、喷雾或涂布成膜等[5]。自然状态下,蛋白质依靠分子中氢键、离子键、二硫键和疏水性相互作用、偶极相互作用等维持其稳定结构。在不同外界条件下,如热、碱、酸和盐处理等,蛋白质分子变性,三维空间结构展开,亚基解离,原来埋藏在分子内部的部分疏水基团、巯基和二硫键等暴露出来。在脱除溶剂(一般为水)的过程中,干燥条件能改变蛋白质结构并影响最终所成膜的性能,从这个意义上说,温度是影响蛋白质变性的重要因素[6]。蛋白质的构造和热稳定性依赖于氨基酸的组成,干燥过程中,当水分逐渐失去,蛋白构象发生改变,蛋白质的展开程度决定了蛋白链间相互作用的共价键(二硫键)或非共价键(疏水作用、离子键和氢键)的类型和比例。蛋白变性后,链间反应变得更容易、更强烈,特别是二硫键的反应[7]。这些链间反应使分子间相互作用不断加强,聚合形成致密的立体网络结构,最终可以得到具有一定阻隔性能和机械强度的蛋白膜。蛋白质分子的适度变性是成膜的先决条件,形成立体网络结构的优劣将影响膜的性能。因此,为了改善膜的性能,应当强化分子间的作用力,促使其形成更致密均匀的网络结构[8]。
2.1 机械性能
包装材料必须有足够的机械强度来保证食品在运输和贮藏过程中的完整性。蛋白膜的机械性能主要通过抗拉强度(tensile strength,TS)、断裂延伸率(elongation at break,E)、穿刺强度(puncture strength,PS)等指标来衡量[3]。TS是指膜材料在纯拉伸力作用下不致断裂时所能承受的最大拉力与受拉伸膜的横截面积的比值;E是指当进行断裂拉伸实验时,膜材料断裂时膜长度增加的百分率,该值用来衡量膜材料在未断裂前的延伸能力;PS是指用专用实验针刺穿膜材料时所需的力,它反映膜材料抵抗钝物穿透的能力[9]。通常情况下,蛋白膜的特殊结构使得其机械特性比糖膜、脂膜要好,同时不同蛋白膜的机械性能也差距较大,在相同处理条件下,乳清分离蛋白(whey protein isolate,WPI)膜的机械性能普遍好于大豆分离蛋白膜与胶原蛋白膜[3]。
2.2 阻隔性能
2.2.1 阻水性
阻水性是衡量膜性能的一项重要指标,通常以蛋白膜的水溶性、水蒸气透过性(water vapor permeability,WVP)、疏水性等来衡量[10]。水溶性主要指膜材料充分溶于水后与溶解前质量的百分比;WVP是指在规定的实验条件下,实验达到平衡时单位时间内,由试样两侧单位水蒸气压引起的,单位厚度的样品在单位面积上透过的水蒸气量,透过方向垂直于膜材料表面[10];疏水性用水滴与膜的接触角表示,接触角越大说明膜的疏水性越大。一般情况下,蛋白膜具有高度亲水性,在高相对湿度条件下会吸收大量的水,导致膜的机械性能减弱,WVP增加。
2.2.2 阻气性
阻气性是衡量膜性能的另一个重要指标。通常用压差法[11]进行气体透过率测试,来检测膜材料对常见的无机气体的阻隔性能。蛋白膜对O2的阻隔性高,有利于防止食品的氧化变质;对N2和CO2的阻隔性高则有利于食品的充气包装。蛋白膜的阻气性通常好于多糖基质膜,同时不同蛋白膜的阻气性差别较大,大豆分离蛋白膜阻隔性较好,尤其阻氧性比玉米蛋白膜和面筋蛋白膜高很多。
蛋白膜的性能与其分子结构紧密相关,蛋白质的结晶度、表面电荷、等电点,分子内的氨基酸组成、分子大小和三维结构,共价键(巯基(—SH)和二硫键(S—S))和非共价键(离子键、范德华力和氢键)以及非极性基团间的疏水作用都能影响所成膜的特性[12]。通过不同的方法改变分子结构能改变膜的性能,为进行有效的分子交联提供了更多可能。
交联是支链型或线型高分子链间以共价键连接成体型或网状高分子的过程。通过物理、化学、酶、物理能等交联方法能使蛋白网络结构获得更强的分子间共价键连接,更紧密的分子堆积,并能降低聚合物的流动性。研究分子交联成为提高蛋白膜的机械性能和阻隔性能的一种可行方法。
3.1 物理交联
3.1.1 温度变性
温度是影响膜特性的重要因素,大多数蛋白质处于高温条件下会发生变性,分子形状由球形变成线性。加热破坏了分子内的氢键和疏水的非极性基团,分子内部的巯基和疏水性的氨基酸侧链残基在溶剂中暴露在分子表面,产生一个开放的结构,加强了蛋白分子内或分子间的相互作用,使交联度增加,从而得到坚固致密的网络结构[2]。蛋白质的展开和变性程度取决于不同的加热时间和加热温度,不同程度的热处理影响蛋白质的交联强度,从而影响蛋白网络结构和所成膜的特性。
Guckian等[13]使用加热与未加热的WPI混合成膜,发现当加热处理的WPI比例减少时,膜的TS降低,溶解性上升,WVP变化不明显。Stuchell等[14]比较了用SPI溶液和热处理到85 ℃的SPI溶液制得的膜的性能,结果表明经过热处理的SPI膜有较低的WVP,较高的TS和E,比未加热的SPI膜更光滑透明。Molinaro等[15]利用响应面分析法确定不同温度、时间、压力作用下处理猪皮明胶蛋白成膜液来改善膜性能的最佳条件,发现当压力600 MPa、温度20.5 ℃条件下保温30 min时所得膜的机械性能、热稳定性、阻水性等与未处理的对照组相比都有所提高,其中阻隔性能的改善尤为明显。
3.1.2 pH值影响
pH值影响蛋白质的结构与功能,与蛋白溶解性、分子间构象以及分子间相互作用有关。pH值较高的环境下,蛋白分子相较其等电点带负电荷,pH值较低时带正电荷;当pH值被调整离开等电点时,蛋白分子间会发生静电斥力,导致蛋白质的溶解度增加,当处在等电点时,蛋白分子不带电荷,会导致蛋白在溶液中聚合和沉淀。蛋白质成膜时的pH值对膜极其重要,碱性条件下所成膜的机械性能和阻隔性能普遍好于酸性条件,碱性条件下蛋白分子适度变性伸展,内部基团暴露,分子产生巯基和二硫键间的反应,增强了膜的交联性,促进坚固网络结构的形成,最终使膜的拉伸性能增强[2]。
Mauri等[16]研究了SPI在不同pH值(2、8和11)条件下所成膜的溶解性和蛋白分子特性的改变,发现蛋白在pH值为8条件下保留了其天然构象,溶解度最高;在pH值为11和2的条件下蛋白发生部分或广泛的变性,pH值为2时膜的溶解度最低。不同pH值处理使蛋白网络结构产生差异,并影响了膜的机械性能和阻隔性能。Brandenburg等[17]研究了SPI膜在pH值为6~12时的特性,发现pH值为6时SPI膜的透氧性较高,阻湿性较差,TS和E值低;高pH值时膜的透氧性低,WVP值低,TS和E值较高,且膜外观随着pH值升高有所改善。
3.1.3 疏水作用
蛋白质结构稳定很大程度上依赖于分子内疏水作用,蛋白质分子由内到外亲水残基增多,疏水残基减少[18]。蛋白质成膜后表面的亲水残基暴露使膜具有了高度亲水性,从而失去了有效的阻湿屏障,在制膜过程中加入疏水性材料(脂类、蜡)或将疏水材料涂布于膜表面能有效地改善膜的阻湿性能。
Sohail等[19]在酪蛋白成膜液中加入蜡制膜和将蜡涂布在纯的酪蛋白膜上,比较两种方法制得的膜的性能,发现前一种膜相比后一种膜的TS大幅下降,E大幅上升,说明将蜡加入膜基质中可增加塑化效果,但涂蜡制得的膜具有更低的WVP。与蜡分子结合引起蛋白质结构的破坏,增加了膜表面自由空间的数量,在蛋白质和蜡界面形成非均匀的疏水性矩阵,改善了膜的阻湿性。Jongjareonrak等[20]在鱼皮明胶蛋白膜中加入蔗糖脂肪酸酯,并与加入相同含量的脂肪酸的膜相比,发现加入蔗糖脂肪酸酯的膜具有更低的WVP。蔗糖脂肪酸酯具有亲水性和疏水性的双重性质,因此可以轻易分散,并与蛋白分子的亲水头基形成氢键来完成与蛋白链的交联作用,从而改变膜的阻湿性。
3.1.4 异源分子作用
异源分子作用主要是指利用不同来源的大分子或小分子物质促进蛋白质的交联。大分子物质(多糖、脂质)与蛋白质之间,由于表面电荷、空间缠绕等相互作用而交联;小分子物质(甘油、乙二醇、聚乙二醇、山梨醇等多元醇增塑剂)更容易纳入蛋白质基质,在蛋白大分子之间具有一定的移动性,而且通过羟基与蛋白分子结合形成高分子材料,能够增加蛋白膜材料的黏弹性和柔韧性,使膜表现出更充分的塑化效果,提高膜材料的加工性能[21]。
佟颖等[22]研究了多糖类物质对谷朊粉(wheat gluten,WG)蛋白膜及性能的影响,发现添加多糖类物质显著提高了WG蛋白膜的透光率、机械性、阻水性和阻氧性,多糖物质的适宜添加量为0.03~0.05 g/g WG。其中果胶和壳聚糖对WG蛋白膜性能的影响较大。果胶添加量为0.04 g/g WG时可使膜的WVP下降12.75%,阻氧性、TS和E分别提高了18.54%、20.31%和30.63%。Wu Leiyan等[23]研究了不同种类的增塑剂(甘油、油酸和聚乙二醇)和增塑剂的用量对玉米醇溶蛋白膜的表面特征和机械性能的影响,发现蛋白膜的微观结构和吸水性依赖于亲水性或疏水性增塑剂的使用,用油酸和聚乙二醇增塑的膜与水或酒精的接触角随着增塑剂用量的增加而增大,说明疏水性变大,用甘油增塑的膜表现出不同的微观结构;用聚乙二醇增塑的膜TS随着增塑剂用量的增加而减小,而E却急剧增加,用甘油和油酸增塑的膜E增加不明显。
3.2 化学交联
化学交联可发生于分子内亚基之间,也可发生于分子之间。作为一类重要化学修饰反应,蛋白质化学交联相比物理交联可以使所得的膜拥有更高的交联度,更好的机械性能和生物相容性。
3.2.1 醛法交联
图1 席夫碱生成反应机制
Fig.1 Mechanism of the formation of schiff base
蛋白多肽链侧链上的基团提供了蛋白膜化学改造的分子基础。利用甲醛、戊二醛(glutaraldehyde,GA)等醛类物质来交联蛋白膜,能提高膜的溶解性、机械性能以及耐热性[24]。醛基可以与蛋白的氨基之间交联形成席夫碱,形成稳定的化学结构(图1)。在所有醛类中GA与蛋白的结合量要比其他醛类高。其交联作用是不可逆的,有很强的的抗酸、抗碱和抗酶解能力。
Chiou等[25]研究了从阿拉斯加鳕鱼和鲑鱼中提取明胶蛋白制膜,用GA进行交联,并与哺乳动物(牛、猪)明胶薄膜的拉伸性、热稳定性、WVP,氧渗透性和生物降解性能进行了比较。交联剂的加入对鱼明胶薄膜的拉伸性能和熔化温度的影响较小,却降低了鲑鱼明胶膜的WVP,增加了鳕鱼明胶膜的氧气透过性;鱼明胶膜的TS和E普遍低于哺乳动物明胶膜,但阻水性和阻氧性明显好于哺乳动物明胶膜,此外,鱼明胶薄膜的降解速率比哺乳动物明胶膜要快。林海莉等[26]研究了调整交联剂GA用量和在最佳使用量条件下交联过程中的搅拌时间对明胶膜的TS的影响。结果表明:成膜液总体积50 mL,GA的用量在2.5 mL(0.5%溶液)时,制得交联明胶膜的TS最大;随着搅拌时间的延长,膜的TS先增加后减小,搅拌时间为40 min时,TS最大。搅拌时间的延长,导致交联明胶中所含的酰胺基团减少,更多的氨基被释放出来,使得明胶分子自身的链缩短,TS有所下降。
通常醛类物质因具有毒性使所交联形成的膜安全性没有保障,制得的膜通常不具备可食性。因此希望有一种毒性低、形成稳定、生物相容性好的交联剂用于蛋白材料的交联,人们为了达到这种目的开发了一种新的交联剂京尼平(genipin,GP)[27]。GP能和胶原蛋白分子的赖氨酸、羟赖氨酸、精氨酸等残基的游离氨基反应,有效地提高了交联胶原的变性温度,同时GP交联胶原的生物相容性要明显优于GA交联的胶原。Bigi等[28]把GP加入胶原蛋白膜中,一个月后测得其机械性能和膨胀学性能与添加GA的蛋白膜的性能类似,但GP的毒性要比GA的小。
3.2.2 二硫键交联
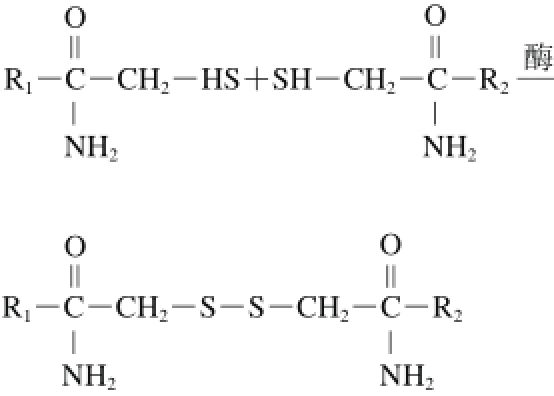
图2 二硫键交联反应机制
Fig.2 Mechanism of the cross-linking reaction of disulf i de bonds
二硫键是2 个S—H被氧化而形成的S—S形式的硫原子间的共价键,二硫键交联是在蛋白质交联中普遍存在并具有特征性的共价交联。蛋白质成膜过程中,为了修饰蛋白的三维结构,一般要通过热变性使巯基和疏水基团暴露出来[29],进而促进分子间二硫键形成和增强疏水作用力[30]。二硫键的形成主要是通过合适的氧化剂氧化蛋白质基质中相邻的两个半胱氨酸残基(图2),从而产生了二硫键交联[31]。二硫键交联形成的网络结构能有效地提高蛋白的结构特性,对制得的蛋白膜的性能有明显的改善。
李升锋等[32]研究了在WPI聚集时控制巯基或二硫键的可接近性,在成膜液中添加还原剂改善WPI所成膜的功能性,发现还原剂可打断分子中的二硫键,增多巯基含量,有 利于在随后的涂膜干燥过程中形成新的分子间二硫键,增强了膜的TS和阻隔性,但E有所下降。
Floris等[33]在研究WPI溶解性时提出,溶解度与蛋白骨架构建之间键合成二硫键网络结构的连续性以及二硫键的重排动力学行为有关,而二硫键的生成是通过—SH/S—S的交换反应。
3.3 酶法交联
酶具有反应条件温和、无毒害、催化高效的特点,利用酶进行蛋白交联可以改善所成膜的特性。目前用于交联的酶主要有谷氨酰胺转氨酶(transglutaminase,TG)、多酚氧化酶(polyphenol oxidase,PPO)、过氧化物酶(peroxidase,POD)等。
3.3.1 谷氨酰胺转氨酶
TG能催化转酰胺基反应,形成ε-(γ-谷氨酰胺基)赖氨酸键的交联,使蛋白质或多肽之间发生共价交联形成共价化合物,形成分子内或分子间的网状结构,进而改善蛋白质的结构和功能[35]。TG可通过氨基的导入、交联及脱氨基3 种途径改性蛋白质(图3)。

图3 TG催化反应机制[[3344]]
Fig.3 Mechanism of the catalytic reaction of TG[34]
胡坤等[36]研究了微生物TG对SPI膜拉伸性能的影响,发现在50 ℃时TG对SPI催化聚合反应60 min,SPI膜的TS和杨氏模量分别比未处理的膜增加了5.5 MPa和24.7 MPa,同时蛋白质的变性温度、热焓值都有所增加;酶处理时间为90 min时,由于TG变性失活及SPI的部分变性,膜的拉伸性能下降。Oh等[37]研究了用TG交联的WPI和酪蛋白膜的性能,发现交联后两种膜的TS和WVP均低于未经处理的膜;虽然差异不明显,但经TG交联的膜的E也比未经处理的膜有所提高。这结果与Yildrim等[38]研究的结果相矛盾,这些差异可能是由于这两个研究用的膜的组成成分和制膜程序不同所导致的。Chambi等[39]研究了TG交联酪蛋白和明胶蛋白制备共混可食膜,发现交联不同比例的共混膜都有很高的E值,只有当酪蛋白和明胶浓度比为75∶25时用TG催化交联可食膜,才观察到膜延展性能的大幅提高,透水性的显著降低。
3.3.2 多酚氧化酶
PPO是一类含铜的氧化还原酶,广泛存在于各种动物、植物和微生物中。PPO可以催化蛋白质分子中的酪氨酸残基以及与蛋白质通过非肽键相连的酚类化合物氧化,引起蛋白质交联[34]。利用PPO修饰蛋白质可用来改变蛋白膜的功能特性。
Takasaki等[40]研究发现蘑菇PPO与小麦醇溶蛋白氧化聚合,催化酪氨酸残基和半胱氨酰残基间形成蛋白结合,发生分子内和分子间的交联,由此方法制得的膜具有良好的机械性能。
3.3.3 过氧化物酶
POD是由微生物或植物所产生的一类氧化还原酶,是以过氧化氢为电子受体催化底物氧化的酶,可以催化蛋白发生交联反应。POD可氧化酪氨酸残基,在蛋白质中形成分子间和分子内的二酪氨酸和三酪氨酸结构,从而使蛋白发生交联作用[41]。
Stuchell等[14]研究了辣根POD对SPI膜的影响。结果表明,经过酶交联处理的膜相比未处理的膜阻湿性没有明显的改善,虽然弹性模量值增大,但膜仍然脆弱易断裂。凝胶电泳显示,酶诱导交联蛋白质的同时,也使一些蛋白链发生降解。
3.4 物理能交联
3.4.1 光诱导
光诱导交联是高分子化合物光化反应的一种。化合物受光照射后发生光解作用,或者键的一部分开键时,生成的游离基等活化分子互相键合而导致高分子链形成网状结构的反应。光诱导交联可能涉及蛋白质的多个变化,如蛋白质变性(高级分子结构的改变),分子内或分子间形成因氧化形成的共价键。包括单独光照射、添加光敏物质等。
紫外照射是一种改善蛋白质膜性能的方式,蛋白质中含有芳香类氨基酸(酪氨酸、苯丙氨酸和色氨酸),氨基酸内的双键和芳香环吸收紫外光后形成游离基,进而形成分子间的共价键交联[42]。Ustunol等[24]用紫外照射法改善WPI膜的性能,发现膜的机械性能显著提高,并且紫外辐射对膜自身良好的透光性没有影响。莫文敏[43]用紫外线照射处理SPI膜,发现辐照处理后分子的结晶度和膜的致密性有所提高,从而膜的强度和阻隔性能有所改善。紫外线处理使SPI中部分氨基酸重新排列、组合,发生分子交联反应,强化了膜的空间网络结构,使膜的TS大幅增强,但膜的阻湿性没有显著改善。
Wihodo等[44]利用脉冲光(pulsed light,PL)来改善酪蛋白膜的力学性能和阻隔性能,PL由强烈的、持续时间短的广谱PL构成,范围从紫外到近红外。在相对湿度53%的条件下,用15 个PL(23.5 J/cm2)照 射膜的两面,膜的TS提高了31.6%,E增加了90%。扫描电子显微镜分析表明,12 个PL照射膜两面时增加了膜的表面光洁度和均匀性,当提高光照强度后,造成膜的表面开裂。同时,他们还利用聚乙二醇400作为光引发剂结合酪蛋白膜,进行PL处理后发现,膜的机械性能显著提高。
3.4.2 辐射
电离辐射可引起蛋白质的构象变化,如氨基酸的氧化、共价键断裂,游离基 团的形成以及重组和聚合反应。由于蛋白质性质和辐照剂量的不同,辐照固体状态蛋白质的结果是引起交联或是蛋白分子降解[3]。
Micard等[45]研究了X射线辐射对小麦面筋蛋白膜性能的影响,发现辐照剂量10 kGy时,膜的WVP和TS有所升高、E值降低,当分别用20 kGy和40 kGy的较高辐射剂量时,膜的性能变化不明显。Lacroix等[46]对SPI、WPI以及酪蛋白混合体系经过γ射线辐照处理后制膜并观测膜的性能,发现辐照后显著提高了膜的机械性能却降低了膜的WVP值。
3.4.3 高压处理
高压处理(100~1 000 MPa)是已知的改善营养大分子功能特性的有效方法。特别在处理蛋白质时,不同压力水平的变化导致多肽不同程度的聚集和解离,从而使蛋白质产生不同程度的变性,改变了蛋白质的表面疏水性和溶解度[47]。高压处理影响球状蛋白结构的研究已经在大豆蛋白、小麦蛋白和WPI等方面开展,这些修饰蛋白的功能特性如发泡性、乳化性、凝胶性都有了显著提高。
Condés等[48]在制备苋菜蛋白可食膜过程中利用不同强度的高压处理成膜液,观察膜性能的变化,发现经高压处理的蛋白分散系比未处理的形成了更均匀、机械性能更强、水溶性和WVP更低的膜,并且膜的厚度、颜色和含水量没发生改变,但膜的透光性有所降低。高压处理使蛋白质结构改变,促进蛋白分子展开,增加了表面疏水性和自由的巯基量,形成更紧致的交联结构从而得到更高性能的膜。
应用于食品包装的理想的蛋白膜应当具有机械强度高、弹性好、阻湿性好、透气性低、无污染并可降解的性能特点。过去几十年人们已经做了大量的工作来提高蛋白膜的性能,其中有关蛋白分子交联的技术包括热处理,改变pH值,添加脂质和塑化剂,利 用化学法、酶法、辐射法、高压、超声处理引起蛋白质交联等。在蛋白质中引入交联键能有效地改善蛋白质的功能特性,同时有些交联方法如化学交联,通常会有破坏性的副反应发生,交联剂使用不当或交联条件控制不好也会破坏膜的结构,但总的来说,蛋白交联改造和提高了其所成膜的组织结构和功能性质。
虽然一些研究表明蛋白膜的许多功能特性仍然不如化工合成膜,但也提出了提高蛋白膜机械性能和阻隔性能的诸多方法。随着包装工业的发展和人们对环境保护、食品安全意识的提高,未来可食蛋白膜的开发利用将具有深远的意义。首先,新技术的发展允许基于分子水平的操作,为新材料如生物聚合膜的制造提供了技术支持;同时,纳米复合材料(微纤化纤维素、纳米二氧化钛、蒙脱土等)正开始应用于可食膜中来改善膜的特性。其次,研究更多物理和生物酶的改性方法,减少化学交联剂的使用有利于获得更健康安全的包装可食膜;制膜过程中添加天然防腐物质和活性功能物质开发具有抑菌、防腐甚至保健功能的可食膜。第三,可食膜既可作为包装材料,又可以食用,在提高包装性能的同时也应注重可食膜食品属性的开发。最后,提高制膜技术和工艺,利用不同分子交联方法使膜的性能指标达到甚至超过石化材料,加快可食膜工业化生产进程和推广应用也是未来可食膜发展的方向。
参考文献:
[1] HARPER B A, BARBUT S, LIM L T, et al. Microstructural and textural investigation of various manufactured collagen sausage casings[J]. Food Research International, 2012, 49(1): 494-500. DOI:10.1016/j.foodres.2012.07.043.
[2] 杨坤, 陈树兴, 赵胜娟, 等. 可食性蛋白膜研究进展[J]. 食品研究与开发, 2009, 30(7): 174-178. DOI:10.3969/j.issn.1005-6521.2009.07.050.
[3] WIHODO M, MORARU C I. Physical and chemical methods used to enhance the structure and mechanical properties of protein films: a review[J]. Journal of Food Engineering, 2013, 114(3): 292-302. DOI:10.1016/j.jfoodeng.2012.08.021.
[4] 贾祥祥, 郭兴凤. 可食性蛋白膜研究进展[J]. 粮食与油脂, 2011(1): 5-8. DOI:10.3969/j.issn.1008-9578.2011.01.002.
[5] 姜燕, 马中苏, 张海悦, 等. 蛋白质基可食性生物聚合膜的研究进展[J]. 食品研究与开发, 2011, 32(11): 168-172. DOI:10.3969/ j.issn.1005-6521.2011.11.047.
[6] DENAVI G, TAPIA-BLÁCIDO D R, AÑÓN M C, et al. Effects of drying conditions on some physical properties of soy protein fi lms[J]. Journal of Food Engineering, 2009, 90(3): 341-349. DOI:10.1016/ j.jfoodeng.2008.07.001.
[7] MAURI A N, AÑÓN M C. Effect of solution pH on solubility and some structural properties of soybean protein isolate fi lms[J]. Journal of the Science of Food and Agriculture, 2006, 86(7): 1064-1072. DOI:10.1002/jsfa.2457.
[8] KUNTE L A, GENNADIOS A, CUPPETT S L, et al. Cast fi lms from soy protein isolates and fractions[J]. Cereal Chemistry, 1997, 74(2): 115-118. DOI:10.1094/CCHEM.1997.74.2.115.
[9] WANG L Z, LIU L, HOLMES J, et al. Assessment of film-forming potential and properties of protein and polysaccharide-based biopolymer films[J]. International Journal of Food Science & Technology, 2007, 42(9): 1128-1138. DOI:10.1007/s00217-005-0151-6.
[10] American Society for Testing and Materials. Standard test methods for water vapor transmission of materials[S]. United States: ASTM International, 2006: 5-7.
[11] American Society for Testing and Materials. Standard test method for determining gas permeablity characteristics of plastic film and sheeting[S]. United States: ASTM International, 2003: 3-4.
[12] 王耀松. 共价交联对WPI成膜的影响及作用机理[D]. 无锡: 江南大学, 2012: 1-9.
[13] GUCKIAN S, DWYER C, O'SULLIVAN M, et al. Properties of and mechanisms of protein interactions in films formed from different proportions of heated and unheated whey protein solutions[J]. European Food Research and Technology, 2006, 223(1): 91-95. DOI:10.1007/s00217-005-0140-9.
[14] STUCHELL Y M, KROCHTA J M. Enzymatic treatments and thermal effects on edible soy protein fi lms[J]. Journal of Food Science, 2006, 59(6): 1332-1337. DOI:10.1111/j.1365-2621.1994.tb14709.x.
[15] MOLINARO S, CRUZ-ROMERO M, SENSIDONI A, et al. Combination of high-pressure treatment, mild heating and holding time effects as a means of improving the barrier properties of gelatin-based packaging fi lms using response surface modeling[J]. Innovative Food Science & Emerging Technologies, 2015, 30: 15-23. DOI:10.1016/ j.ifset.2015.05.005.
[16] MAURI A N, AÑÓN M C. Effect of solution pH on solubility and some structural properties of soybean protein isolate fi lms[J]. Journal of the Science of Food and Agriculture, 2006, 86(7): 1064-1072. DOI:10.1002/jsfa.2457.
[17] BRANDENBURG A H, WELLER C L, TESTIN R F. Edible films and coatings from soy protein[J]. Journal of Food Science, 1993, 58(5): 1086-1089. DOI:10.1111/j.1365-2621.1993.tb06120.x.
[18] 王克夷. 疏水作用和蛋白质[J]. 生命的化学, 1999, 19(5): 233-235. DOI:10.3969/j.issn.1000-1336.1999.05.011.
[19] SOHAIL S S, WANG B, BISWAS M A S, et al. Physical, morphological, and barrier properties of edible casein fi lms with wax applications[J]. Journal of Food Science, 2006, 71(4): C255-C259. DOI:10.1111/j.1750-3841.2006.00006.x.
[20] JONGJAREONRAK A, BENJAKUL S, VISESSANGUAN W, et al. Fatty acids and their sucrose esters affect the properties of fi sh skin gelatin-based fi lm[J]. European Food Research & Technology, 2006, 222(5/6): 650-657. DOI:10.1007/s00217-005-0151-6.
[21] 张平安, 艾志录, 张建威. 增塑剂对小麦面筋蛋白膜机械性能的影响[J]. 粮油加工, 2009(10): 165-167.
[22] 佟颖, 张春红, 常南, 等. 多糖类物质对谷朊粉蛋白膜性能的影响[J].食品工业, 2012, 33(9): 105-108.
[23] WU Leiyan, WEN Qibiao, YANG Xiaoquan. Effect of plasticizer on surface and mechanical properties of zein films[J]. Journal of the Chemical Industry & Engineering Society of China, 2010, 61(1): 137-145. [24] USTUNOL Z, MERT B. Water solubility, mechanical, barrier, and thermal properties of cross-linked whey protein isolate-based fi lms[J]. Journal of Food Science, 2006, 69(3): FEP129-FEP133. DOI:10.1111/ j.1365-2621.2004.tb13365.x.
[25] CHIOU B S, AVENA-BUSTILLOS R J, BECHTEL P J, et al. Cold water fish gelatin films: effects of cross-linking on thermal, mechanical, barrier, and biodegradation properties[J]. European Polymer Journal, 2008, 44(11): 3748-3753. DOI:10.1016/ j.eurpolymj.2008.08.011.
[26] 林海莉, 曹静, 李艳. 戊二醛交联明胶膜的制备与性能研究[J]. 化学工程与装备, 2010(6): 56-58. DOI:10.3969/ j.issn.1003-0735.2010.06.020.
[27] YOO J S, KIM Y J, KIM S H, et al. Study on genipin: a new alternative natural cross-linking agent for fi xing heterograft tissue[J]. Korean Journal of Thoracic and Cardiovascular Surgery, 2011, 44(3): 197-207. DOI:10.5090/kjtcs.2011.44.3.197.
[28] BIGI A, COJAZZI G S, ROVERI N, et al. Stabilization of gelatin films by cross-linking with genipin[J]. Biomaterials, 2002, 23(24): 4827-4832. DOI:10.1006/excr.1997.3810.
[29] SHIMADA K, CHEFTEL J C. Sulfhydryl group/disulfide bond interchange reactions during heat-induced gelation of whey protein isolate[J]. Journal of Agricultural and Food Chemistry, 2002, 37(1): 161-168. DOI:10.1021/jf00085a038.
[30] KOKOSZKA S, DEBEAUFORT F, LENART A, et al. Liquid and vapour water transfer through whey protein/lipid emulsion films[J]. Journal of the Science of Food and Agriculture, 2010, 90(10): 1673-1680. DOI:10.1002/jsfa.4001.
[31] 李君文, 赵新淮. 食品中的蛋白质交联技术[J]. 食品工业科技, 2011, 32(1): 380-384.
[32] 李升锋, 曾庆孝. 改善大豆分离蛋白膜性能的研究进展[J]. 郑州轻工业学院学报(自然科学版), 2001, 16(3): 56-60. DOI:10.3969/ j.issn.1004-1478.2001.03.016.
[33] FLORIS R, BODNÁR I, WEINBRECK F, et al. Dynamic rearrangement of disulfide bridges influences solubility of whey protein coatings[J]. International Dairy Journal, 2008, 18(5): 566-573. DOI:10.1016/j.idairyj.2007.10.013.
[34] 吴进菊, 汤尚文, 黄升谋, 等. 酶法交联对食物蛋白的改性作用研究进展[J]. 食品工业科技, 2011, 32(11): 511-513.
[35] KIELISZEK M, MISIEWICZ A. Microbial transglutaminase and its application in the food industry. a review[J]. Folia Microbiologica, 2014, 59(3): 241-250. DOI:10.1007/s12223-013-0287-x.
[36] 胡坤, 萧兆荣, 陈学敬. 谷氨酰胺转氨酶对大豆分离蛋白塑料拉伸性能的影响[J]. 食品与发酵工业, 2008, 34(6): 6-10.
[37] OH J H, WANG B, FIELD P D, et al. Characteristics of edible films made from dairy proteins and zein hydrolysate cross-linked with transglutaminase[J]. International Journal of Food Science & Technology, 2004, 39(3): 287-294. DOI:10.1111/j.1365-2621.2004.00783.x.
[38] YILDIRIM M, HETTIARACHCHY N S. Properties of films produced by cross-linking whey proteins and 11S globulin using transglutaminase[J]. Journal of Food Science, 1998, 63(2): 248-252.
[39] CHAMBI H, GROSSO C. Edible films produced with gelatin and casein cross-linked with transglutaminase[J]. Food Research International, 2006, 39(4): 458-466. DOI:10.1016/ j.foodres.2005.09.009.
[40] TAKASAKI S, KAWAKISHI S, MURATA M, et al. Polymerisation of gliadin mediated by mushroom tyrosinase[J]. LWT-Food Science and Technology, 2001, 34(8): 507-512. DOI:10.1006/fstl.2001.0800.
[41] MATHEIS G, WHITAKER J R. Peroxidase-catalyzed cross linking of proteins[J]. Journal of Protein Chemistry, 1984, 3(1): 35-48.
[42] TOMIHATA K, BURCZAK K, SHIRAKI K, et al. Crosslinking and biodegradation of native and denatured collagen[M]//SHALABY S W, IKADA Y, LANGER R, et al. Polymers of biological and biomedical significance. Washington D C: American Chemical Society, 1994: 275-286.
[43] 莫文敏. 可食性大豆蛋白膜性能的强化和应用研究[D]. 广州: 华南理工大学, 2001: 26-33.
[44] WIHODO M, MORARU C I. Effect of pulsed light treatment on the functional properties of casein films[J]. LWT-Food Science and Technology, 2015, 64(2): 837-844. DOI:10.1016/j.lwt.2015.06.067.
[45] MICARD V, BELAMRI R, MOREL M, et al. Properties of chemically and physically treated wheat gluten fi lms[J]. Journal of Agricultural and Food Chemistry, 2000, 48(7): 2948-2953. DOI:10.1021/ jf0001785.
[46] LACROIX M, LE T C, OUATTARA B, et al. Use of γ-irradiation to produce fi lms from whey, casein and soya proteins: structure and functionals characteristics[J]. Radiation Physics and Chemistry, 2002, 63(3/4/5/6): 827-832. DOI:10.1016/S0969-806X(01)00574-6.
[47] SPERONI F, BEAUMAL V, LAMBALLERIE M D, et al. Gelation of soybean proteins induced by sequential high-pressure and thermal treatments[J]. Food Hydrocolloids, 2009, 23(5): 1433-1442. DOI:10.1016/j.foodhyd.2008.11.008.
[48] CONDÉS M C, AÑÓN M C, MAURI A N. Amaranth protein fi lms prepared with high-pressure treated proteins[J]. Journal of Food Engineering, 2015, 166: 38-44. DOI:10.1016/j.jfoodeng.2015.05.005.
Recent Progress in Technologies for the Improvement of Protein-Based Film Performance Based on Molecular Cross-Linking
GAO Guixian, WANG Wenhang*
(Engineering Research Center of Food Biotechnology, Ministry of Education, Tianjin University of Science and Technology, Tianjin 300457, China)
Abstract:Protein-based film has an important role in the field of edible film due to its characteristics of non-toxicity, biodegradability, green environmental protection, shelf life extension of foods, and nutrient supply. How to improve its relatively weak mechanical strength and insuff i cient barrier performance has always been and will be a problem of great concern for researchers. This article first reviews the formation mechanism and properties of protein-based film with emphasis on the existing technologies for the improvement of protein-based fi lm properties based on molecular cross-linking including physical cross-linking, chemical cross-linking, enzymatic cross-linking and physical energy-induced cross-linking. Finally, the signif i cance and development trend of cross-linking in protein-based fi lm are also proposed.
Key words:edible fi lm; protein-based fi lm; molecular cross-linking; performance improvement
DOI:10.7506/spkx1002-6630-201709044
中图分类号:TS206.4
文献标志码:A
文章编号:1002-6630(2017)09-0280-07
引文格式:
高贵贤, 王稳航. 基于分子交联的蛋白膜性能改良技术的研究进展[J]. 食品科学, 2017, 38(9): 280-286. DOI:10.7506/ spkx1002-6630-201709044. http://www.spkx.net.cn
GAO Guixian, WANG Wenhang. Recent progress in technologies for the improvement of protein-based fi lm performance based on molecular cross-linking[J]. Food Science, 2017, 38(9): 280-286. (in Chinese with English abstract)
DOI:10.7506/ spkx1002-6630-201709044. http://www.spkx.net.cn
收稿日期:2016-04-25
基金项目:国家高技术研究发展计划(863计划)项目(2013AA102204);食品生物技术教育部工程研究中心(天津科技大学)应用转化项目(SPZX004)
作者简介:高贵贤(1990—),男,硕士研究生,研究方向为动物源性食品加工与控制。E-mail:983557263@qq.com
*通信作者:王稳航(1977—),男,副研究员,博士,研究方向为动物源性食品加工与控制,食品大分子结构、性质与功能。E-mail:wangwenhang@tust.edu.cn