农产品中的真菌毒素污染严重。据联合国粮食及农业组织(Food and Agriculture Organization of the United Nations,FAO)统计,全球每年约有占总体25%(约10亿 t)的粮食遭受真菌毒素污染[1]。真菌毒素是由病原真菌产生的次级代谢产物,其种类多、结构和性质各异、毒性广泛。农产品中重点关注的真菌毒素主要有黄曲霉毒素(aflatoxin,AF)、赭曲霉毒素A(ochratoxins A,OTA)、链格孢霉毒素、展青霉素(patulin,PAT)、玉米赤霉烯酮(zearalenone,ZEA)、T-2毒素(trichothecenes,TS)、伏马毒素(fumonisins,FBs)等。这些毒素多具有神经毒、致癌、致突变、致畸、免疫抑制等毒性。近年来,农产品中真菌毒素污染严重影响了农产品质量安全和进出口贸易,许多国家都投入了大量的资源开展其检测技术、形成机理、消解规律、风险评估等研究。
果品是重要的农产品,也广泛受到真菌毒素的污染[2]。水果田间生产和采收、贮运、销售、加工等环节与谷物类农产品不尽相同,其真菌毒素的产生规律具有一定特殊性。真菌可轻易突破果皮的防御,并且水果含水量和水分活度高,理论上更利于真菌的增殖。果品中的真菌毒素主要有PAT、链格孢霉毒素、OTA和AF[3]。近年来,有关水果及果汁中PAT,苹果、梨等水果中链格孢霉毒素,葡萄和葡萄酒中OTA,以及干果和坚果中AF的研究报道较多,并在污染现状、产毒菌株、毒理学性质、生物合成途径等方面有新的进展[4-7]。本文综述了近年来果品中4 种常见的真菌毒素的产毒菌株、理化性质、污染情况、毒性毒理、产毒基因、合成途径、影响因素等方面的研究进展。
1 展青霉素
PAT又称棒曲霉素,是一种主要由扩展青霉产生的内酯类化合物。PAT主要由青霉属(Penicillium)和曲霉属(Aspergillus)产生,包括青霉,如扩展青霉(P. expansum)、展青霉(P. patulum)、产黄青霉(P. chrysogenum)、灰黄青霉(P. griseofulvum)和曲霉,如棒曲霉(A. Clavalus)、土曲霉(A. terreus)、巨曲霉(A. giganteus)等[8-11]。PAT分子式为C7H6O4,系统名为4-羟基-4H-呋[3,2-c]吡喃-2(6H)-酮,具有呋喃并吡喃杂环的内酯结构,溶于水、氯仿、丙酮、乙醇、乙酸乙酯等溶剂,在酸性环境下结构稳定,在碱性环境下不稳定,在276 nm波长处有特征紫外吸收[12]。
PAT主要污染水果及其制品,尤以苹果及其制品(特别是苹果浓缩汁)的相关研究报道最多,检出量可达数百µg/kg。其污染的水果主要有苹果、山楂、柑橘、猕猴桃、樱桃、蓝莓、香蕉、草莓、葡萄等,水果制品有苹果浓缩汁、山楂制品等[11,13-14]。PAT在受霉菌污染的苹果、山楂、柑橘果实,苹果浓缩汁及其饮料,苹果及山楂的固体制品中可不同程度检出[11,13-14]。例如,Sarubbi等[12]在共80 种苹果浆和番茄浆产品中检出PAT平均质量浓度为7.15 μg/L;Bonerba等[15]在欧洲12 家果汁公司生产的共105 种苹果浓缩汁、梨汁和混合果汁样品中检测到PAT阳性率为45%,其中苹果汁质量浓度范围为6~30 mg/L,梨汁为5~92 mg/L,混合果汁为1~45 mg/L。目前,许多国家主要针对苹果制品中规定了PAT的限量。世界卫生组织(World Health Organization,WHO)推荐苹果浓缩汁中PAT限量为50 μg/L[16]。美国食品药品监督管理局(Food and Drug Administration,FDA)规定以苹果、山楂原料制成的产品中PAT限量为50 μg/kg[4]。欧盟制定苹果汁及其他以苹果为原料的饮料中PAT限量为50 μg/kg,固体苹果制品中为25 μg/kg,以苹果为原料的婴幼儿食品中PAT限量为10 μg/kg[17]。我国GB 2761—2017《食品安全国家标准 食品中真菌毒素限量》[18]规定以苹果、山楂为原料制成的产品(包括果汁饮料类和酒类)中PAT限量为50 μg/kg。
PAT具有急性毒性、致癌性、免疫和生殖毒性等多种较复杂的毒性作用[19-20]。药物研发最初发现PAT具有与β-内酰胺类抗生素相似的药理活性,后续研究因其具有多种毒性而终止了药物开发[21]。PAT具有较强的急性毒性,在啮齿动物中的半数致死量(median lethal dose,LD50)为20~100 mg/kg,在家鸡中为50~170 mg/kg[11]。其急性毒性表现为胃肠道损伤、神经症状(抽搐)、肺充血和水肿,亚急性表现为体质量减轻、胃肠道变性、肾脏和神经充血水肿[4,11]。PAT的致癌强度存在争议,WHO认为PAT是较强的基因毒性物质;国际癌症研究机构(International Agency for Research on Cancer,IARC)认为PAT对人的致癌性尚无法定论,将其定义为对人类的可疑致癌物质[21]。PAT的致癌性在不同实验对象中差异较大,其致癌性、致染色体畸变和致基因突变性在大多数哺乳动物细胞系实验中能取得阳性结果,但在细菌实验中多为阴性结果。例如,PAT能导致小鼠淋巴瘤L5178Y细胞、V79细胞、FM3A细胞等多个细胞系染色体畸变和基因突变[4,22-23],但仅在少数细菌如酿酒酵母和枯草芽孢杆菌的Ames实验中表现出致突变性,在其他多种细菌实验中并无致突变或促进突变作用[4,24]。PAT化学结构中的内酰基基团是与毒性有关的基团,内酰胺键能竞争性地与某些体内活性物质或酶活性中心(如巯基)发生共价结合,继而干扰正常新陈代谢[4,25]。PAT还可结合谷胱甘肽(glutathione,GSH)上的活性巯基,导致细胞内GSH消耗和活性氧自由基浓度上升,从而产生毒性[26]。PAT还可通过交联、产生核质桥等机制影响微核形成,从而引起DNA结构性损伤[27]。
PAT基因簇包含多个编码PAT合成的结构基因和转录因子[4,28-29]。基因簇是存在于染色体上结构、功能相对独立的片段,由多个功能相关的基因和转录因子组成[4,28]。Artigot等[30]首先在棒曲霉和扩展青霉菌株中发现与PAT合成相关的基因簇。棒曲霉菌株中的PAT基因簇是一个全长为41 kb的DNA片段,包含多个PAT合成酶和辅助因子,该基因簇包含与PAT合成相关的重要基因,包括6-甲基水杨酸(6-methylsalicylic acid,6-MSA)合成酶基因PatK、3-甲基酚羟化酶的基因PatH或PatI、异戊醇氧化酶的基因PatN(idh基因)等[31-33]。目前发现有15 个参与毒素合成的基因(图1),其中,10 个基因编码参与PAT合成的反应酶,包括PatB、PatD、PatE、PatG、PatH、PatI、PatJ、PatK、PatO和PatN[4]。PatB、PatD、PatE 3 个基因编码葡萄糖-甲醇-胆碱(glucose-methanol-choline,GMC)氧化还原聚合酶;PatG编码6-MSA脱羧酶催化6-MSA脱去羧基生成3-甲基酚;PatH和PatI编码细胞色素(cytochrome,CYP)氧化酶催化3-甲基酚羟化生成相应的醇和醛;PatJ编码一个双加氧酶,功能暂未明确;PatK编码6-MSA合成酶催化丙二酰CoA和乙酰CoA反应生成6-MSA;PatO和PatN基因共同编码异戊醇氧化酶(isoepoxydon dehydrogenase,IDH)[4,34]。另外,4 个基因编码PAT合成过程的辅助因子,分别为PatL、PatM、PatC和PatA[4]。其中,PatL编码的转录因子的N端含有Zn(Ⅱ)2Cys6家族锌指结构的DNA结合结构域[35]。Zn(Ⅱ)2Cys6家族是真菌特有的一类转录因子,是真菌次级代谢物生物合成过程中重要的调控因子[36-37]。PatM、PatC和PatA是3 个编码转运子的基因[4,32]。暂未发现PatF基因的功能,可能与该基因簇的转录调控有关[4,32-33]。PAT经聚酮类代谢物合成途径,约经历10 步反应合成(图1)[4]。PAT合成反应主要可分为以下步骤:3 分子丙二酰CoA和1 分子乙酰CoA在6-MSA合成酶催化下生成6-MSA;6-MSA在6-MSA脱羧酶催化下脱去羧基生成3-甲基酚;3-甲基酚在CYP氧化酶CYP619C2和CYP619C3共同催化下完成两步氧化反应生成龙胆醇或2,5-二羟基苯甲醛;继而经环氧化反应最终生成PAT[4,33-34]。
PAT产生菌侵染是果品毒素残留的先决条件。新鲜水果中基本无PAT残留,但新鲜水果中多能分离得到青霉或曲霉等PAT产生菌[11,15]。PAT残留多与水果腐烂有一定关系,在扩展青霉引起的腐烂水果或腐烂部分的样品中PAT阳性率和检出浓度较高[11]。PAT对果汁及其制品污染的普遍性与果汁生产加工过程产毒真菌增殖有一定关系[11,38]。果汁生产过程,水果的组织结构遭到破坏而失去保护力,导致产毒真菌增殖和产生毒素[38]。近年来,有关果品PAT的形成机制和控制技术研究较多。不同产PAT真菌具有不同的产毒能力[10-11]。扩展青霉菌株在分离培养条件下具有较强的产毒能力,是苹果和苹果浓缩汁中主要的产毒菌[10-11]。在人工培养条件下,扩展青霉的产毒能力受多种因素影响,主要有培养基中N元素和Mn元素浓度、水分活度、pH值和培养环境的温度、紫外线等因素[39-41]。研究发现,在缺素培养基中增加N元素和Mn元素,PAT合成多种关键酶的表达量和PAT产量都相应增加[42];另外,温度、pH值、紫外线等也是影响PAT形成的因素[11,43]。苹果浓缩汁生产过程中PAT的控制包括多个环节[44]。由于病原真菌侵染果实可发生在水果田间生产和采后各环节,理论上原料果不可避免地带有产毒菌。因此,在原料准备阶段,应当控制果汁生产的原料果,尽量选择种植条件良好、无病害的原料果,尽量选择新鲜果,避免腐烂果、落地果。在果实贮藏阶段,温度、贮藏时间、气调等均会影响果实的PAT残留[45-46]。总体上贮藏温度越接近0 ℃,增加CO2浓度或降低O2浓度都对PAT产生抑制作用[47]。在苹果汁生产环节,PAT控制的关键点包括水洗、人工剔除腐烂果、防止原料腐烂、选择合适的澄清与吸附剂等[47]。另外,运用高能射线、活性炭处理、化学保护、巴氏杀菌、微生物降解等手段也可控制苹果汁中PAT的产生[43,48]。
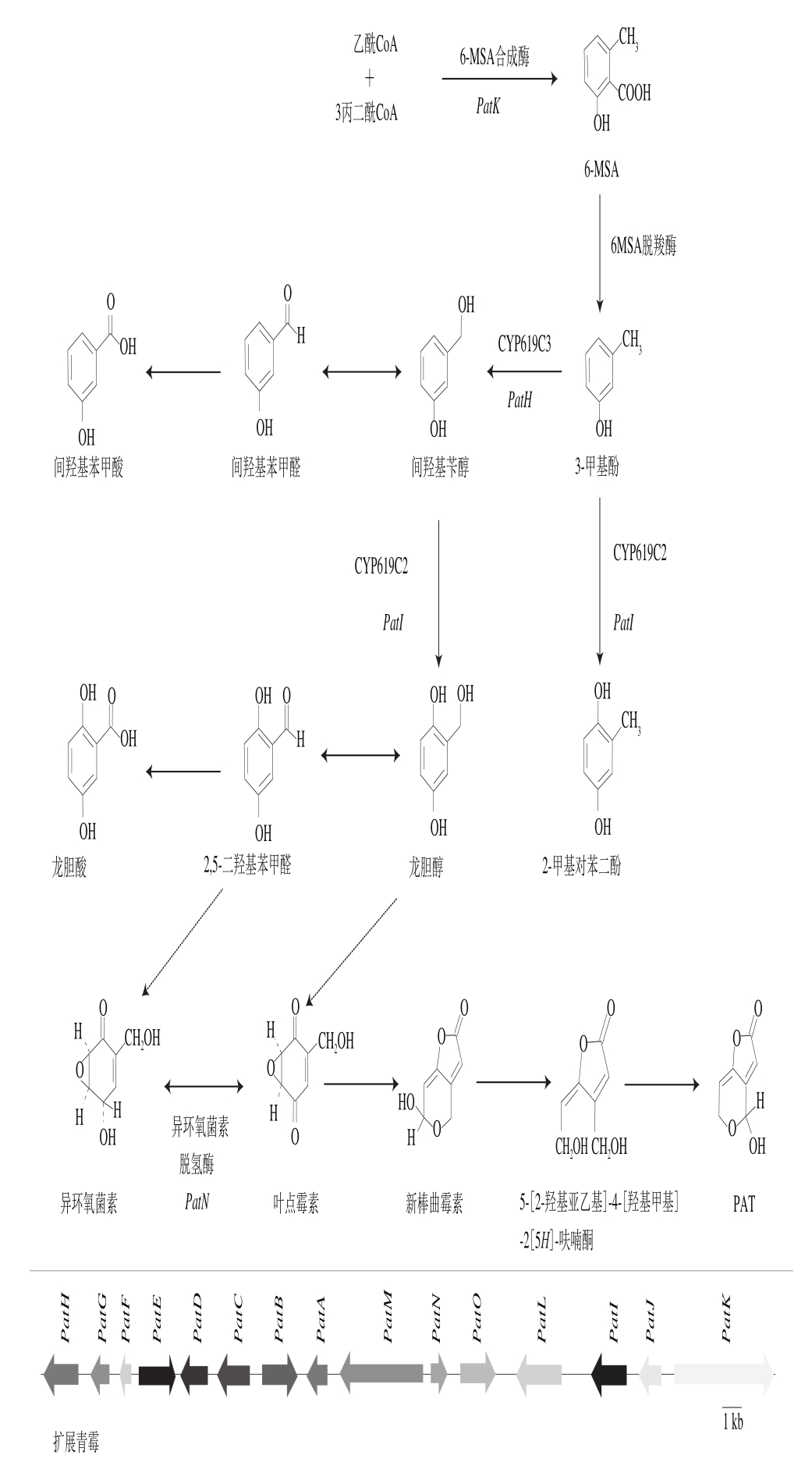
图1 PAT的合成途径和扩展青霉中的PAT合成基因簇[4]
Fig. 1 Biosynthetic pathway of patulin and clustered genes[4]
2 链格孢霉毒素
链格孢霉毒素是一类主要由链格孢霉产生的毒素。链格孢属的互交链格孢菌是主要侵染菌和产毒菌,可引起果蔬田间和采后病害,及毒素残留[8,49]。果品中链格孢霉毒素主要由链格孢属(Alternaria)产生,包括交链格孢(A. alternata)、柑橘链格孢(A. citri)、细交链格孢(A. tenuis)、茄链格孢(A. solani)和其他霉菌如稻梨孢(P. oryzae)、黄灰青霉(P. aurantiogriseum)、黄青霉(P. chrysogenum)等[50-51]。目前已分离鉴定的链格孢霉毒素超过30 种,关注和研究较多的包括细交链孢菌酮酸(tenuazonic acid,TeA)、互隔交链孢酚(alternariol,AOH)、交链孢酚单甲醚(alternariol monomethyl ether,AME)、腾毒素(tentoxin,Ten)、互隔交链孢霉素(altenuene,ALT)和交链孢毒素(altertoxin,ATX)Ⅰ、Ⅱ、Ⅲ[49,52]。链格孢霉毒素具有多种母核结构,其中AOH、AME、ALT属于苯并吡喃酮衍生物;ATXⅠ、ATXⅡ、ATX III属于二萘嵌苯类衍生物;TeA属于吡咯烷-2,4-二酮类衍生物;ALT毒素具有长链氨基多元醇的丙三羧酸酯类结构;Ten具有环形四肽结构[49,52]。
链格孢霉毒素主要污染的果蔬有苹果、梨、柑橘、葡萄、草莓、蓝莓、芒果、西红柿等,在腐烂样品中检出浓度较高[53-55]。其中,TeA、AOH和AME在果品的阳性率和检出浓度较高[54]。例如,蒋黎艳等[55]测定柑橘样品中ALT、AME、AOH、TeA和Ten,阳性率为25%,含量范围为2.1~21.8 µg/kg;van de Perre等[53]测定阿根廷的蓝莓、树莓和黑莓样品中AME和AOH含量范围为13.0~22.2 µg/kg。López等[56]检测发现无花果干中TeA含量高达1 728 μg/kg。如今,链格孢霉毒素毒理学、膳食摄入风险及评估尚处于资料积累阶段,尚无国家对链格孢霉毒素制定限量标准。
链格孢霉毒素对人和动物有急性毒性、致癌、致畸、致突变性等多种毒性。据流行病学调查报道,我国河南省林县食道癌持续高发的原因可能与该地区农产品中链格孢霉毒素污染有关[57-58]。链格孢真菌培养物对小鼠、鸡、鸡胚等有急性毒性、致畸性、胚胎毒性,并且培养物在Ames实验中对TA98菌株有致突变性[59]。后续对毒素进行分离和结构确定的研究发现,TeA是在果品中浓度较高和在动物体内毒性作用较强的一种[59]。TeA在多种动物、细胞、细菌实验中表现出较强的急慢性毒性、致癌性、细胞毒性等[55,60]。动物急性和亚急性毒性表现为多器官出血、水肿等病理变化,并表现为食物利用率下降,体质量增加缓慢[59]。TeA对某些植物同样有毒性作用,表现出较强的除草剂活性[61]。相关细胞毒性实验发现,TeA能干扰核糖体上肽链合成,其影响终止过程,使得合成完毕的肽链不能够脱离核糖体,从而干扰蛋白质合成[55]。AOH、AME和ALT不具有明显的急性毒性,但具有较强的致突变性和生殖毒性[59,62-63]。AOH和AME能够导致结肠癌HT-29细胞DNA在复制过程中发生断裂[64]。AOH在V79细胞和小鼠淋巴瘤细胞中表现出对拓扑异构酶I和II活性的抑制作用,其致突变性约为强致突变物质4-硝基喹啉-N-氧化物的1/50[62-63]。AOH的致突变机理可能是通过抑制拓扑异构酶I和II活性,使得DNA在复制过程中拓扑结构异常,导致DNA不能正常复制[62-63]。ATXs具有较强的急性毒性和Ames致突变性,并且在人淋巴瘤Raji细胞株上表现出促癌作用[62-63]。
链格孢霉毒素可能经聚酮途径合成,具体途径尚不明确。研究表明,聚酮化合物合成酶(polyketide synthases,PKS)是链格孢霉毒素重要的合成酶[65-66]。Yun等[67]在水稻稻瘟病菌(Magnaporthe oryzae)中发现TeA合成酶(TeA synthetase,TAS)1编码基因序列号为MGG_07803。TAS1是具有非核糖体肽合成酶(nonribosomal peptide synthetase,NRPS)功能和PKS功能的聚合酶,在催化异亮氨酸和乙酰乙酰CoA形成TeA过程中起重要作用[67]。Chooi等[68]研究表明SnPKS19(SNOG_15829)基因编码的PKS是Parastagonospora nodorum菌合成AOH和AME关键酶。
水果链格孢霉毒素残留多与贮藏中链格孢菌侵染有一定关系[53-55]。链格孢菌中的互交链格孢菌(A. alternata)是水果田间和采后主要的产毒菌[69-72]。此外,互交链格孢菌株可引起作物田间和采后病害[73]。研究发现,在不同植物种类样品中分离到的互交链格孢菌具有遗传特异性,属于不同菌株,可产生宿主特异的植物毒素(host-specific toxins,HSTs),称为链格孢菌的寄主选择性[74-75]。Lengi[74]、Deng Jianxin[75]等发现日本梨的AK-毒素、柑橘的ACT-毒素和草莓的AF-毒素是链格孢菌产生的具有酯化癸三烯酸类似结构的HSTs。互交链格孢菌感染多发生在水果采前阶段,在采后贮藏中,果实因失去人为保护或贮藏时间过长等原因,引起产毒真菌增殖造成病害或形成真菌毒素。在人工培养条件下,链格孢霉毒素的产生除与互交链格孢菌株产毒能力差异有关外,还受到培养基中的水分活度、pH值、培养温度等因素影响[53]。Oviedo等[76]在15~34 ℃和0.95~0.98水分活度范围内进行正交试验,研究了水分活度和温度对极细链格孢菌(A. tenuissima)产生ATX II的影响,发现在温度为30 ℃、水分活度为0.98时极细链格孢菌产生ATX II能力较强。
3 赭曲霉毒素A
赭曲霉毒素是由曲霉和青霉属的某些真菌产生的毒素[7,77]。赭曲霉毒素主要的产生菌包括曲霉属中的炭黑曲霉(A. carbonarius)、黑曲霉(A. niger)、赭曲霉(A. ochraceus)、寄生曲霉(A. parasiticus)和青霉属菌株中的疣孢青霉(P. verruculosum)、纯绿青霉(P. polonicum)、变幻青霉(P. variabile)和产黄青霉(P. chrysogenum)等[7,77]。目前发现,具有明显毒性的赭曲霉毒素有7 种,关注较多的包括OTA、赭曲霉毒素B(ochratoxin B,OTB)、赭曲霉毒素C(ochratoxin C,OTC)等[7]。其中,OTA毒性最大,被WHO和IARC归为2B类致癌物。OTA的分子式是C20H18ClNO6,具有异香豆素化合物的聚酮类化合物类似结构,微溶于水,有较强的化学和热稳定性[9]。
OTA主要污染谷物类农产品,其次污染葡萄及葡萄制品如葡萄干、葡萄汁、葡萄酒等[78-79]。OTA污染的果品还包括开心果、花生、无花果干、杏干等[7]。例如,Akdeniz等[80]研究了土耳其葡萄制品的OTA污染情况,结果发现葡萄干、葡萄果汁和葡萄酒样品污染阳性率分别为8%、20%、88%,其中OTA平均含量分别为1.15、1.40、2.04 µg/kg。鉴于OTA的强毒性和污染严重性,许多个国家对谷物、葡萄及葡萄制品中OTA进行了限量规定。国际葡萄和葡萄酒组织(International Organisation of Vine and Wine,OIV)规定葡萄酒中OTA限量为2 µg/kg。欧盟和加拿大对葡萄酒、葡萄汁和葡萄干中OTA限量分别为2、2、10 µg/kg[81-82]。我国GB 2761—2017《食品安全国家标准 食品中真菌毒素限量》规定了以谷物、豆类和其为原料制成产品的OTA限量为5 μg/kg,并未对葡萄制品中OTA进行限定[18]。
OTA对动物和人都具有多方面的毒性,包括致癌、致畸、神经毒性、肾毒性等[25]。OTA是较强的致癌物质,可导致DNA损伤和多位点甲基化[80,83]。OTA有很强的急性毒性,在犬、家猪、家鸡中LD50分别为0.2、1.0、3.3 mg/kg,在小鼠、大鼠中的LD50在20~58 mg/kg范围内[25]。在OTA亚急性毒性实验中,动物出现严重的氧化应激、血浆参数改变和肾脏组织病变[80]。由于OTA化学结构与苯丙氨酸相似,其在体内可与苯丙氨酸竞争而干扰某些代谢反应[80]。Darif等[83]研究结果表明OTA可干扰以苯丙氨酸为底物的酶促反应和蛋白质合成反应等,并且OTA能够导致线粒体过氧化和加速细胞凋亡。
OTA经聚酮类化合物合成途径合成,具体过程还未明确。OTA合成途径与异香豆素类似物相似,是以L-苯丙氨酸为底物的聚酮化合物途径合成[84]。OTA合成过程涉及几种重要的酶,包括PKS、NRPS、卤化酶、CYP450单加氧酶、酯酶等[84-85]。Gil-Serna等[86]研究了曲霉菌中OTA合成基因,发现毒素合成的3 个关键酶(PKS、NRPS、CYP450单加氧酶)基因位于一条连续长度为20 742 bp的DNA链。AcOTApks是编码PKS的基因,在OTA合成的起始阶段起重要作用[7,85,87]。AcOTAnrps基因编码的NRPS,在催化异香豆素和L-β-苯丙氨酸的肽键形成OTB过程起关键作用[88]。OTB是OTA的前体,OTB可能经AcOTAhal基因编码的卤化酶完成其结构中C-5位置的卤化催化形成OTA[88]。另外两个基因AcOTAp450和AcOTAbZIP可能在毒素合成过程中起着酶或者辅助因子作用[88]。
近年来,有关果品中OTA形成的影响因素研究取得了一定的进展。OTA主要的产生菌是曲霉和青霉,但在作物和地域上有各自的优势菌[7]。Wang Yan等[7]列举了21种能产生OTA的曲霉和青霉,并总结出曲霉属真菌是温室内或温带地区OTA的主要产生菌,而青霉属真菌是较冷地区OTA产生的优势菌。研究发现,谷物中OTA可能由赭曲霉(A. ochraceus)和疣孢青霉(P. verruculosum)产生,但水果及果汁、可可豆和咖啡中OTA可能主要是由碳黑曲霉(A. carbonarius)和黑曲霉(A. niger)产生[78-79]。影响OTA形成的因素有光照、氧化胁迫、pH值、渗透压、氮源等。光照对产毒真菌繁殖和毒素形成的影响比较复杂。Schmidt-Heydt等[89]在多种产OTA菌培养研究中发现,高波长红光(627 nm)和低波长蓝光(470~455 nm)对OTA的形成有抑制作用。Cheong等[90]也得出了类似结果,并总结出黑色素含量较高的菌株对光照的敏感性不及黑色素含量较低的菌株,培养基种类可对真菌的光照敏感性造成影响。真菌细胞的氧化应激状态也影响OTA合成。氧胁迫调控因子(activator protein,AP)-1是细胞重要的转录因子,在细胞氧化应激中发挥着重要作用,具有DNA结合结构域和转录激活活性[7,91]。研究表明,敲除真菌Aoyap1基因,将导致真菌处于氧化应激状态,并影响毒素产生[7,91]。另外,pH值、渗透压、氮源等因素可影响OTA的生成[7,92-93]。
4 黄曲霉毒素
AF主要由曲霉属中黄曲霉(A. flavus)和寄生曲霉(A. parasiticus)菌株产生[8]。目前已分离鉴定的AF有17 种,关注较多的包括AFB1、AFB2、AFG1、AFG2、AFM1、AFM2等[94]。AFM1、AFM2是由AFB1、AFB2在人或动物体内经代谢转化形成,主要污染肉、奶等动物制品[94]。AFB1是毒性最大的一种,被WHO和IARC划定为1类致癌物。AFB1具有二呋喃环并香豆素结构,分子式为C17H12O6,具有很强化学和热稳定性,需280 ℃以上长时间处理才能破坏其结构。
AF可对多种农产品包括玉米、水稻、花生、小麦、大豆、坚果类等及其制品造成污染[87]。在果品中,AF主要污染花生、核桃、开心果、榛子、杏仁、葡萄干、无花果干等。AF在干果和坚果中阳性率较高,检出量可达几百µg/kg[25,95-96]。AF对人类危害巨大,如今许多国家对农产品中AF进行了严格限量规定,范围为0.05~30.00 μg/kg[97-98]。针对干果和坚果制品,国际食品法典委员会颁布的CODEX STAN 193—2010规定:4 种AF(AFB1、AFB2、AFG1、AFG2)在杏仁、巴西坚果、榛子和开心果初级农产品中总限量为15 µg/kg,在即食产品中限量为10 µg/kg[98]。欧盟标准No 1881/2006及其修订版规定:开心果、巴西坚果、榛子等中4 种AF(AFB1、AFB2、AFG1、AFG2)总限量为10~15 µg/kg,其中AFB1限量为5~12 µg/kg不等;即食产品中AF和AFB1限量分别为4~10 µg/kg和2~8 µg/kg[17,81,99]。FDA标准CPG Sec. 570.375规定巴西坚果、开心果AF总量限量为20 µg/kg[100]。我国GB 2761—2017《食品安全国家标准 食品中真菌毒素限量》规定除花生外的其他熟制坚果及籽类AFB1限量为5 µg/kg[18]。
AFB1具有急性毒性、致癌、致畸、致突变、免疫抑制等毒性。AFB1短时间暴露对人和动物有很强的急性、亚急性毒性作用。AFB1的LD50在多数动物体内的范围为0.3~17.9 mg/kg,属于剧毒类物质。AFB1的主要急性毒性是导致肝损伤,包括肝细胞肿胀、空泡变性,肝脏肿胀、出血、坏死、变性等;亚急性毒性主要体现在肝硬化、胆管增生、胃肠道紊乱、贫血等[101]。AFB1长时间暴露有很强的致癌、致畸、致突变、免疫抑制、营养紊乱等毒性作用[101-102]。AFB1具有致癌性主要原因是其被肝脏药物代谢酶活化形成活性代谢产物,继而破坏DNA结构和影响其功能。目前认为,AFB1通过细胞色素氧化酶P450(CYP3A4)代谢产生的活性代谢产物为8,9-外环氧AFB1(exo-8,9-epoxide AFB1,exo-AFBO)[8,101-102]。活性产物exo-AFBO能够与DNA发生亲核反应,形成AFB1-DNA加合物,导致DNA结构改变,进而促进或导致癌变[8,101]。研究表明,AFB1还可引起抑癌基因p53突变和癌基因ras激活[103]。
AF合成基因簇位于真菌第3号染色体上(图2)[29,104]。寄生曲霉AF合成基因簇基因序列号为YA341790。AF合成基因簇包括约25 个基因,总长度约为80 kb。基因aflA~aflY是已经克隆得到的可能与AF合成有关的基因。其中,aflA~aflQ已经明确具有催化功能的基因;aflT~aflY具体作用并不明确。AflR和aflS基因是重要的调控因子[105]。AflR基因是寄生曲霉和黄曲霉AF合成基因簇中的必需基因,在多数AF产生菌株中具有高度同源性[106-108]。AflR基因编码具有Zn(Ⅱ)2Cys6结构的转录因子,能够特异地识别启动子序列(5-TCGN5CGR-3),对启动转录有重要作用[109-110]。AflR基因高表达可提高毒素生物合成途径中其他基因(如aflF)的表达水平,从而增加AFB1的合成量[105]。相反,AflR基因缺失可能导致不能合成AF[29,111]。AF合成约需20 步反应过程,经历聚酮合成途径。AF合成是以乙酰CoA为底物,在一系列酶催化下形成具有复合杂环结构的聚酮骨架化合物(图2)[29]。合成反应起始是由aflA和aflB基因编码的α亚基和β亚基共同组成脂肪酸合成酶催化乙酰-CoA形成己酰-CoA;己酰-CoA再由aflC编码的PKS催化生成诺素罗瑞尼克酸(norsolorinic acid,NOR);NOR被aflE编码的还原酶和aflF编码的脱氢酶催化生成奥佛兰提素(averantin,AVN);AVN经一个由aflG基因编码的CYP450酶(ord-1)催化生成奥佛路凡素(5’-hydroxyaverantin,HAVN);HAVN经aflH编码的醇脱氢酶(alcoholdehydrogenase,adhA)脱氢催化生成奥佛尼红素(averufin,AVF);AVF经aflI编码的氧化酶催化生成杂色半缩醛乙酸(versiconal hemiacetal acetate,VHA);VHA经aflJ编码的酯化酶催化生成杂色醇(versiconal,VAL);VAL经aflK编码的杂色曲霉B合成酶催化生成杂色曲霉B(versicolorin B,VERB);VERB经aflL编码的CYP450单加氧酶催化生成杂色曲霉A(versicolorin A,VERA);VERA经aflM和aflN编码的脱氢酶和CYP450单加氧酶催化生成去甲基柄曲霉素(demethylsterigmatocystin,DMST);DMST经aflO编码的O-甲基转移酶I催化生成柄曲霉素(sterigmatocystin,ST);ST经aflP编码的O-甲基转移酶II催化生成O-甲基柄曲霉素(O-methylsterigmatocystin,OMST);OMST经aflQ编码的单加氧酶催化最终生成AFB1[29,97,110]。OMST可能经aflQ编码的单加氧酶,或aflY编码的还原酶和NorB编码的脱氢酶共同催化最终生成AF [112]。
[112]。
近年来,有关果品中AF产生的影响因素和控制手段研究较多。研究表明,不良的贮藏环境条件是AF污染的主要因素,包括温度、水分活度和CO2浓度。贮藏条件的温度和水分活度是对黄曲霉产毒影响较大的因素。Arrus等[113]以巴西坚果为培养基,在相对湿度为75%、80%、85%、97%和温度为10、13、15、25、30 ℃条件下设计正交试验,发现在相对湿度为97%、温度为25 ℃和30 ℃时AF总量和AFB1含量分别达到6 817 µg/kg和4 483 µg/kg。另外,水分活度和温度影响AF调节基因和结构基因的表达。Gallo等[114]以杏仁作为培养基,研究水分活度(0.90、0.93、0.96、0.99)和温度(20、28、37 ℃)对黄曲霉的产毒性能的研究中发现,水分活度在0.90、0.93时无真菌生长和AFB1的产生,在水分活度0.96和28 ℃条件下AFB1产生最多,在28 ℃条件下调节基因aflR和aflS的表达量较高,在28 ℃和水分活度为0.96、0.99时结构基因aflD和aflO表达量较高。Lahouar等[115]在温度15~37 ℃、水分活度0.85~0.99范围条件下进行研究,结果表明温度在37 ℃和水分活度在0.97~0.99时黄曲霉生长速率较快,但水分活度低于0.91时黄曲霉将不能生长。CO2浓度升高同样影响黄曲霉生长和AF形成。Giorni等[116]研究表明,CO2体积分数升高到25%时将抑制黄曲霉生长,升高到50%及以上时AF合成受到明显抑制。AF控制手段还有生防菌、化学物质、物理射线等。生防菌或毒素降解酶同时培养可能抑制黄曲霉或AF形成,如培养基中添加降解酶、酿酒酵母、少孢根霉菌、乳酸杆菌能抑制黄曲霉生长或AF形成[117-119]。有关化学物质抑制黄曲霉生长或AF形成的报道较多,这些化学物质包括抗真菌剂、花青苷、黄酮、多酚类物质、类胡萝卜素、水飞蓟素等[117,120-122]。多种物理处理能降低农产品中的AF含量,如水洗和吸附等处理能降低AF含量,γ射线辐照能导致AFB1降解[123-124]。

图2 AF的合成基因簇结构和AF的合成途径[29]
Fig. 2 Clustered genes involved in biosynthetic pathway of aflatoxins[29]
5 结 语
真菌毒素严重危害人类健康,其在果品中的残留严重影响果品质量安全。研究发现,果品中的真菌毒素主要有PAT、链格孢霉毒素、OTA和AF。上述毒素对人体具有广泛毒性,在水果及其制品的产毒菌株、污染情况、毒性毒理、合成途径及其影响因素各有不同。PAT主要污染苹果、山楂及其制品,是由青霉和曲霉属菌株经聚酮途径合成,涉及到多种酶与底物反应,并受到多种因素影响。链格孢霉是引起多种水果蔬菜病害和产生链格孢霉毒素的主要病菌。在果品中TeA、AOH、AME和ALT是主要残留的链格孢霉毒素。OTA是2B类致癌物,主要污染葡萄及其制品。AF污染干果、坚果等。AFB1是第1类致癌物,其合成过程已经比较明确。本文总结了相关基础理论,期望对果品中真菌毒素研究领域科研人员提供一定参考。
真菌毒素合成途径、影响因素及调控机理的生化和分子生物学将是今后真菌毒素研究重点内容之一。综述发现,真菌毒素的发生规律、毒素合成的影响因素与控制机理是真菌毒素防控技术发展的关键,但相关机理还不完全清楚。前期研究表明,真菌毒素的产毒物质基础、合成途径和影响因素比较复杂;真菌毒素基因表达调控可能发生在多个层次,并受多因素和多调控组分控制。目前,多种真菌毒素合成生化通路的基因表达调控机理尚未完全阐明。因此,真菌毒素的合成途径、基因调控、环境影响因素及机理将成为今后的研究热点。
参考文献:
[1] FERRE F S. Worldwide occurrence of mycotoxins in rice[J]. Food Control, 2016, 62: 291-298. DOI:10.1016/j.foodcont.2015.10.051.
[2] 王蒙, 姜楠, 戴莹, 等. 国内外水果真菌毒素的限量及检测方法标准分析[J]. 食品安全质量检测学报, 2016, 7(2): 459-467.
[3] HUSSEIN H S, BRASEL J M. Toxicity, metabolism, and impact of mycotoxins on humans and animals[J]. Toxicology, 2001, 167(2): 101-134. DOI:10.1016/s0300-483x(01)00471-1.
[4] PUEL O, GALTIER P, OSWALD I P. Biosynthesis and toxicological effects of patulin[J]. Toxins, 2010, 2(4): 613-631. DOI:10.3390/toxins2040613.
[5] ESCRIVÁ L, FONT G, MANYES L. In vivo toxicity studies of fusarium mycotoxins in the last decade: a review[J]. Food and Chemical Toxicology, 2015, 78: 185-206. DOI:10.1016/j.fct.2015.02.005.
[6] TURNER N W, BRAMHMBHATT H, SZABO-VEZSE M, et al.Analytical methods for determination of mycotoxins: an update (2009–2014)[J]. Analytica Chimica Acta, 2015, 901: 12-33. DOI:10.1016/j.aca.2015.10.013.
[7] WANG Yan, WANG Liuqing, LIU Fei, et al. Ochratoxin a producing fungi, biosynthetic pathway and regulatory mechanisms[J]. Toxins,2016, 8(3): 83. DOI:10.3390/toxins8030083.
[8] BENNETT J W, KLICH M. Mycotoxins[J]. Clinical Microbiology Reviews, 2003, 16(3): 497-516. DOI:10.1128/cmr.16.3.497-516.2003.
[9] ZHU Y Y, YU J, BRECHT J K, et al. Pre-harvest application of oxalic acid increases quality and resistance to Penicillium expansum in kiwifruit during postharvest storage[J]. Food Chemistry, 2016, 190:537-543. DOI:10.1016/j.foodchem.2015.06.001.
[10] 聂继云. 果品及其制品展青霉素污染的发生、防控与检测[J].中国农业科学, 2017, 50(18): 3591-3607. DOI:10.3864/j.issn.0578-1752.2017.18.015.
[11] MOAKE M M, PADILLA-ZAKOUR O I, WOROBO R W.Comprehensive review of patulin control methods in foods[J].Comprehensive Reviews in Food Science and Food Safety, 2005, 4(1):8-21. DOI:10.1111/j.1541-4337.2005.tb00068.x.
[12] SARUBBI F, FORMISANO G, AURIEMMA G, et al. Patulin in homogenized fruit's and tomato products[J]. Food Control, 2016, 59:420-423. DOI:10.1016/j.foodcont.2015.06.022.
[13] DRUSCH S, RAGAB W. Mycotoxins in fruits, fruit juices, and dried fruits[J]. Journal of Food Protection, 2003, 66(8): 1514-1527.DOI:10.4315/0362-028X-66.8.1514.
[14] JI X F, LI R, YANG H, et al. Occurrence of patulin in various fruit products and dietary exposure assessment for consumers in China[J]. Food Control, 2017, 78: 100-107. DOI:10.1016/j.foodcont.2017.02.044.
[15] BONERBA E, CECI E, CONTE R, et al. Survey of the presence of patulin in fruit juices[J]. Food Additives and Contaminants: Part B,2010, 3(2): 114-119. DOI:10.1080/19393210.2010.490882.
[16] VAN EGMOND H P, SCHOTHORST R C, JONKER M A.Regulations relating to mycotoxins in food[J]. Analytical and Bioanalytical Chemistry, 2007, 389(1): 147-157. DOI:10.1007/s00216-007-1317-9.
[17] Standing Committee on Plants, Animals, Food and Feed. Setting maximum levels for certain contaminants in foodstuffs: COMMISSION REGULATION (EC) No 1881/2006[S]. [2016-01-05].The European Commission, 2006: 23. http://down.foodmate.net/standard/sort/13/11666.html.
[18] 卫生部. 食品安全国家标准 食品中真菌毒素限量: GB 2761—2017[S]. 北京: 中国标准出版社, 2011: 2-7.
[19] SELMANOǦLU G. Evaluation of the reproductive toxicity of patulin in growing male rats[J]. Food and Chemical Toxicology, 2006, 44(12):2019-2024. DOI:10.1016/j.fct.2006.06.022.
[20] ASSUNÇÃO R, ALVITO P, KLEIVELAND C R, et al.Characterization of in vitro effects of patulin on intestinal epithelial and immune cells[J]. Toxicology Letters, 2016, 250: 47-56.DOI:10.1016/j.toxlet.2016.04.007.
[21] International Agency for Research on Cancer (IARC). Patulin. some naturally occurring toxins and synthetic food components. monographs on the evaluation of carcinogenic risk to humans[R]. Lyon: IARC,1986, 40: 83-89.
[22] DONMEZ-ALTUNTAS H, GOKALP-YILDIZ P, BITGEN N, et al.Evaluation of genotoxicity, cytotoxicity and cytostasis in human lymphocytes exposed to patulin by using the cytokinesis-block micronucleus cytome (CBMN cyt) assay[J]. Mycotoxin Research,2013, 29(2): 63-70. DOI:10.1007/s12550-012-0153-8.
[23] SCHUMACHER D M, METZLER M, LEHMANN L. Mutagenicity of the mycotoxin patulin in cultured Chinese hamster V79 cells, and its modulation by intracellular glutathione[J]. Archives of Toxicology,2005, 79(2): 110-121. DOI:10.1007/s00204-004-0612-x.
[24] U.S. Food and Drug Adnimistration(FDA). Compliance Policy Guidance for FDA Staff: apple juice, apple juice concentrates, and apple juice products-adulteration with patulin: CPG Sec.510.150[S].Maryland: U.S. Food and Drug Adnimistration(FDA), 2001:1[2016-11-05]. https://www.fda.gov/ICECI/ComplianceManuals/CompliancePolicyGuidanceManual/ucm074427.htm.
[25] MARIN S, RAMOS A J, CANO-SANCHO G, et al. Mycotoxins:occurrence, toxicology, and exposure assessment[J]. Food and Chemical Toxicology, 2013, 60: 218-237. DOI:10.1016/j.fct.2013.07.047.
[26] PILLAY Y, PHULUKDAREE A, NAGIAH S, et al. Patulin triggers NRF2-mediated survival mechanisms in kidney cells[J]. Toxicon,2015, 99: 1-5. DOI:10.1016/j.toxicon.2015.03.004.
[27] GLASER N, STOPPER H. Patulin: mechanism of genotoxicity[J].Food and Chemical Toxicology, 2012, 50(5): 1796-1801.DOI:10.1016/j.fct.2012.02.096.
[28] GRAHAM G J. Tandem genes and clustered genes[J]. Journal of Theoretical Biology, 1995, 175(1): 71-87. DOI:10.1006/jtbi.1995.0122.
[29] YU J J, CHANG P K, EHRLICH K C, et al. Clustered pathway genes in aflatoxin biosynthesis[J]. Applied and Environmental Microbiology,2004, 70(3): 1253-1262. DOI:10.1128/aem.70.3.1253-1262.2004.
[30] ARTIGOT M P, LOISEAU N, LAFFITTE J, et al. Molecular cloning and functional characterization of two CYP619 cytochrome P450s involved in biosynthesis of patulin in Aspergillus clavatus[J].Microbiology, 2009, 155(Pt5): 1738-1747. DOI:10.1099/mic.0.024836-0.
[31] WANG I K, REEVES C, GAUCHER G M. Isolation and sequencing of a genomic DNA clone containing the 3’ terminus of the 6-methylsalicylic acid polyketide synthetase gene of Penicillium urticae[J]. Canadian Journal of Microbiology, 1991, 37(1): 86-95.
[32] LAI T F, WANG Y, BAI X L, et al. Dissecting inhibitory effect of boric acid on virulence and patulin production of Penicillium expansum[J]. Postharvest Biology and Technology, 2016, 117: 187-196. DOI:10.1016/j.postharvbio.2016.03.003.
[33] DE CLECQ N, VLAEMYNCK G, VAN PAMEL E, et al.Isoepoxydon dehydrogenase (idh) gene expression in relation to patulin production by Penicillium expansum under different temperature and atmosphere[J]. International Journal of Food Microbiology, 2016,220(4): 50-57. DOI:10.1016/j.ijfoodmicro.2016.01.004.
[34] SNINI S P, TADRIST S, LAFFITTE J, et al. The gene PatG involved in the biosynthesis pathway of patulin, a food-borne mycotoxin,encodes a 6-methylsalicylic acid decarboxylase[J]. International Journal of Food Microbiology, 2014, 171(5): 77-83. DOI:10.1016/j.ijfoodmicro.2013.11.020.
[35] LIU J J, WOLK C P. Mutations in genes patA and patL of Anabaena sp. strain PCC 7120 result in similar phenotypes, and the proteins encoded by those genes may interact[J]. Journal of Bacteriology, 2011,193(21): 6070-6074. DOI:10.1128/jb.05523-11.
[36] BOK J W, NOORDERMEER D, KALE S P, et al. Secondary metabolic gene cluster silencing in Aspergillus nidulans[J]. Molecular Microbiology, 2006, 61(6): 1636-1645. DOI:10.1111/j.1365-2958.2006.05330.x.
[37] BOK J W, KELLER N P. LaeA, a regulator of secondary metabolism in Aspergillus spp.[J]. Eukaryot Cell, 2004, 3(2): 527-535.DOI:10.1128/ec.3.2.527-535.2004.
[38] 苏青峰. 苹果浓缩汁(AJC)生产中棒曲霉素产生菌的分离鉴定及控制技术研究[D]. 杨凌: 西北农林科技大学, 2005: 15-18.
[39] PRUSKY D, BARAD S, MENT D, et al. The pH modulation by fungal secreted molecules: a mechanism affecting pathogenicity by postharvest pathogens[J]. Israel Journal of Plant Sciences, 2016, 63(1):22-30. DOI:10.1080/07929978.2016.1151290.
[40] BARAD S, ESPESO E A, SHERMAN A, et al. Ammonia activates pacC and patulin accumulation in an acidic environment during apple colonization by Penicillium expansum[J]. Molecular Plant Pathology,2016, 17(5): 727-740. DOI:10.1111/mpp.12327.
[41] MENNITI A M, NERI F, GREGORI R, et al. Some factors influencing patulin production by Penicillium expansum in pome fruits[J]. Journal of the Science of Food and Agriculture, 2010, 90(13): 2183-2187.DOI:10.1002/jsfa.4067.
[42] ZONG Y Y, LI B Q, TIAN S P. Effects of carbon, nitrogen and ambient pH on patulin production and related gene expression in Penicillium expansum[J]. International Journal of Food Microbiology,2015, 206(2): 102-108. DOI:10.1016/j.ijfoodmicro.2015.05.007.
[43] 高振鹏, 张丹, 刘瑞, 等. 苹果汁中展青霉素的去除动力学与热力学研究[J]. 农业机械学报, 2015, 46(10): 304-310. DOI:10.6041/j.issn.1000-1298.2015.10.041.
[44] 秦敏丽, 盛文军, 韩舜愈, 等. 超声波去除浓缩苹果汁中棒曲霉素技术条件的优化[J]. 甘肃农业大学学报, 2014, 49(2): 150-154.DOI:10.3969/j.issn.1003-4315.2014.02.028.
[45] 刘华峰. 棒曲霉素在腐烂苹果中的分布规律及清洗、树脂吸附对苹果汁中棒曲霉素的脱除技术研究[D]. 兰州: 甘肃农业大学, 2010: 39-41.
[46] DE SOUZA SANT’ANA A, ROSENTHAL A, DE MASSAGUER P R. The fate of patulin in apple juice processing: a review[J].Food Research International, 2008, 41(5): 441-453. DOI:10.1016/j.foodres.2008.03.001.
[47] 张小平, 李元瑞, 师俊玲, 等. 苹果汁中棒曲霉素控制技术研究进展[J]. 中国农业科学, 2004, 37(11): 1672-1676. DOI:10.3321/j.issn:0578-1752.2004.11.015.
[48] 王媛, 袁亚宏, 杨丽霞, 等. 多酚及植物精油对扩展青霉生长及展青霉素生成的抑制作用研究[J]. 食品安全质量检测学报, 2015, 6(7):2702-2707.
[49] OSTRY V. Alternaria mycotoxins: an overview of chemical characterization, producers, toxicity, analysis and occurrence in foodstuffs[J]. World Mycotoxin Journal, 2008, 1(2): 175-188.DOI:10.3920/WMJ2008.x013.
[50] 吴春生, 马良, 江涛, 等. 链格孢霉毒素细交链格孢菌酮酸的研究进展[J]. 食品科学, 2014, 35(19): 295-301. DOI:10.7506/spkx1002-6630-201419059.
[51] SOLFRIZZO M, GIROLAMO A D, VITTI C, et al. Toxigenic profile of Alternaria alternata and Alternaria radicina occurring on umbelliferous plants[J]. Food Additives and Contaminats, 2005, 22(4):302-308. DOI:10.1080/02652030500058379.
[52] 满燕, 梁刚, 李安, 等. 链格孢霉毒素检测方法研究进展[J]. 食品安全质量检测学报, 2016, 7(2): 453-458.
[53] VAN DE PERRE E, DESCHUYFFELEER N, JACXSENS L, et al.Screening of moulds and mycotoxins in tomatoes, bell peppers, onions,soft red fruits and derived tomato products[J]. Food Control, 2014,37(1): 165-170. DOI:10.1016/j.foodcont.2013.09.034.
[54] PATRIARCA A. Alternaria in food products[J]. Current Opinion in Food Science, 2016, 11: 1-9. DOI:10.1016/j.cofs.2016.08.007.
[55] 蒋黎艳, 赵其阳, 龚蕾, 等. 超高效液相色谱串联质谱法快速检测柑橘中的5 种链格孢霉毒素[J]. 分析化学, 2015, 43(12): 1851-1858.DOI:10.11895/j.issn.0253-3820.150370.
[56] LÓPEZ P, VENEMA D, MOL H, et al. Alternaria toxins and conjugates in selected foods in the Netherlands[J]. Food Control, 2016,69: 153-159. DOI:10.1016/j.foodcont.2016.04.001.
[57] 李琮宇. 河南食管癌高发区食管癌家系收集和遗传流行病学分析[D].郑州: 郑州大学, 2007: 2-3.
[58] 詹瑄, 朱宝玉, 李树森, 等. 河南省农民膳食营养结构与疾病死亡率的初步研究[J]. 河南预防医学杂志, 1991(2): 610-614.
[59] TANG J J, HU X T. Environmental, genetic and cellular toxicity of tenuazonic acid isolated from Alternaria alternata[J]. African Journal of Biotechnology, 2008, 7(8): 1151-1156.
[60] BENSASSI F, GALLERNE C, SHARAF EL DEIN O, et al. Cell death induced by the Alternaria mycotoxin Alternariol[J]. Toxicology in Vitro, 2012, 26(6): 915-923. DOI:10.1016/j.tiv.2012.04.014.
[61] 周兵. 链格孢菌AAC-毒素生物源除草剂若干关键产业化技术的研究[D]. 南京: 南京农业大学, 2007: 7-10.
[62] FERNÁNDEZ-BLANCO C, FONT G, RUIZ M J. Role of quercetin on Caco-2 cells against cytotoxic effects of alternariol and alternariol monomethyl ether[J]. Food and Chemical Toxicology, 2016, 89: 60-66. DOI:10.1016/j.fct.2016.01.011.
[63] FERNÁNDEZ-BLANCO C, JUAN-GARCÍA A, JUAN C, et al.Alternariol induce toxicity via cell death and mitochondrial damage on Caco-2 cells[J]. Food and Chemical Toxicology, 2016, 88: 32-39.DOI:10.1016/j.fct.2015.11.022.
[64] PFEIFFER E, ESCHBACH S, METZLER M. Alternaria toxins: DNA strand-breaking activity in mammalian cells in vitro[J]. Mycotoxin Research, 2007, 23(3): 152-157. DOI:10.1007/bf02951512.
[65] COX R J. Polyketides, proteins and genes in fungi: programmed nanomachines begin to reveal their secrets[J]. Organic and Biomolecular Chemistry, 2007, 5(13): 2010-2026. DOI:10.1039/b704420h.
[66] KATZ L. Manipulation of modular polyketide syntheses[J]. Chemical Reviews, 1997, 97(7): 2557-2575. DOI:10.1021/cr960025.
[67] YUN C S, MOTOYAMA T, OSADA H. Biosynthesis of the mycotoxin tenuazonic acid by a fungal NRPS-PKS hybrid enzyme[J].Nature Communications, 2015, 6: 8758. DOI:10.1038/ncomms9758.
[68] CHOOI Y H, MURIA-GONZALEZ M J, MEAD O L, et al. SnPKS19 encodes the polyketide synthase for alternariol mycotoxin biosynthesis in the wheat pathogen Parastagonospora nodorum[J]. Applied and Environmental Microbiology, 2015, 81(16): 5309-5317. DOI:10.1128/aem.00278-15.
[69] 王宏, 常有宏, 陈志谊. 梨黑斑病病原菌生物学特性研究[J]. 果树学报, 2006, 23(2): 247-251. DOI:10.3969/j.issn.1009-9980.2006.02.021.
[70] 张彩霞, 陈莹, 李壮, 等. 苹果链格孢菌与寄主叶片互作的超微结构研究[J]. 西北植物学报, 2012, 32(1): 106-110. DOI:10.3969/j.issn.1000-4025.2012.01.017.
[71] 唐淬. 柑橘黑斑病、褐斑病的分离鉴定及分子检测[D]. 重庆: 西南大学, 2012: 18-21.
[72] 赵远征, 刘志恒, 李俞涛, 等. 大樱桃黑斑病病原鉴定及其致病性研究[J]. 园艺学报, 2013, 40(8): 1560-1566.
[73] 吴孔明, 陈万权, 倪汉祥, 等. 植物保护学学科研究现状与展望[R].2010—2011植物保护学学科发展报告, 2011: 4-6.
[74] LENGI M R, NIAZMAND A R, KIANOUSH M. Genetic differences in Alternaria alternata isolates associated with brown spot in tangerine cultivars[J]. Scienceasia, 2014, 40(4): 263-267. DOI:10.2306/sciencea sia1513-1874.2014.40.263.
[75] DENG Jianxin, PAUL N C, PARK M S, et al. Molecular characterization, morphology, and pathogenicity of Alternaria panax from araliaceous plants in Korea[J]. Mycological Progress, 2013,12(2): 383-396. DOI:10.1007/s11557-012-0844-8.
[76] OVIEDO M S, RAMIREZ M L, BARROS G G, et al. Influence of water activity and temperature on growth and mycotoxin production by Alternaria alternata on irradiated soya beans[J]. International Journal of Food Microbiology, 2011, 149(2): 127-132. DOI:10.1016/j.ijfoodmicro.2011.06.007.
[77] KARCZMARCZYK A, REINER-ROZMAN C, HAGENEDER S,et al. Fast and sensitive detection of ochratoxin A in red wine by nanoparticle-enhanced SPR.[J]. Analytica Chimica Acta, 2016, 937:143-150. DOI:10.1016/j.aca.2016.07.034.
[78] AMÉZQUETA S, GONZÁLEZ-PEÑAS E, MURILLO-ARBIZU M,et al. Ochratoxin A decontamination: a review[J]. Food Control, 2009,20(4): 326-333. DOI:10.1016/j.foodcont.2008.05.017.
[79] HOCKING A D, LEONG S L L, KAZI B A, et al. Fungi and mycotoxins in vineyards and grape products[J]. International Journal of Food Microbiology, 2007, 119(1/2): 84-88. DOI:10.1016/j.ijfoodmicro.2007.07.031.
[80] AKDENIZ A S, OZDEN S, ALPERTUNGA B. Ochratoxin A in dried grapes and grape-derived products in Turkey[J]. Food Additives &Contaminants. Part B, Surveillance, 2013, 6(4): 265-269. DOI:10.1080/19393210.2013.814719.
[81] Standing Committee on Plants, Animals, Food and Feed. Setting maximum levels for certain contaminants in foodstuffs: Commission Regulation(EU) 2015/1005[S]. the European Commission, 2015: 11-12[2016-11-05].http://down.foodmate.net/standard/sort/13/11666.html.
[82] Organisation Internationale de la Vigne et Du Vin (OIV). Compendium of international methods of wine and must analysis: Edition 2008[S].Pairs: OIV, 2007: 28[2016-11-05]. https://wenku.baidu.com/view/e50cc162ed630b1c58eeb532.html.
[83] DARIF Y, MOUNTASSIF D, BELKEBIR A, et al. Ochratoxin A mediates MAPK activation, modulates IL-2 and TNF-alpha mRNA expression and induces apoptosis by mitochondria-dependent and mitochondria-independent pathways in human H9 T cells[J]. Journal of Toxicological Sciences, 2016, 41(3): 403-416.
[84] NGUYEN H D T, MCMULLIN D R, PONOMAREVA E, et al.Ochratoxin A production by Penicillium thymicola[J]. Fungal Biology,2016, 120(8): 1041-1049. DOI:10.1016/j.funbio.2016.04.002.
[85] FERRARA M, MAGISTÀ D, EPIFANI F, et al. Study of gene expression and OTA production by Penicillium nordicum during a small-scale seasoning process of salami[J]. International Journal of Food Microbiology, 2016, 227: 51-55. DOI:10.1016/j.ijfoodmicro.2016.03.028.
[86] GIL-SERNA J, VÁZQUEZ C, GONZÁLEZ-JAÉN M T, et al.Clustered array of ochratoxin A biosynthetic genes in Aspergillus steynii and their expression patterns in permissive conditions[J].International Journal of Food Microbiology, 2015, 214: 102-108.DOI:10.1016/j.ijfoodmicro.2015.07.020.
[87] RAWLINGS B J. Biosynthesis of polyketides (other than actinomycete macrolides)[J]. Natural Product Reports, 1999, 16(4): 425-484.DOI:10.1039/a900566h.
[88] FERRARA M, PERRONE G, GAMBACORTA L, et al. Identification of a halogenase involved in the biosynthesis of ochratoxin a in Aspergillus carbonarius[J]. Applied and Environmental Microbiology,2016, 82(18): 5631-5641. DOI:10.1128/aem.01209-16.
[89] SCHMIDT-HEYDT M, RÜFER C, RAUPP F, et al. Influence of light on food relevant fungi with emphasis on ochratoxin producing species[J]. International Journal of Food Microbiology, 2011, 145(1):229-237. DOI:10.1016/j.ijfoodmicro.2010.12.022.
[90] CHEONG K K, STRUB C, MONTET D, et al. Effect of different light wavelengths on the growth and ochratoxin A production in Aspergillus carbonarius and Aspergillus westerdijkiae[J]. Fungal Biology, 2016,120(5): 745-751. DOI:10.1016/j.funbio.2016.02.005.
[91] ESPESO E A, TILBURN J, SANCHEZ-PULIDO L, et al. Specific DNA recognition by the Aspergillus nidulans three zinc finger transcription factor PacC[J]. Journal of Molecular Biology, 1997,274(4): 466-480. DOI:10.1006/jmbi.1997.1428.
[92] ARST H N, PEÑALVA M A. pH regulation in Aspergillus and parallels with higher eukaryotic regulatory systems[J]. Trends in Genetics, 2003,19(4): 224-231. DOI:10.1016/s0168-9525(03)00052-0.
[93] MEDINA A, MATEO E M, VALLE-ALGARRA F M, et al. Influence of nitrogen and carbon sources on the production of ochratoxin A by ochratoxigenic strains of Aspergillus spp. isolated from grapes[J].International Journal of Food Microbiology, 2008, 122(1/2): 93-99.DOI:10.1016/j.ijfoodmicro.2007.11.055.
[94] HERZALLAH S M. Determination of aflatoxins in eggs, milk, meat and meat products using HPLC fluorescent and UV detectors[J].Food Chemistry, 2009, 114(3): 1141-1146. DOI:10.1016/j.foodchem.2008.10.077.
[95] OSTADRAHIMI A, ASHRAFNEJAD F, KAZEMI A, et al. Aflatoxin in raw and salt-roasted nuts (pistachios, peanuts and walnuts) sold in markets of Tabriz, Iran[J]. Jundishapur Journal of Microbiology, 2014,7(1): 6874. DOI:10.5812/jjm.8674.
[96] DE MELLO F R, SCUSSEL V M. Characteristics of in-shell brazil nuts and their relationship to aflatoxin contamination: criteria for sorting[J]. Journal of Agricultural and Food Chemistry, 2007, 55(22):9305-9310. DOI:10.1021/jf071392x.
[97] 罗自生, 秦雨, 徐艳群, 等. 黄曲霉毒素的生物合成、代谢和毒性研究进展[J]. 食品科学, 2015, 36(3): 250-257. DOI:10.7506/spkx1002-6630-201503048.
[98] Codex Alimentarius. Codex general standard for contaminants and toxins in food and feed: Codex Stan 193-2010[S]. Codex Alimentarius Commission(CAC), 2010: 8-9[2016-03-08]. http://down.foodmate.net/standard/sort/11/3329.html.
[99] ZHAO Y R, HUANG J X, MA L Y, et al. Development and validation of a simple and fast method for simultaneous determination of aflatoxin B1 and sterigmatocystin in grains[J]. Food Chemistry, 2016,221: 11-17. DOI:10.1016/j.foodchem.2016.10.036.
[100] Food and Drug Adnimistration(FDA). Compliance policy guides aflatoxin in peanuts and peanut products: CPG Sec. 570.375[S].Maryland: U.S. Food and Drug Adnimistration(FDA), 2011: 1[2016-03-08]. https://www.regulations.gov/contentStreamer?objectId=09000 064811b3d92&disposition=attachment&contentType=pdf.
[101] GUENGERICH F P, JOHNSON W W, SHIMADA T, et al. Activation and detoxication of aflatoxin B1[J]. Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis, 1998, 402(1/2): 121-128.DOI:10.1016/S0027-5107(97)00289-3.
[102] YENER Z, CELIK I, ILHAN F, et al. Effects of Urtica dioica L. seed on lipid peroxidation, antioxidants and liver pathology in aflatoxininduced tissue injury in rats[J]. Food and Chemical Toxicology, 2008,47(2): 418-424. DOI:10.1016/j.fct.2008.11.031.
[103] PENG X, CHEN K, CHEN J, et al. Aflatoxin B1affects apoptosis and expression of Bax, Bcl-2, and Caspase-3 in thymus and bursa of fabricius in broiler chickens[J]. Environmental Toxicology, 2016,31(9): 1113-1120. DOI:10.1002/tox.22120.
[104] MOORE G G, SINGH R, HORN B W, et al. Recombination and lineage-specific gene loss in the aflatoxin gene cluster of Aspergillus flavus[J]. Molecular Ecology, 2009, 18(23): 4870-4887. DOI:10.1111/j.1365-294X.2009.04414.x.
[105] DU W, OBRIAN G R, PAYNE G A. Function and regulation of aflJ in the accumulation of aflatoxin early pathway intermediate in Aspergillus flavus[J]. Food Additives and Contaminants, 2007, 24(10):1043-1050. DOI:10.1080/02652030701513826.
[106] 孙长坡, 常晓娇, 伍松陵, 等. 利用PCR-RFLP方法鉴别黄曲霉毒素产毒菌株[J]. 中国农业科学, 2014, 47(18): 3675-3683. DOI:10.3864/j.issn.0578-1752.2014.18.015.
[107] EHRLICH K C, MACK B M, WEI Q J, et al. Association with AflR in endosomes reveals new functions for AflJ in aflatoxin biosynthesis[J].Toxins (Basel), 2012, 4(12): 1582-1600. DOI:10.3390/toxins4121582.
[108] AL-SAAD L A, AL-BADRAN A I, AL-JUMAYLI S A, et al. Impact of bacterial biocontrol agents on aflatoxin biosynthetic genes, aflD and aflR expression, and phenotypic aflatoxin B1production by Aspergillus flavus under different environmental and nutritional regimes[J].International Journal of Food Microbiology, 2015, 217: 123-129.DOI:10.1016/j.ijfoodmicro.2015.10.016.
[109] MINTO R E, TOWNSEND C A. Enzymology and molecular biology of aflatoxin biosynthesis[J]. Chemical Reviews, 1997, 97(7): 2537-2556. DOI:10.1021/cr960032y.
[110] YABE K, NAKAJIMA H. Enzyme reactions and genes in aflatoxin biosynthesis[J]. Applied Microbiology and Biotechnology, 2004,64(6): 745-755. DOI:10.1007/s00253-004-1566-x.
[111] PAYNE G A, BROWN M P. Genetics and physiology of aflatoxin biosynthesis[J]. Annual Review of Phytopathology, 1998, 36: 329-362. DOI:10.1146/annurev.phyto.36.1.329.
[112] CHANG P K, SCHARFENSTEIN L L, EHRLICH K C, et al. The Aspergillus flavus fluP-associated metabolite promotes sclerotial production[J]. Fungal Biology, 2016, 120(10): 1258-1268.DOI:10.1016/j.funbio.2016.07.010.
[113] ARRUS K, BLANK G, ABRAMSON D, et al. Aflatoxin production by Aspergillus flavus in Brazil nuts[J]. Journal of Stored Products Research, 2005, 41(5): 513-527. DOI:10.1016/j.jspr.2004.07.005.
[114] GALLO A, SOLFRIZZO M, EPIFANI F, et al. Effect of temperature and water activity on gene expression and aflatoxin biosynthesis in Aspergillus flavus on almond medium[J]. International Journal of Food Microbiology, 2016, 217(1): 162-169. DOI:10.1016/j.ijfoodmicro.2015.10.026.
[115] LAHOUAR A, MARIN S, CRESPO-SEMPERE A, et al. Effects of temperature, water activity and incubation time on fungal growth and aflatoxin B1 production by toxinogenic Aspergillus flavus isolates on sorghum seeds[J]. Revista Argentina de Microbiologia, 2016, 48(1):78-85. DOI:10.1016/j.ram.2015.10.001.
[116] GIORNI P, BATTILANI P, PIETRI A, et al. Effect of awand CO2level on Aspergillus flavus growth and aflatoxin production in high moisture maize post-harvest[J]. International Journal of Food Microbiology, 2007, 122(1/2): 109-113. DOI:10.1016/j.ijfoodmicro.2007.11.051.
[117] BOVO F, FRANCO LT, ROSIM RE, et al. Ability of a Lactobacillus rhamnosus strain cultured in milk whey based medium to bind aflatoxin B1[J]. Food Science and Technology, 2014, 34(3): 566-570.DOI:10.1590/1678-457x.6373.
[118] ZUO R Y, CHANG J, YIN Q Q, et al. Effect of the combined probiotics with aflatoxin B1-degrading enzyme on aflatoxin detoxification, broiler production performance and hepatic enzyme gene expression[J]. Food and Chemical Toxicology, 2013, 59(8): 470-475. DOI:10.1016/j.fct.2013.06.044.
[119] KIM S, LEE H, LEE S, et al. Invited review: microbe-mediated aflatoxin decontamination of dairy products and feeds[J]. Journal of Dairy Science, 2017, 100(2): 871-880. DOI:10.3168/jds.2016-11264.
[120] MALLOZZI M A B, CORRÊA B, HARAGUCHI M, et al. Effect of flavonoids on Aspergillus flavus growth and aflatoxin production[J].Revista De Microbiologia, 1996, 27(3): 161-165.
[121] NORTON R A. Inhibition of aflatoxin B1biosynthesis in Aspergillus flavus by anthocyanidins and related flavonoids[J]. Journal of Agricultural and Food Chemistry, 1999, 47(3): 1230-1235.DOI:10.1021/jf980995t.
[122] ZHOU W, HU L B, ZHAO Y, et al. Inhibition of fungal aflatoxin B1 biosynthesis by diverse botanically-derived polyphenols[J].Tropical Journal of Pharmaceutical Research, 2015, 14(4): 605-609.DOI:10.4314/tjpr.v14i4.7.
[123] GHANEM I, ORFI M, SHAMMA M. Effect of gamma radiation on the inactivation of aflatoxin B1in food and feed crops[J]. Brazilian Journal of Microbiology, 2008, 39(4): 787-791. DOI:10.1590/S1517-83822008000400035.
[124] WOMACK E D, BROWN A E, SPARKS D L. A recent review of non-biological remediation of aflatoxin-contaminated crops[J].Journal of the Science of Food and Agriculture, 2014, 94(9): 1706-1714. DOI:10.1002/jsfa.6520.